心脏结构及功能对非体外循环冠状动脉旁路移植术后心房颤动的影响
韩宏光 王辉山 金 岩 于 岩 赵 洋 李晓密 徐莉莹
(中国人民解放军沈阳军区总医院心外科,沈阳市 110016,E-mail:317482615@qq.com)
论著·临床研究
心脏结构及功能对非体外循环冠状动脉旁路移植术后心房颤动的影响
韩宏光 王辉山 金 岩 于 岩 赵 洋 李晓密 徐莉莹
(中国人民解放军沈阳军区总医院心外科,沈阳市 110016,E-mail:317482615@qq.com)
目的 探讨心脏结构及功能对非体外循环冠状动脉旁路移植术(OPCAB)术后心房颤动(AF)发生的影响。方法 回顾性分析330例行OPCAB患者的临床资料,165例术后发生AF的患者作为心房颤动组(AF组),非AF患者165例作为非心房颤动组(NAF组),记录两组患者临床基本资料以及心脏彩超指标,单因素分析中有统计学意义的因素进入多因素logistic回归分析,以分析影响OPCAB术后AF发生的危险因素。采用受试者工作特征(ROC)曲线评价该独立危险因素预测OPCAB术后AF发生的诊断效能。结果 AF组患者左房内径、左室舒张末容积、合并二尖瓣关闭不全者大于NAF组,左室射血分数小于NAF组(P<0.05)。多因素logistic回归分析结果显示,左房内径是OPCAB术后心房颤动的独立危险因素(P<0.05)。左房内径预测OPCAB术后AF的ROC曲线下面积为0.729,敏感度为68.8%,特异度为66.8%。结论 左房内径是OPCAB术后AF发生的独立危险因素,左室收缩功能、左室舒张末容积、二尖瓣关闭不全可能影响OPCAB术后心房颤动的发生。
冠心病;非体外循环;冠状动脉旁路移植术;心房颤动;术后;心脏结构;心脏功能;危险因素
冠心病是目前危害人类健康的最常见疾病之一,其严重降低患者的生存质量[1]。作为治疗冠心病最有效的方法之一,冠状动脉旁路移植术(coronary artery bypass grafting,CABG)数量逐年增加。随着手术技术及监护质量的不断提高,其术后并发症的发生率呈逐年下降趋势[1-4],但术后心房颤动(atrial fibrillation,AF)的发生率却居高不下,20%~40%[3-6]。国内外研究普遍认为术后AF的发生与多种因素有关[7-9]。术后AF常常引起血流动力学紊乱,减少心肌供血,增加心肌耗氧量,诱发心肌梗死,延长住院时间,增加住院费用,致残率、致死率较高。超声心动图是目前临床上最常用的评价心脏结构及功能的方法。本研究通过探讨心脏不停跳冠状动脉旁路术(off-pump coronary artery bypass,OPCAB)术后心脏结构、功能与心房颤动发生的关系,为临床治疗提供可靠的参考。
1 资料与方法
1.1 临床资料 回顾性分析2012年1月至2014年12月在我科行OPCAB的冠心病患者的临床资料,所有患者均经冠状动脉造影确诊。选取OPCAB术后心房颤动患者165例作为心房颤动组(AF组),非心房颤动患者165例作为非心房颤动组(NAF组)。AF组中男91例,女74例,年龄43~72(66.4±8.5)岁;合并疾病为:高血压73例,糖尿病58例,脑血管病15例,慢性阻塞性肺疾病6例。NAF组中男87例,女78例,年龄45~76(66.1±7.9)岁;合并疾病为:高血压65例,糖尿病55例,脑血管病史13例,慢性阻塞性肺疾病5例。全部患者至少术前1周停用阿司匹林和(或)氯吡格雷,术前服用β-受体阻滞剂、硝酸酯类、钙离子通道阻滞剂、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)或血管紧张素Ⅱ受体拮抗剂(angiotensin Ⅱ receptor antagonist,ARB)类等药物的患者于手术当日停药。两组年龄、性别、合并高血压、糖尿病、冠心病、术前用药等资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
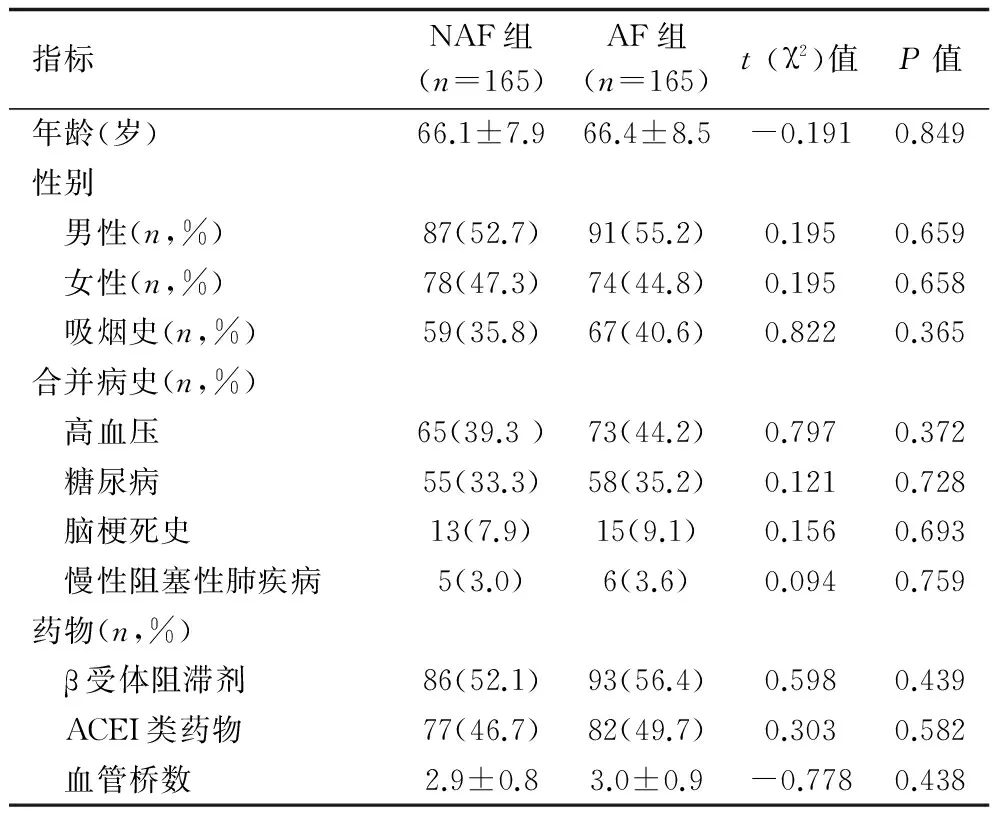
表1 两组临床资料比较
1.2 AF诊断标准 AF诊断依据2014年美国心脏协会、美国心脏病学会及美国心律学会制定的《美国心房颤动患者管理指南》[10]:(1)ECG:RR间期绝对不规则;(2) ECG:P波不明显,特别是在V1导联会出现一些近似规则的心房电活动;(3) 心房颤动周期,例如两次AF的间隔一般<200 ms,频率>300次/min。
1.3 纳入标准 (1)两均为首次实施单纯OPCAB手术择期患者;(2)AF组患者符合上述心房颤动的诊断标准且心房颤动持续时间≥l0min;发作时程较短,可自行转为窦性心律、药物干预或电复律治疗可转为窦性心律者;(3)两组患者均有自主行为能力,能理解并配合实验的进行,签署知情同意书,并我院医学伦理会同意。
1.4 排除标准 (1)既往有心房颤动病史、病态窦房结综合征、房室传导阻滞病史者;(2)心梗后合并室间隔穿孔、室壁瘤的患者;(3)合并有心脏瓣膜疾病、先天性心脏病等器质性心脏病者;(4)甲状腺功能亢进或减低及甲状腺结节等甲状腺疾病患者,术前严重的感染、电解质紊乱者,严重的肝肾功能不全者;(5)术后住院期间(1~3周)死亡者、合并有恶性肿瘤等其他严重影响患者预后的疾病患者,精神异常或法律上的残疾患者。
1.5 心脏超声检查 于手术前1 d清晨,采用飞利浦IE33型彩色多普勒超声诊断仪对患者进行心脏超声检查。经胸骨左缘第二肋间左室长轴切面在心脏收缩期测量左房内径(left atrial dimension,LAD)、左室收缩末期内径(left ventricular end-systolic dimension,LVESD);于舒张期测量左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、室间隔厚度(interventricular septal thickness,IVST)、左室后壁厚度(left ventricular posterior wall thickness,LVPWT)、右室内径;经Simpson法估算左室舒张末容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末容积(left ventricular end-systolic volume,LVESV)、左室射血分数(left ventricular ejection fraction,LVEF)、左室横径缩短率(fraction shortening,FS);心尖四腔切面观察二尖瓣、三尖瓣的瓣膜情况,包括二尖瓣关闭不全(mitral insufficiency,MI)、二尖瓣狭窄(mitral stenosis,MS)、三尖瓣关闭不全(tricuspid insufficiency,TI)、三尖瓣狭窄(tricuspid stenosis,TS);心尖五腔切面观测主动脉的瓣膜情况,包括主动脉瓣关闭不全(aortic insufficiency,AI)、主动脉瓣狭窄(aortic stenosis,AS)。
1.6 OPCAB术后患者心房颤动的处理 排除发热、疼痛、低血容量、低钾血症、尿潴留等原因后,积极给予药物治疗(胺碘酮、去乙酰毛花苷)或电复律。药物治疗指征及方法:心室率<140次/min,无严重血流动力学障碍者,在保证血钾水平≥4.5 mmol/L后,给予快速静脉泵入胺碘酮150 mg,继之以0.5~1.0 mg/(kg·h)持续静脉泵入;心室率达到目标要求或复律成功者,根据心室率调整胺碘酮用量,2 d内无复发者,改口服用药,0.2 g/次,3次/d;1周后减为2次/d;再一周可减为1次/d,稳定后停用。电复律指征及方法:心房颤动心律,心室率>140次/min,伴随血流动力学障碍。可先予25%硫酸镁1.0 g加入20 ml 5%葡萄糖溶液静脉输液泵泵入后给予1~2 J/kg行心脏同步电复律,复律成功者静脉持续泵入胺碘酮0.5~1.0 mg/(kg·h),复律失败者再予药物转律治疗。1.7 统计学分析 应用SPSS19.0软件进行统计学分析。计量资料以(x±s)表示,采用独立样本t检验;计数资料比较采用χ2检验;多因素分析采用多因素logistic回归模型;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析诊断指标的诊断效能,根据Youden指数最大的切点确定最佳临界点。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者超声心脏结构及功能的比较 AF组比NAF组LAD明显增大(P<0.05), 且合并二尖瓣关闭不全者比例大于NAF组(P<0.05);AF组LVEDV大于NAF组(P<0.05),LVEF低于NAF组(P<0.05)。见表2和表3。

表2 两组患者超声指标比较(x±s)

表3 两组患者瓣膜病变发生情况比较(n,%)
2.2 OPCAB术后AF的多因素logistic回归分析 以OPCAB术后AF为因变量(赋值:AF=1,无AF=0),以2.2中有统计学意义的心脏超声指标LAD、LVEF、LVEDV、MI(MI者赋值为1,无MI者赋值为0;其余指标为连续变量)为自变量进行多因素logistic回归分析,结果显示LAD是OPCAB术后心房颤动的独立危险因素(P<0.05),见表4。
2.3 LAD预测OPCAB术后AF因素的ROC曲线分析 ROC曲线结果显示,LAD预测OPCAB术后AF的ROC曲线下面积为0.729(95%CI:0.665,0.793;P<0.001),Youden指数最大的切点是37.5 mm,其敏感度为68.8%,特异度为66.8%。见图1。

表4 OPCAB术后AF的多因素logistic回归分析

图1 LAD预测OPCAB术后心房颤动的ROC曲线
3 讨 论
OPCAB是一种用于替换梗阻的冠状动脉以彻底重建血管的治疗方法,用以增加缺血心肌血液供应,有效解除或缓解心绞痛症状、改善患者运动耐力、提高生活质量,是目前国际上公认的治疗冠心病最有效的方法[11]。近年来,非体外循环冠状动脉旁路移植术后AF研究一直备受关注。AF是OPCAB术后早期最常见的并发症之一,常发生于术后1~5 d,尤多见于1~3 d。本研究AF组165例患者中有126例发生于术后1~3 d,占全组的76.3%。术后AF可引起患者血流动力学紊乱,使脑卒中风险和病死率上升,增加患者的住院时间和医疗费用。部分药物(如他汀类药、β受体阻滞剂)虽可以预防术后AF,降低其发生率,但是并不能同时降低患者的病死率及住院时间[12]。临床研究结果表明,CABG术后AF的发生受多种因素的影响,但其发生具体机制目前尚未明确[13]。目前国际上普遍公认的发生机制主要包括3个方面,即心房功能失调、手术过程中的直接损伤和术后患者内环境紊乱[13-16]。而心房功能失调又与心脏结构改变密切相关,因此,研究术后AF与心脏结构功能改变相关性,对其及早预防,降低其发生率有着极为重要的意义。
本研究结果显示,LAD扩大是OPCAB术后AF的一个独立危险因素(P<0.05)。Vaziri等[17]指出,LAD可预测术后AF发生。LAD>40 mm的术后发生AF的概率明显增加,LAD每增加5 mm,AF的发生率则会增加1.4倍。研究表明AF的电重构、组织重构与心腔的结构及功能密切相关,以LAD尤甚[18],左心房压力会随着左心房增大而增大,出现兴奋性异常和心肌自律性,其还会引起电机械重构,导致不同区域的心肌细胞电活动不均一,可能产生AF发生的电生理基础——折返。Cox等[19]提出心房扩大的患者术后有5%的AF发生率,这是因为心房扩大导致不应期离散度增加,诱发OPCAB术后心房颤动。另外手术操作造成心房缺血,进一步加剧心房不应期离散度的不均一,更容易诱导AF发生。采用ROC曲线分析LAD预测患者术后出现AF的效能,结果显示LAD为37.5 mm时,ROC曲线下面积为0.729,敏感度为68.8%,特异度为66.8%,提示LAD在心房颤动预测方面具有一定的价值。
本研究中AF组 LVEF显著低于NAF组(P<0.05),提示LVEF降低能促进心房颤动的发生。LVEF是指左室每次搏动输出的血容量占舒张末期左室血容量的百分比。人体安静时,LVEF的正常范围为55%~65%。心肌收缩能力越强,则每搏输出量越多,射血分数也越大。术前左心功能差的患者往往存在心房内压力增高、心房扩大、心肌缺血、肾素-血管紧张素-醛固酮系统失衡导致的水、电解质紊乱[20];而代偿性增加的血管紧张素和儿茶酚胺可使心房纤维化增强,改变心房的传导性,以上均为心房颤动发生的诱发因素。
MI是二尖瓣的解剖结构和(或)功能上的异常导致心脏收缩期左室内的部分血液返流到左房。本研究结果显示,合并二尖瓣关闭不全者比例大于NAF组(P<0.05),考虑与二尖瓣关闭不全导致收缩期左室射出的血返流到左房,使舒张期返流入左室的血流增多,使左室舒张末压力增高,左室压力增高传导至左房,引起左房压力增高,长期则导致左房内径增大,左房结构改变有关。
虽然AF是指心房节律的不规则,但左室结构异常与AF也有着密切的联系。本研究显示AF组LVEDV高于NAF组(P<0.05),提示LVEDV增高可能影响术后AF发生的因素之一。LVEDV是指舒张末期心脏的血容量,它是反映心功能的指标之一,由左室在舒张末期的压力及心脏扩大程度决定,它间接反映了左室舒张末期的压力。AF患者左室压力升高可能会导致左室舒张功能异常,而且还会引起左房压力传导性增高,长期则导致左房结构的异常。另一方面,左房增大可能与左室舒张末期容积改变有关。LVEDV高的患者常合并左室舒张功能异常,而后者会引起左室压力上升,作用于心房壁和肺静脉的张力受体,或者直接引起心房肌结构的改变,而心房肌结构的改变与术后AF的发生密切相关,因此LVEDV增大可能是影响术后OPCABAF发生的一个重要因素。
OPCAB术后患者发生AF的相关因素众多,机制复杂,除国内外研究普遍证实与心脏结构重塑和心房电重构相关外,还存在自主神经张力变化所造成的神经源性AF。另外,随着心房波波长减小,使心房内容易发生多发折返,使心房颤动产生自我维持的趋势,产生“心房颤动致心房颤动”现象[21-22]。因此,对AF的研究将是一项复杂、长期、多元的过程,未来本研究组还将进一步通过电生理等多方面进行OPCAB术后AF相关研究,以期为临床诊治提供重要的参考。
[1] 王 文,朱曼璐,王拥军,等.《中国心血管病报告2012》概要[J].中国循环杂志,2013,28(6):408-412.
[2] Benedetto U,Ng C,Frati G,et al.Miniaturized extracorporeal circulation versus off-pump coronary artery bypass grafting:a meta-analysis of randomized controlled trials[J].Int J Surg,2015,14:96-104.
[3] Philip F,Becker M,Galla J,et al.Transient post-operative atrial fibrillation predicts short and long term adverse events following CABG[J].Cardiovasc Diagn Ther,2014,4(5):365-372.
[4] Mostafa A,El-Haddad MA,Shenoy M,et al.Atrial fibrillation post cardiac bypass surgery[J].Avicenna J Med,2012,2(3):65-70.
[5] Pilatis ND,Anyfantakis ZA,Spiliopoulos K,et al.The role of BNP and CRP in predicting the development of atrial fibrillation in patients undergoing isolated coronary artery bypass surgery[J].ISRN Cardiol,2013,2013:235 018.
[6] Chang NS,Hsu LJ,Lin YS,et al.WW domain-containing oxidoreductase:a candidate tumor suppressor[J].Trends Mol Med,2007,13(1):12-22.
[7] Jensen PN,Thacker EL,Dublin S,et al.Racial differences in the incidence of and risk factors for atrial fibrillation in older adults:the cardiovascular health study[J].J Am Geriatr Soc,2013,61(2):276-280.
[8] Al-Shaar L,Schwann TA,Kabour A,et al.Increased late mortality after coronary artery bypass surgery complicated by isolated new-onset atrial fibrillation:a comprehensive propensity-matched analysis[J].J Thorac Cardiovasc Surg,2014,148(5):1 860-1 868.
[9] Guo Y,Hu S,Wu Q,et al.Predictors of atrial fibrillation after coronary artery bypass graft surgery[J].Chin Med J,2002,115(2):232-234.
[10]January CT,Wann LS,Alpert JS,et al.2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society[J].Circulation,2014,130(23):2 071-2 104.
[11]Hillis LD,Smith PK,Anderson JL,et al.2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery:executive summary:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J].Circulation,2011,124(23):2 610-2 642.
[12]沈童童,单其俊,袁 彪,等.冠状动脉旁路移植术后心房颤动的发生率及其危险因素分析[J].中国心脏起搏与心电生理杂志,2007,21(3):215-216.
[13]Sánchez-Quintana D,López-Mínguez JR,Pizarro G,et al.Triggers and anatomical substrates in the Genesis and perpetuation of atrial fibrillation[J].Curr Cardiol Rev,2012,8(4):310-326.
[14]Akkaya M,Higuchi K,Koopmann M,et al.Higher degree of left atrial structural remodeling in patients with atrial fibrillation and left ventricular systolic dysfunction[J].J Cardiovasc Electrophysiol,2013,24(5):485-491.
[15]Kumar S,Teh AW,Medi C,et al.Atrial remodeling in varying clinical substrates within beating human hearts:relevance to atrial fibrillation[J].Prog Biophys Mol Biol,2012,110(2-3):278-294.
[16]Fuchs T,Baron EL,Leitman M,et al.Does chronic atrial fibrillation induce cardiac remodeling?[J].Echocardiography,2013,30(2):140-146.
[17]Vaziri SM,Larson MG,Benjamin EJ,et al.Echocardiographic predictors of nonrheumatic atrial fibrillation.The Framingham Heart Study[J].Circulation,1994,89(2):724-730.
[18]Nardi F,Diena M,Caimmi PP,et al.Relationship between left atrial volume and atrial fibrillation following coronary artery bypass grafting[J].J Card Surg,2012,27(1):128-135
[19]Cox JL.A perspective of postoperative atrial fibrillation in cardiac operations[J].Ann Thorac Surg,1993,56(3):405-409.
[20]顾 松,苏丕雄,刘 岩,等.冠状动脉旁路移植术后心房颤动的高危因素分析[J].中华心律失常学杂志,2002,6(4):207-210.
[21]Wijffels MC,Kirchhof CJ,Dorland R,et al.Atrial fibrillation begets atrial fibrillation.A study in awake chronically instrumented goats[J].Circulation,1995,92(7):1 954-1 968.
[22]Allessie MA.Atrial electrophysiologic remodeling:another vicious circle?[J].J Cardiovasc Electrophysiol,1998,9(12):1 378-1 393.
Effects of cardiac structure and function on atrial fibrillation after off-pump coronary artery bypass grafting
HANHong-guang,WANGHui-shan,JINYan,YUYan,ZHAOYang,LIXiao-mi,XULi-ying
(DepartmentofCardiovascularSurgery,GeneralHospitalofShenyangMilitaryRegion,Shenyang110016,China)
Objective To investigate the effects of cardiac structure and function on the incidence of atrial fibrillation(AF) after off-pump coronary artery bypass grafting(OPCAB).Methods The clinical data of 330 patients undergoing OPCAB were analyzed retrospectively.A total of 165 patients with AF after OPCAB were enrolled as AF group,and 165 patients without AF after OPCAB as non-AF(NAF) group.The clinical basic data and indices of echocardiography were recorded in the two groups.The factors with statistical difference in univariate analysis were enrolled in multivariate logistic regression analysis for analyzing the risk factors influencing the incidence of AF after OPCAB.Receiver operating characteristic(ROC) curve was used to assess the diagnostic performance of independent risk factors for predicting the incidence of AF after OPCAB.Results The levels of left atrial dimension(LAD),left ventricular end-diastolic volume(LVEDV) and mitral insufficiency(MI) were significantly higher,and left ventricular ejection fraction(LVEF) decreased in AF group compared to NAF group(P<0.05).The result of multivariate logistic regression analysis showed that LAD was the independent risk factor for AF after OPCAB(P<0.05).The area under ROC curve,sensitivity and specificity of LAD for predicting AF after OPCAB were 0.729,68.8% and 66.8% respectively.Conclusion LAD is the independent risk factor for AF after OPCAB,and LAD,LVEF,LVEDV and MI are the factors probably influencing the incidence of AF after OPCAB. 【Key words】 Coronary heart disease,Off-pump,Coronary artery bypass grafting,Atrial fibrillation,Postoperation,Cardiac structure,Cardiac function,Risk factor
韩宏光(1972~),男,博士,主任医师,研究方向:心血管外科重症监护。
王辉山(1965~),男,博士,主任医师,研究方向:危重冠心病外科,E-mail:hanxiyao@163.com。
R 654.2
A
0253-4304(2016)06-0809-05
10.11675/j.issn.0253-4304.2016.06.16
2016-02-18
2016-05-03)

