脑深部刺激适应症局部场电位节律特征研究进展
陈 玥 钱 星 郝红伟# 李路明,2#*
1(神经调控技术国家工程实验室,北京 100084)2(北京脑重大疾病研究院癫痫研究所,北京 100093)
脑深部刺激适应症局部场电位节律特征研究进展
陈 玥1钱 星1郝红伟1#李路明1,2#*
1(神经调控技术国家工程实验室,北京 100084)2(北京脑重大疾病研究院癫痫研究所,北京 100093)
脑深部电刺激(DBS)作为一种植入性的神经调控技术,在治疗脑功能障碍的同时,也为研究人员打开了局部场电位(LFP)探究大脑的窗口。基于美国食品药品监督管理局(FDA)批准的4种DBS适应症,包括帕金森病、肌张力障碍、特发性震颤和强迫症的治疗现状和致病机理假说,重点总结上述疾病患者相关脑区LFP的Theta节律、Alpha节律、Beta节律,Gamma节律以及更高频段节律的特征,分析各种节律与临床症状及行为的关联,得到DBS刺激靶点或相关脑区的LFP节律能够显著反映疾病特征的结论,还介绍首例实时全植入式的LFP研究工具和其最新研究结果。这些LFP特征为后续的病理研究、DBS机制探索和新疗法改进提供理论基础。最后,基于目前LFP研究的不足之处,提出未来LFP研究在DBS神经调控领域的潜在发展方向,对神经调控领域的发展具有重要的意义。
脑深部电刺激;适应症;局部场电位;节律;神经调控
引言
脑深部刺激(deep brain stimulation,DBS)是一种神经外科治疗手段,初期多用于病灶定位[1-2],到1991年被证明可作为运动障碍疾病可靠的治疗手段[3]。随着人们对DBS认识的深入,越来越多的难治性神经类疾病开始尝试用DBS作为一种治疗方案。帕金森病(Parkinson′s disease, PD)、肌张力障碍(dystonia)、特发性震颤(essential tremor, ET)、强迫症(obsessive-compulsive disorder, OCD)是目前美国食品药品监督管理局(Food and Drug Administration, FDA)批准的4种DBS适应症。其中,前3种属于典型的运动障碍类疾病,强迫症则是目前唯一被批准DBS应用的精神障碍类疾病。研究清楚这些疾病的特征和机制,对治疗运动障碍疾病、探索大脑功能有着重要的意义。
局部场电位(local field potential,LFP)是一种细胞外场电位,可看作多个神经元细胞放电的低频部分(约300 Hz以下),能够代表大多数反映神经元群体协同活动相对缓慢(3 ms以上)事件[4]。图1说明了LFP记录的电极位置和采集模式。
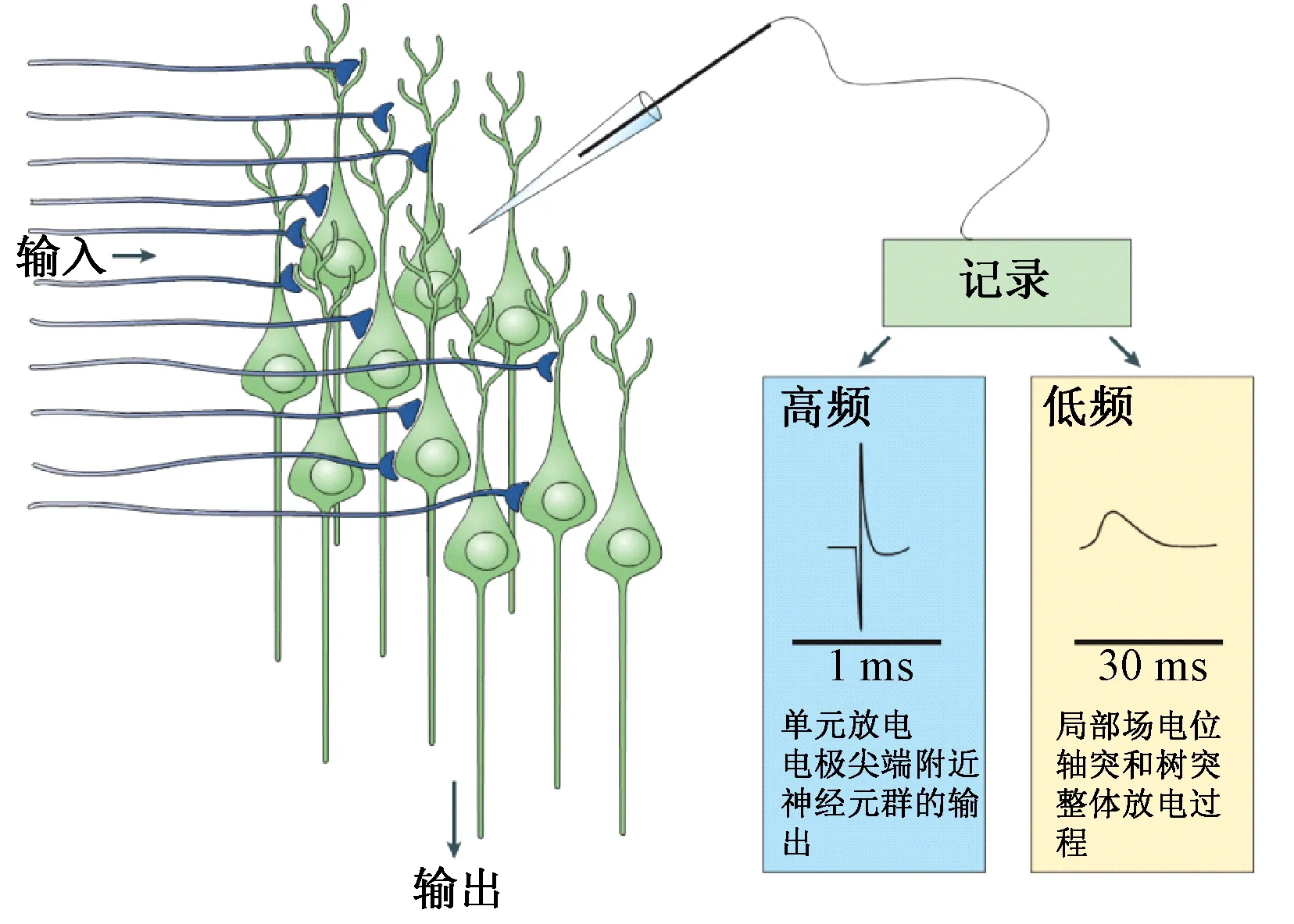
图1 局部场电位和神经元单元放电的记录方式[5]Fig.1 Recordings of LFP and neurons spikes[5].
按照脑电图(electroencephalogram,EEG)的低频信号节律分类方法,LFP低频部分通常被分为5种节律,分别是Delta(δ,0~4 Hz)节律、Theta(θ,4~8 Hz)节律、Alpha(α,8~12 Hz)节律、Beta(β,12~24/30 Hz)节律和Gamma(γ,24/30~40/80 Hz)节律[5]。研究发现,LFP不同节律的变化可以代表神经元活动的某种状态,或与疾病相关,或与大脑功能相关。DBS手术需要在脑深部植入特制的电极,从而对大脑指定区域进行电脉冲刺激[1],这一特殊的手术过程和DBS电极的条件,恰好为研究人员提供了记录上述脑深部区域LFP的机会,使得DBS适应症的LFP节律成为研究热点。2013年,带有LFP采集功能的DBS设备被全植入人体体内,“第一次真正打开了大脑的一扇窗口”[6],这将对脑疾病和脑功能的研究带来极大的促进。
在此概括了DBS适应症目前的治疗情况,对其相应的LFP节律特征研究进行了深入的分析和总结。运动障碍类疾病中以帕金森病LFP生物标记的发现最为典型。作为DBS的第四种适应症,难治性强迫症也在LFP节律活动上有所体现,值得研究者进行后续关注。下面将分别介绍这些DBS适应症的LFP节律特征研究进展。
1 帕金森病
帕金森病,作为最常见的一种神经退行性疾病,影响着世界上65岁以上老年人口的1%~2%[7]。其主要症状包括静止性震颤、运动迟缓、僵直和运动不能,晚期或伴有中线症状。近年来,帕金森病的发病率持续增长,且呈现年轻化的趋势,在医学研究界引起了高度重视。1997年,FDA批准丘脑深部电刺激治疗帕金森病的震颤症状;2002年,FDA批准丘脑底核电刺激治疗帕金森病的其他症状;2003年,苍白球电刺激治疗帕金森病也被FDA批准。与帕金森病直接相关的脑神经区域是基底节及其周围组织,基底节的损伤或功能的异常导致了帕金森病的产生。1990年,Michael D. Crutcher和Mahlon R. Delong分别发表在TINS的两篇文章[8-9]正式提出基底节-丘脑-皮层回路模型的工作机理及致病机制的假说。纹状体致密区的多巴胺分泌减少后,基底节中的直接通路被抑制,间接通路被激活,二者平衡的破坏导致丘脑底核(subthalamic nucleus, STN)和苍白球内侧(globus pallidus internus, GPi)均产生异常的兴奋,进而抑制了丘脑和大脑皮层运动区的神经元活动,造成了运动迟缓、僵直或运动不能的出现。这一假说的建立,为DBS靶点的选择提供了理论依据,也对运动障碍以及涉及基底节功能的精神障碍的病理提供了解释,成为后续计算神经科学仿真、相关疾病研究的理论基础。
1.1 Beta节律
LFP的记录一直伴随着基底节的探索,在证明相关环路的同时,也揭开了帕金森病脑深部电活动的神秘面纱。Beta振荡作为帕金森病运动迟缓、僵直或运动不能症状的生物标记,已被越来越多的研究者认可。Beta节律的变化最早是通过多巴胺药物作用前后对比发现的,处于药物关期的帕金森病患者的STN和GPi放电相关性显著,LFP的Beta频段在频域上均呈现出明显的峰值[10]。这一发现填补了帕金森病患者LFP同步电活动研究的空白,对后续生物标记的发现提供了基础。此后,Beta节律被进一步证明存在于相关大脑皮层[11]和连接大脑皮层和基底节的桥梁——纹状体中[12]。在接下来的研究中,药物引起的僵直和运动迟缓症状的改善,与Beta节律的抑制程度被明确为正相关关系[13-14]。类似的,DBS作用后也使得STN和GPi的Beta节律显著降低[15-16]。研究发现DBS刺激参数与Beta节律的抑制程度存在定量关系,高频电刺激(>100 Hz)的刺激幅值越高,Beta节律的抑制效果越明显[16-17],如图2所示。当刺激频率越高时,神经元放电的抑制强度也越大[18]。上述研究从药物和DBS两种疗法出发,论证了Beta节律与临床症状改善的关系。Beta节律在治疗前后、个体之间较为稳定的可复现性,是其作为临床症状的电生理生物标记最基本的实验基础。
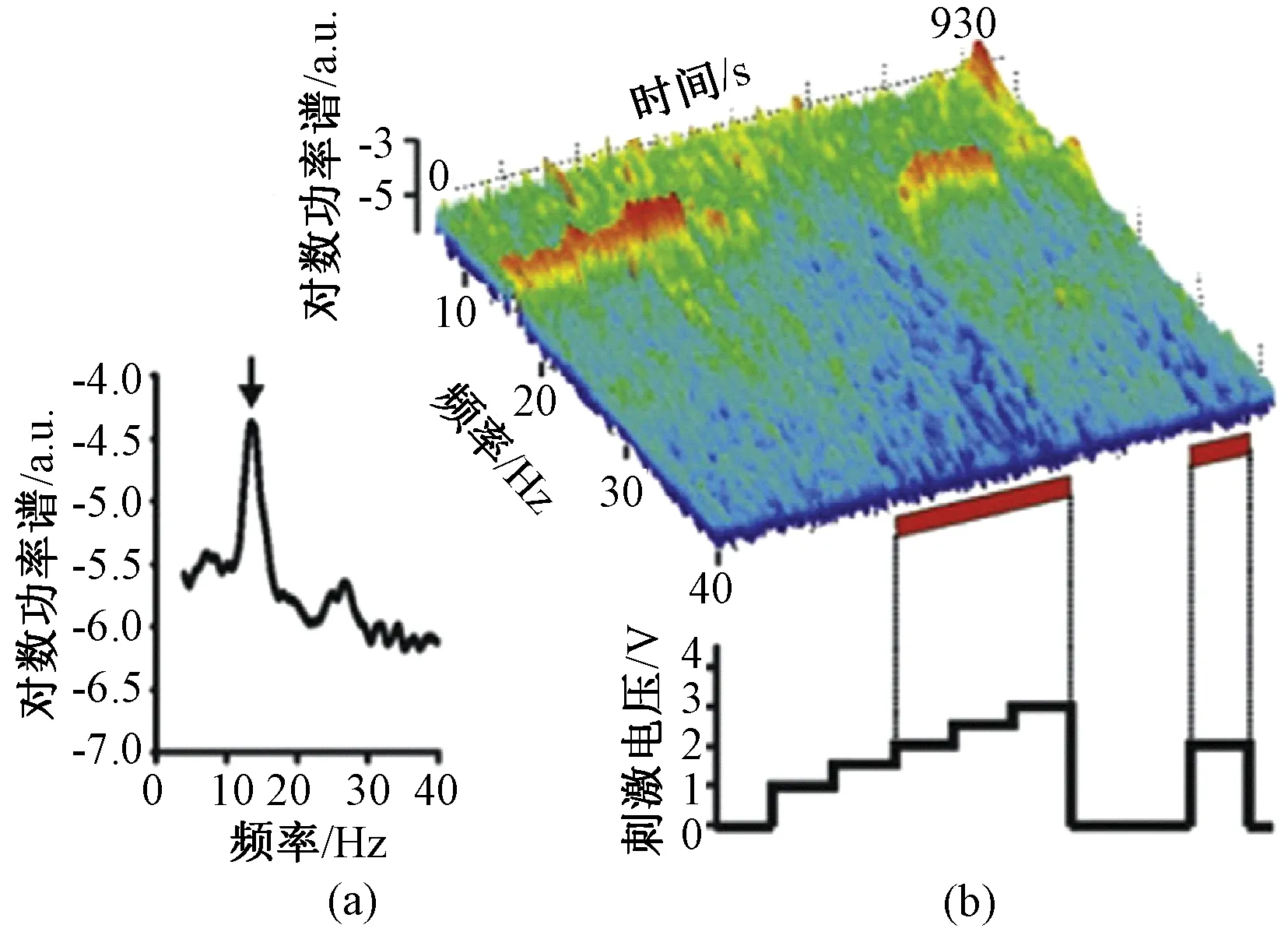
图2 帕金森病患者STN的局部场电位记录[19]。(a)静息状态下LFP功率谱表现出的Beta节律;(b)时频分析显示逐渐增加DBS刺激幅值可以抑制Beta节律,关闭刺激后Beta节律立刻出现Fig.2 LFP recorded from STN of PD patients[19]. (a) Beta oscillation in the power spectrum of LFP recorded without stimulation. (b) Time-frequency analysis shows that as stimulation amplitude increases, beta rhythm is gradually suppressed. Once DBS is turned off, beta rhythm recovered immediately
有关运动功能的实验进一步证明Beta节律确实是一种运动功能减退性症状的生物标记。主动运动包括运动的准备、运动指令的发出和运动的完成,可分解为前馈运动和感觉反馈运动,后两者分别可以用想象运动和被动运动来模拟。通过对事件相关的LFP研究发现,主动运动的发生会伴随基底节Beta节律活动的减弱[20-21],被动运动和想象运动的发生也可以得到类似的结果,但抑制程度相对较低[22-24]。上述结果说明基底节的Beta节律与整个运动过程密切相关。
采用新型带有感知功能的DBS设备,可以实现全植入体内部后利用传统DBS宏电极记录脑深部区域的LFP信号。体内脉冲发生器通过特制的天线,将数据实时传输至体外计算机存储。图3为带有LFP感知功能的DBS系统示例(G102RS,北京品驰医疗设备有限公司)。该方法能够实现患者在各种状态下LFP灵活的记录,并能在DBS开启刺激的同时获取电刺激对大脑即时的响应,这将成为研究大脑功能的有力手段[25-26]。

图3 带有感知功能的DBS系统示意图Fig.3 Schematic of the DBS with the ability of LFP sensing
目前,笔者所属团队已经完成了G102RS整套系统的研发,并完成了首例临床实验。接受植入手术的帕金森病患者,年龄57岁,性别男,PD病史14年,左侧曾接受GPi毁损术,DBS治疗史6年,临床症状以僵直为主,并伴有震颤。在完成刺激器更换手术后,采集到患者双侧STN的静息态LFP信号,如图4(a)所示。利用加窗的傅里叶变换进行功率谱密度估计,得到信号在频域的表现,如图4(b)所示。从频谱中可以看到,患者双侧STN中存在较明显的Beta节律振荡,其中未毁损GPi的右侧STN更为显著。

图4 带感知功能的DBS临床LFP采集结果。(a)双侧STN时域LFP信号;(b)LFP功率谱估计Fig.4 The LFP signal collected by G102RS of the first clinical trial. (a) LFP time serials of bilateral STN; (b) Bilateral LFP power spectrum estimation
1.2 Gamma节律和高频节律
随着认识的深入,基底节其他节律活动所代表的意义也在逐步清晰,其中具有代表性的是Gamma节律。与Beta节律相反,研究显示Gamma节律可能是一种促进运动的节律活动[27]。Gamma节律最早是同Beta节律一起被发现的,处于药物开期的帕金森病患者STN在70 Hz左右出现峰值[10]。患者在出现明显的震颤症状时会伴随着Gamma节律活动的增强,且其严重程度与Gamma低频段活动强度成正相关[28-29],精神压力的增大也会伴随着这一频段活动的增高[31],如图5所示。药物开期时,运动事件的发生也会伴随Gamma节律活动的增强[22]。
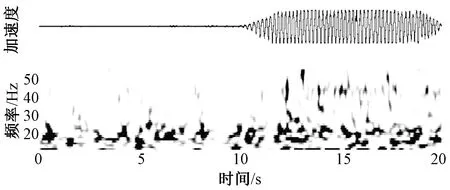
图5 帕金森病患者STN核团记录到的LFP时频分析显示Gamma节律发生在震颤出现的时期[30]Fig.5 Spectrogram of LFP in the STN of a PD patient shows that Gamma oscillation occurred and sustained during tremor [30]
基底节高频振荡(high frequency oscillation,HFO)是指相关核团脑电活动频率范围大于200 Hz的同步振荡,这一频段的同步活动与帕金森运动症状的改善相关[32-33]。与Gamma节律一起,HFO被认为是促进运动的同步活动[34-35]。
1.3 Alpha节律
在较低频的节律中,Alpha节律与帕金森震颤、异动、中线症状和高级认知功能有关。研究表明,肢体震颤节律(约5 Hz)及其倍频(约10 Hz)存在于基底节-皮层回路中[36]。在药物开期患者发生异动时,基底节中的Alpha节律也会显著升高[37]。
有些帕金森病患者在晚期会出现步态冻结,有的甚至情绪和记忆都会受到不同程度的影响。传统多巴胺药物对上述问题的治疗效果并不显著,这大大影响了患者的生活质量。其中步态冻结的患者无法开始或正常行走,容易造成跌倒,危害极大。目前关于步态冻结、情绪和记忆的病理解释还没有公认的说法。一种假说认为,步态冻结患者的脚桥核(pendunculopontine nucleus,PPN)出现退化或损伤,而基底节输出核团的异常兴奋进一步抑制了已经受损的PPN的活性,是步态冻结的原因之一[38]。PPN所涉及的其他功能与运动功能构成竞争关系,在这种情况下的基底节-PPN回路只能支撑有限的功能,使得运动皮层无法有效调用PPN,加剧了步态冻结,也影响到正常的情感和边缘系统功能。另一种假说[39]认为,帕金森病患者的基底节的感觉运动功能负责习惯性运动序列的完成,例如行走或转身。这一功能的丧失,导致本可以自动完成的运动序列,都需要依赖主动运动控制回路分解完成,而这一回路也受到基底节异常的影响,最终使得习惯性运动序列的执行出现障碍。不论上述哪一种假说,都涉及到皮层对皮层下核团的控制功能,有待实验去证明。
研究发现,患者在步态冻结时,PPN的Alpha节律能量降低,开始行走后,该节律的活动恢复[40],这为用PPN解释和治疗步态冻结提供了电生理依据。与情感、注意和记忆等大脑认知功能相关的LFP节律特征也在逐步地得到证实。如相关研究表明,STN的Alpha节律与帕金森病患者的消极情绪相关,积极情绪刺激下患者的Alpha节律去同步化比消极的情绪刺激,包括淡漠、恐惧和悲伤更要明显[41],感受到意外的惊喜时会伴随着Beta/Gamma节律活动的增强[42]。
除了上述单一节律的特征,在帕金森病患者基底节、丘脑、皮层各自内部或相互之间,LFP不同节律的耦合关系可以为研究脑网络机理和DBS机制提供更多的信息[43-45],但这类研究目前尚未形成具有一定鲁棒性的电生理特征结果。
2 肌张力障碍
与帕金森病类似,肌张力障碍也是由于基底节损伤或神经递质传导失衡造成的运动障碍类疾病。其不同之处在于,肌张力障碍的表征属于运动机能亢奋性的,表现在过高的肌张力水平、异常扭曲的动作和姿势等。肌张力障碍可能的病因来自于基因变异、基底节局灶性病变或多巴胺代谢障碍[7]。2003年,FDA正式批准DBS用于治疗肌张力障碍。
2.1 Theta和Alpha节律
虽然基底节与肌张力障碍的关系有待明确,但其LFP节律在Theta、Alpha、Beta等较低频段的特征已经初现端倪。作为DBS治疗的主要靶点,苍白球是肌张力障碍电生理记录的主要位置。研究发现,苍白球局部场电位Theta、Alpha或低Beta节律明显增强,且在GPi中尤其显著[46-48],如图6中深色谱线所示。研究人员在STN中也发现了类似的低频节律活动[49],验证了STN与GPi在结构和功能上的连接基础,为GPi和STN作为治疗靶点提供了依据。上述节律活动与患者非自主运动下的肌电具有相关性,进一步表明肌张力障碍的临床症状很可能与苍白球的低频节律有关[50-51]。
对苍白球进行高频电刺激是治疗肌张力障碍的常见手段[52-53]。研究表明,高频电刺激(130 Hz)明显地抑制了肌张力障碍患者苍白球的低频节律活动[54],如图6中浅色谱线所示。与帕金森病不同,患者的症状并不是在低频节律活动得到抑制的同时立即改善,而是滞后于LFP的反应一段时间。这表明,GPi的低频节律虽然可以作为肌张力障碍的一种疾病特征,但其背后的意义并不只局限于苍白球的功能,可能涉及到更多的回路或脑区的共同作用才导致了相应临床症状的变化。

图6 痉挛性肌张力障碍患者GPi中LFP的Theta和Alpha节律较高,并在电刺激开启后得到抑制[54]Fig.6 Mean relative spectral power of LFP in the phasic dystonia patients GPi during DBS off and on[54]
2.2 Gamma节律
肌张力障碍患者的运动状态与苍白球的Gamma节律有关。Arun Singh的一项研究表明,肌张力障碍患者在行走时,其苍白球Theta、Alpha和Gamma节律相比静止时有一定程度的增强,Beta节律有所降低[55]。其中,Gamma节律又进一步地与运动的强度、速度等运动参数呈现正相关[56],如图7所示。这与帕金森病基底节环路中Beta和Gamma节律的运动性质相一致。

图7 不同运动强度下肌张力障碍患者GPi的Gamma节律能量的变化[56]。(a)运动幅度较小时,Gamma节律的振荡较弱;(b)运动幅度较大时,Gamma节律的振荡较强Fig.7 Gamma oscillatory power changes during small and large amplitude movements [56].(a)Gamma oscillation is weak during small amplitude movements;(b)Gamma oscillation is strong during large amplitude movements
值得注意的是,不同类型的肌张力障碍基底节的频率特征虽然接近,但放电模式也会有所不同[57]。有关肌张力障碍LFP节律特征的结论还需要更多的研究来验证,但初步的结论认为,肌张力障碍在GPi和STN中的LFP节律主要集中在Theta和Alpha段。
3 特发性震颤
特发性震颤是一种常见的运动障碍,临床症状包括上肢、头部、面部/颌、声音、舌、躯干以及下肢的震颤[58]。其与帕金森病最大的不同是震颤多由运动或某种姿势引起。1997年,FDA正式批准DBS用于治疗特发性震颤。对丘脑腹中间核(ventralis intermedius,Vim)或STN进行高频电刺激能够使震颤得到有效的抑制[59-60]。
特发性震颤患者丘脑处的LFP节律与震颤节律的相干性较显著,Vim和丘脑腹侧后部(ventralis oralis posterior, Vop)的Theta、Alpha节律较强[61]。与帕金森病患者相比,特发性震颤患者Vim中的Beta节律更强,且这一节律与低频震颤节律显著相关,并在主动运动时得到显著降低[61-62]。丘脑的Alpha、Beta节律(8~27 Hz)与感觉运动皮层和相关肌肉的电活动相干性显著,且Vim中的节律活动滞后于大脑皮层和肌肉[63],对研究震颤的起源和Beta节律的功能,解释震颤发生时运动系统节律的传导过程提供了一定依据。
基于上述结果,丘脑中Alpha节律可以作为特发性震颤疾病在丘脑运动相关区域的特征。实验证明,高频电刺激(180Hz)Vim会抑制初级运动皮层的Alpha节律和感觉皮层S1区的Theta节律[64]。这一可逆的节律反应验证了丘脑和皮层之间Theta和Alpha节律的传导特性。值得注意的是,丘脑内部不同的位置,如Vim与Vop所对应LFP节律有所不同,前者以Theta、Alpha节律为主,后者还存在一定的Beta节律,这也许与特发性震颤的病理相关[35,61]。后续研究有待进一步确定这些核团的区别和功能,为精细的治疗方法提供有力的支撑。
4 强迫症
强迫症是一种神经精神障碍,主要症状为患者持续性重复浮现某种想法,为了缓解内心无法停止的焦虑而再执行某些行为或精神仪式[65]。例如,患者经常被迫地反复确认一件事情,完成整齐的排序或严谨的计数等。根据流行病学统计,强迫症的患病率为2%~3%,患者的工作、社交和家庭都受到很大的影响。2009年,FDA正式批准DBS用于治疗药物难治性强迫症。临床研究发现,电刺激内囊前肢、伏隔核、腹侧纹状体等区域能够有效改善难治性强迫症[66-68]。
强迫症患者表现出临床症状时,STN中LFP的Delta节律和Alpha节律表现较明显[69]。由于DBS在强迫症的治疗领域中开展较晚,有关强迫症患者LFP的研究较少,样本量十分有限。基于动物模型的研究发现,对伏隔核(nucleus accumbens,NAc)进行高频电刺激(130 Hz)可以增强丘脑背内侧核(mediodorsal thalamic nucleus)和NAc的Delta和Theta的节律活动[70],这些脑网络活动的改变在某种程度上反映了DBS起效的机制,为后续开展DBS治疗强迫症,研究强迫症机理提供了基础。
5 总结与展望
5.1 LFP特征与存在的问题
在此综述了DBS适应症及其局部场电位的研究进展,分析了各种节律与临床症状及行为的关联,对不同疾病的LFP节律特征进行了总结。局部场电位作为表征大脑活动的电生理信号,能够在不同功能受损的大脑中体现出差异。帕金森病的LFP研究最为深入,STN等区域的Beta频段能量的升高已经成为僵直和运动迟缓可靠的节律特征,并为初步的闭环DBS提供了生物标记[36];Gamma节律及更高频段的节律作为促进运动生物标记,与症状的关系也在逐渐清晰;基底节的其他功能可能与Alpha等低频节律之间存在潜在关系。肌张力障碍的LFP节律特征主要表现在GPi和STN核团的Theta、Alpha或低Beta节律的振荡。虽然与帕金森病所观察的核团相同,但肌张力障碍却表现出不同的节律。结合以上两种疾病的致病假说,笔者可以推测,对于不同的运动障碍疾病,基底节的节律活动会发生特定的改变。特发性震颤的特征主要是丘脑腹中间和腹后部核的Theta、Alpha节律。强迫症患者的STN中Delta、Alpha节律较为突出,但由于样本量不足还不能形成确定的结论。表1总结了上述DBS适应症在静息状态下不同脑区LFP各种节律的详细变化。
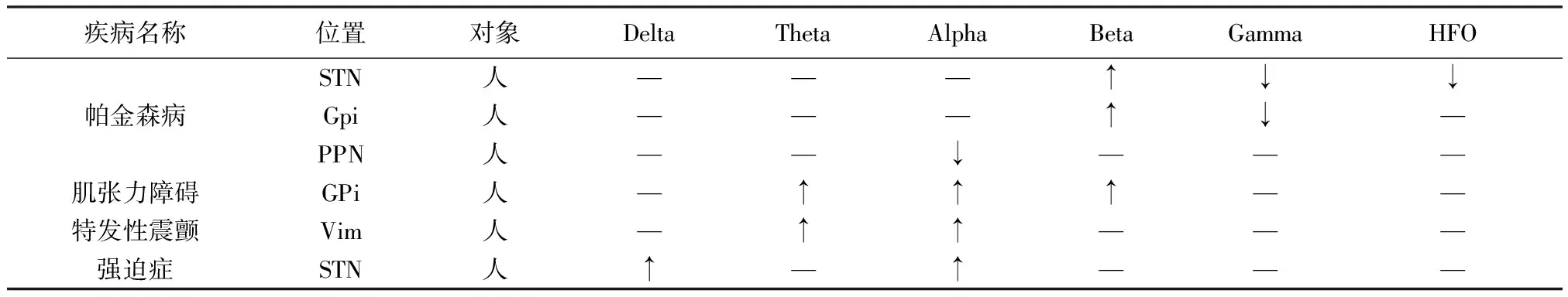
表1 不同DBS适应症静息态LFP节律特征总结
虽然笔者得到的LFP特征具有临床意义,但上述研究中的LFP记录均在术中完成,记录时间短,周期小,无法排除手术带来的创伤效应叠加的影响,临床评估时间较短。此外,据笔者所知,目前的研究几乎未涉及到LFP节律与DBS刺激频率的定量关系,对应临床症状更尚不清晰,其对神经节律调控的认识有待加深。
5.2 LFP研究前景
可以预见,越来越多的药物难治性脑功能疾病将可能被DBS缓解或治愈。这是人类认识脑功能的重要机遇。了解疾病特性,掌握DBS机制对神经调控技术至关重要。基于目前LFP节律特征研究结果和DBS技术的发展,未来LFP研究在DBS神经调控领域的潜能主要包括以下3个方面。
5.2.1 验证和完善病理假说
从目前研究最多、最深入的帕金森病来看,LFP在描述疾病特性和基底节-丘脑-皮层环路工作原理方面发挥了重要的作用,相关核团或脑区的Beta振荡、Gamma振荡与大脑功能、疾病症状之间的关系已经越来越清晰。但帕金森病是一种极其复杂的运动障碍疾病,其不同症状目前还无法用统一的模型解释,新的模型还在不断涌现,以修正和完善传统的病理模型。其他运动障碍或精神障碍疾病的病理模型也尚未形成结论,所有的假说均需要实验去验证。而在不同疾病下,甚至同一疾病不同症状下,不同功能核团或脑区的LFP的不同节律包含着丰富的信息。挖掘出这些信息背后的含义对于研究脑功能,验证相关疾病机理具有重大的意义。
5.2.2 同步植入式LFP采集技术带来的机遇
如前文所述,带有LFP感知功能的DBS目前已经进入临床实验阶段,这使得研究人员能够长期持续的记录患者的LFP信号,且全植入的性质使得患者的日常生活不会因记录而受到任何影响。这不仅可以对研究DBS适应症病程发展提供新的窗口,还可以在更加稳定、可控的状态下观察患者更多样的静息态、任务态下的大脑反应。相关研究人员已经利用该类型的装置,获得了患者或动物模型在不同姿势、不同运动形式下的LFP变化[21-23,71],在验证了这一方法可行性的同时,也为后续的研究打下了基础。
此外,这一装置还可以作为新型脑机接口的一部分,为更多的患者(如瘫痪、残障人员)提供便利。
5.2.3 新的刺激方式提供更多可能
现有的DBS刺激模式均为高频不间断刺激,不同患者或在不同临床状态下,DBS参数无法做到灵活的个性化调节,延长了DBS的程控周期。长期的高频刺激还可能给患者带来一定的副作用,DBS刺激方法亟待改善。
目前提出的新刺激方式主要包括闭环刺激和新型刺激序列两种。闭环DBS的概念已不再新鲜,相关研究人员利用外围设备根据LFP特征初步实现了有效的闭环刺激,在减少刺激副作用的同时,节省了电池电量,提高了刺激效率[19,36,72]。但这样的闭环离普及应用还有一定距离,主要原因是其系统工作需要依赖外部设备,无法独立地在患者体内实现闭环刺激。新型刺激序列的开发主要是因为现有的刺激模式无法解决全部的问题。研究表明,高频电刺激带来的中线症状的副作用,可以在低频刺激下得到改善[73]。从节律调控的角度出发,笔者所在的团队提出了根据不同运动节律损伤而调整的变频电刺激方法。初步研究结果表明,高频-低频交替电刺激能有效改善帕金森病患者的步态冻结[74],这为DBS新刺激模式改善临床症状方法带来了希望。
限制新刺激模式发展的主要因素是DBS作用与LFP节律特征之间的关系尚不清晰,目前研究人员还无法知晓某组DBS参数对大脑活动确切的影响,以及对应临床症状的改善。随着这类研究的深入,带感知功能的DBS必将发挥巨大的作用,相信DBS参数、LFP节律特征与疾病之间的联系会逐渐清晰。届时根据患者的大脑状态实时调整DBS策略,可以实现更加精准的个性化刺激疗法。
[1] Perlmutter JS, Mink JW. Deep brain stimulation [J]. Annual Review of Neuroscience, 2006, 29: 229-257.
[2] 李路明,郝红伟. 植入式神经刺激器的现状与发展趋势[J]. 中国医疗器械杂志,2009,02:107-111.
[3] Benabid AL, Pollak P, Hoffmann D, et al. Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus[J]. The Lancet, 1991, 337(8738): 403-406.
[4] Logothetis NK. The underpinnings of the BOLD functional magnetic resonance imaging signal [J]. The Journal of Neuroscience, 2003, 23(10): 3963-3971.
[5] Iadecola C. Neurovascular regulation in the normal brain and in Alzheimer′s disease [J]. Nature Reviews Neuroscience, 2004, 5(5): 347-360.
[6] Shen H, Neuroscience: Tuning the brain [EB]. http://www.nature.com/news/neuroscience-tuning-the-brain-1.14900, 2014-03-19/2016-02-23.
[7] Kandel ER, Schwartz JH, Jessell TM, et al. Principles of neural science [M] (5thEdition). Beijing: China Machine Press, 2015:996-1403.
[8] Alexander GE, Crutcher MD. Functional architecture of basal ganglia circuits: neural substrates of parallel processing [J]. Trends in Neurosciences, 1990, 13(7): 266-271.
[9] DeLong MR. Primate models of movement disorders of basal ganglia origin [J]. Trends in Neurosciences, 1990, 13(7): 281-285.
[10] Brown P, Oliviero A, Mazzone P, et al. Dopamine dependency of oscillations between subthalamic nucleus and pallidum in Parkinson′s disease [J]. The Journal of Neuroscience, 2001, 21(3): 1033-1038.
[11] Swann N, Poizner H, Houser M, et al. Deep brain stimulation of the subthalamic nucleus alters the cortical profile of response inhibition in the beta frequency band: A scalp EEG study in Parkinson′s disease[J]. The Journal of Neuroscience, 2011, 31(15): 5721-5729.
[12] McCarthy MM, Moore-Kochlacs C, Gu X, et al. Striatal origin of the pathologic beta oscillations in Parkinson′s disease[J]. Proceedings of the National Academy of Sciences, 2011, 108(28): 11620-11625.
[13] Ray NJ, Jenkinson N, Wang S, et al. Local field potential beta activity in the subthalamic nucleus of patients with Parkinson′s disease is associated with improvements in bradykinesia after dopamine and deep brain stimulation [J]. Experimental Neurology, 2008, 213(1): 108-113.
[14] Kühn AA, Tsui A, Aziz T, et al. Pathological synchronisation in the subthalamic nucleus of patients with Parkinson′s disease relates to both bradykinesia and rigidity [J]. Experimental Neurology, 2009, 215(2): 380-387.
[15] Kühn AA, Kempf F, Brücke C, et al. High-frequency stimulation of the subthalamic nucleus suppresses oscillatory β activity in patients with Parkinson′s disease in parallel with improvement in motor performance [J]. The Journal of Neuroscience, 2008, 28(24): 6165-6173.
[16] Whitmer D, De Solages C, Hill B, et al. High frequency deep brain stimulation attenuates subthalamic and cortical rhythms in Parkinson′s disease[J]. Front Hum Neurosci, 2012, 6(155): 1-18.
[17] Eusebio A, Thevathasan W, Gaynor LD, et al. Deep brain stimulation can suppress pathological synchronisation in parkinsonian patients[J]. Journal of Neurology, Neurosurgery & Psychiatry, 2011, 82(5): 569-573.
[18] Grill WM, Snyder AN, Miocinovic S. Deep brain stimulation creates an informational lesion of the stimulated nucleus[J]. Neuroreport, 2004, 15(7): 1137-1140.
[19] Priori A, Foffani G, Rossi L, et al. Adaptive deep brain stimulation (aDBS) controlled by local field potential oscillations[J]. Experimental Neurology, 2013, 245: 77-86.
[20] Joundi R A, Brittain J S, Green A L, et al. Oscillatory activity in the subthalamic nucleus during arm reaching in Parkinson′s disease[J]. Experimental Neurology, 2012, 236(2): 319-326.
[21] Quinn E J, Blumenfeld Z, Velisar A, et al. Beta oscillations in freely moving Parkinson′s subjects are attenuated during deep brain stimulation [J]. Movement Disorders, 2015, 30(13): 1750-1758.
[22] Cassidy M, Mazzone P, Oliviero A, et al. Movement-related changes in synchronization in the human basal ganglia [J]. Brain, 2002, 125(6): 1235-1246.
[23] Connolly AT, Muralidharan A, Hendrix C, et al. Local field potential recordings in a non-human primate model of Parkinsons disease using the Activa PC+S neurostimulator [J]. Journal of Neural Engineering, 2015, 12(6): 066012.
[24] Kühn AA, Doyle L, Pogosyan A, et al. Modulation of beta oscillations in the subthalamic area during motor imagery in Parkinson′s disease[J]. Brain, 2006, 129(3): 695-706.
[25] Qian X, Hao H, Ma B, et al. Implanted rechargeable electroencephalography (EEG) device [J]. Electronics Letters, 2014, 50(20): 1419-1421.
[26] Stanslaski S, Afshar P, Cong P, et al. Design and validation of a fully implantable, chronic, closed-loop neuromodulation device with concurrent sensing and stimulation[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2012, 20(4): 410-421.
[27] Jenkinson N, Kühn AA, Brown P. Gamma oscillations in the human basal ganglia [J]. Experimental Neurology, 2013, 245: 72-76.
[28] Beudel M, Little S, Pogosyan A, et al. Tremor reduction by deep brain stimulation is associated with gamma power suppression in Parkinson′s disease [J]. Neuromodulation: Technology at the Neural Interface, 2015, 18(5): 349-354.
[29] Anzak A, Tan H, Pogosyan A, et al. Subthalamic nucleus activity optimizes maximal effort motor responses in Parkinson′s disease[J]. Brain, 2012, 135(9): 2766-2778.
[30] Weinberger M, Hutchison WD, Lozano AM, et al. Increased gamma oscillatory activity in the subthalamic nucleus during tremor in Parkinson′s disease patients[J]. Journal of Neurophysiology, 2009, 101(2): 789-802.
[31] Anzak A, Gaynor L, Beigi M, et al. Subthalamic nucleus gamma oscillations mediate a switch from automatic to controlled processing: a study of random number generation in Parkinson′s disease [J]. Neuroimage, 2013, 64: 284-289.
[32] Foffani G, Priori A, Egidi M, et al. 300‐Hz subthalamic oscillations in Parkinson′s disease [J]. Brain, 2003, 126(10): 2153-2163.
[33] Özkurt T E, Butz M, Homburger M, et al. High frequency oscillations in the subthalamic nucleus: a neurophysiological marker of the motor state in Parkinson′s disease[J]. Experimental Neurology, 2011, 229(2): 324-331.
[34] Blumenfeld Z, Bront⊇-Stewart H. High frequency deep brain stimulation and neural rhythms in Parkinson′s disease [J]. Neuropsychology Review, 2015, 25(4): 384-397.
[35] Thompson JA, Lanctin D, Ince NF, et al. Clinical implications of local field potentials for understanding and treating movement disorders [J]. Stereotactic and Functional Neurosurgery, 2014, 92(4): 251-263.
[36] Beudel M, Brown P. Adaptive deep brain stimulation in Parkinson′s disease [J]. Parkinsonism & Related Disorders, 2016, 22: S123-S126.
[37] Alonso-Frech F, Zamarbide I, Alegre M, et al. Slow oscillatory activity and levodopa-induced dyskinesias in Parkinson′s disease [J]. Brain, 2006, 129(7): 1748-1757.
[38] Lewis SJG, Barker RA. A pathophysiological model of freezing of gait in Parkinson′s disease [J]. Parkinsonism & Related Disorders, 2009, 15(5): 333-338.
[39] Redgrave P, Rodriguez M, Smith Y, et al. Goal-directed and habitual control in the basal ganglia: implications for Parkinson′s disease[J]. Nature Reviews Neuroscience, 2010, 11(11): 760-772.
[40] Androulidakis AG, Mazzone P, Litvak V, et al. Oscillatory activity in the pedunculopontine area of patients with Parkinson′s disease[J]. Experimental Neurology, 2008, 211(1): 59-66.
[41] Huebl J, Schoenecker T, Siegert S, et al. Modulation of subthalamic alpha activity to emotional stimuli correlates with depressive symptoms in Parkinson′s disease [J]. Movement Disorders, 2011, 26(3): 477-483.
[42] Marco-Pallarés J, Münte T F, Rodríguez-Fornells A. The role of high-frequency oscillatory activity in reward processing and learning [J]. Neuroscience & Biobehavioral Reviews, 2015, 49: 1-7.
[43] López-Azcárate J, Tainta M, Rodríguez-Oroz MC, et al. Coupling between beta and high-frequency activity in the human subthalamic nucleus may be a pathophysiological mechanism in Parkinson′s disease [J]. The Journal of Neuroscience, 2010, 30(19): 6667-6677.
[44] Connolly AT, Jensen AL, Bello EM, et al. Modulations in oscillatory frequency and coupling in globus pallidus with increasing parkinsonian severity[J]. The Journal of Neuroscience, 2015, 35(15): 6231-6240.
[45] 王宗宝,黄永志,张新静,等. 帕金森病患者局部场电位信号多频耦合特征分析[J]. 生物医学工程学杂志,2015,04:874-880.
[46] Chen CC, Kühn AA, Trottenberg T, et al. Neuronal activity in globus pallidus interna can be synchronized to local field potential activity over 3-12 Hz in patients with dystonia [J]. Experimental Neurology, 2006, 202(2): 480-486.
[47] Kühn AA, Brücke C, Schneider GH, et al. Increased beta activity in dystonia patients after drug-induced dopamine deficiency [J]. Experimental Neurology, 2008, 214(1): 140-143.
[48] Lee J R, Kiss ZHT. Interhemispheric difference of pallidal local field potential activity in cervical dystonia [J]. Journal of Neurology, Neurosurgery & Psychiatry, 2013, 85(3): 306-310.
[49] Neumann WJ, Huebl J, Brücke C, et al. Enhanced low-frequency oscillatory activity of the subthalamic nucleus in a patient with dystonia [J]. Movement Disorders, 2012, 27(8): 1063-1066.
[50] Liu X, Wang S, Yianni J, et al. The sensory and motor representation of synchronized oscillations in the globus pallidus in patients with primary dystonia [J]. Brain, 2008, 131(6): 1562-1573.
[51] Weinberger M, Hutchison WD, Alavi M, et al. Oscillatory activity in the globus pallidus internus: comparison between Parkinson′s disease and dystonia [J]. Clinical Neurophysiology, 2012, 123(2): 358-368.
[52] Volkmann J, Mueller J, Deuschl G, et al. Pallidal neurostimulation in patients with medication-refractory cervical dystonia: a randomised, sham-controlled trial [J]. The Lancet Neurology, 2014, 13(9): 875-884.
[53] 杨张凯,王学廉,汪鑫,等. 脑深部电刺激治疗肌张力障碍的疗效分析[J]. 中国临床神经外科杂志,2015,1:21-24.
[54] Barow E, Neumann WJ, Brücke C, et al. Deep brain stimulation suppresses pallidal low frequency activity in patients with phasic dystonic movements [J]. Brain, 2014, 137(11): 3012-3024.
[55] Singh A, Kammermeier S, Plate A, et al. Pattern of local field potential activity in the globus pallidus internum of dystonic patients during walking on a treadmill [J]. Experimental Neurology, 2011, 232(2): 162-167.
[56] Brücke C, Huebl J, Schönecker T, et al. Scaling of movement is related to pallidal γ oscillations in patients with dystonia [J]. The Journal of Neuroscience, 2012, 32(3): 1008-1019.
[57] Welter ML, Grabli D, Karachi C, et al. Pallidal activity in myoclonus dystonia correlates with motor signs [J]. Movement Disorders, 2015, 30(7): 992-996.
[58] Elble RJ. What is essential tremor? [J]. Current Neurology and Neuroscience Reports. 2013, 13(6) :1-8.
[59] Koller WC, Lyons KE, Wilkinson SB, et al. Long-term safety and efficacy of unilateral deep brain stimulation of the thalamus in essential tremor[J]. Movement Disorders, 2001, 16(3): 464-468.
[60] 陈宁,孟凡刚,马羽,等. 丘脑底核脑深部电刺激治疗特发性震颤2例临床分析[J]. 立体定向和功能性神经外科杂志,2013,1:34-37.
[61] Kane A, Hutchison WD, Hodaie M, et al. Enhanced synchronization of thalamic theta band local field potentials in patients with essential tremor [J]. Experimental Neurology, 2009, 217(1): 171-176.
[62] Basha D, Dostrovsky J O, Rios A LL, et al. Beta oscillatory neurons in the motor thalamus of movement disorder and pain patients[J]. Experimental Neurology, 2014, 261: 782-790.
[63] Marsden JF, Ashby P, Limousin-Dowsey P, et al. Coherence between cerebellar thalamus, cortex and muscle in man[J]. Brain, 2000, 123(7): 1459-1470.
[64] Air EL, Ryapolova-Webb E, de Hemptinne C, et al. Acute effects of thalamic deep brain stimulation and thalamotomy on sensorimotor cortex local field potentials in essential tremor [J]. Clinical Neurophysiology, 2012, 123(11): 2232-2238.
[65] Abramowitz JS, Taylor S, McKay D. Obsessive-compulsive disorder [J]. The Lancet, 2009, 374(9688): 491-499.
[66] Greenberg BD, Malone DA, Friehs GM, et al. Three-year outcomes in deep brain stimulation for highly resistant obsessive-compulsive disorder [J]. Neuropsychopharmacology, 2006, 31(11): 2384-2393.
[67] Huff W, Lenartz D, Schormann M, et al. Unilateral deep brain stimulation of the nucleus accumbens in patients with treatment-resistant obsessive-compulsive disorder: Outcomes after one year[J]. Clinical Neurology and Neurosurgery, 2010, 112(2): 137-143.
[68] Kohl S, Schönherr DM, Luigjes J, et al. Deep brain stimulation for treatment-refractory obsessive compulsive disorder: a systematic review [J]. BMC Psychiatry, 2014, 14(1): 214.
[69] Bastin J, Polosan M, Piallat B, et al. Changes of oscillatory activity in the subthalamic nucleus during obsessive-compulsive disorder symptoms: two case reports [J]. Cortex, 2014, 60: 145-150.
[70] Ewing SG, Grace AA. Long-term high frequency deep brain stimulation of the nucleus accumbens drives time-dependent changes in functional connectivity in the rodent limbic system [J]. Brain Stimulation, 2013, 6(3): 274-285.
[71] Neumann WJ, Staub F, Horn A, et al. Deep brain recordings using an implanted pulse generator in Parkinson′s disease [J]. Neuromodulation: Technology at the Neural Interface, 2016, 19(1): 20-24.
[72] Little S, Pogosyan A, Neal S, et al. Adaptive deep brain stimulation in advanced Parkinson disease [J]. Annals of Neurology, 2013, 74(3): 449-457.
[73] Fasano A, Lozano AM. The FM/AM world is shaping the future of deep brain stimulation[J]. Movement Disorders, 2014, 29(2): 161-163.
[74] Jia F, Guo Y, Wan S, et al. Variable frequency stimulation of subthalamic nucleus for freezing of gait in Parkinson′s disease[J]. Parkinsonism & Related Disorders, 2015, 21(12): 1471-1472.
Current Research on Local Field Potential Rhythms of Deep Brain Stimulation Indications
Chen Yue1Qian Xing1Hao Hongwei1#Li Luming1,2#*
1(NationalEngineeringLaboratoryforNeuromodulation,Beijing100084,China)2(CenterofEpilepsy,BeijingInstituteforBrainDisorders,Beijing100093,China)
As a technology of neuromodulation, Deep Brain Stimulation (DBS) has become an established clinical treatment for brain disorders and opened a window of brain for neuroscience researchers. In this article, current treatment status and pathology hypothesis of 4 FDA-approved brain disorders are briefly introduced, including the Parkinson disease (PD), dystonia, essential tremor and obsessive compulsive disorder (OCD). The LFP theta, alpha, beta, gamma and other high frequency rhythms of the above diseases are summarized as well. Relevance between the LFP rhythms and clinical symptoms or behaviors is analyzed. The latest implantable LFP research tool and the real-time collection results are introduced. In conclusion, the LFP rhythms of DBS targets or related areas could reflect characteristics of different brain disorders. These electrophysiological rhythms will make the foundation for the pathological study, DBS mechanism exploration and theoretical development of neuromodulation. At last, based on the limits of the current researches, this article proposes some prospect of LFP rhythm study, which would be of great significance to the field of neuromodulation.
deep brain stimulation (DBS); indication; local field potential (LFP); rhythm; neuromodulation
10.3969/j.issn.0258-8021. 2016. 05.010
2015-03-24, 录用日期:2016-07-08
国家自然科学基金大仪器专项(81527901);中央在京高校重大成果转化项目(Z151100003915123)
R318
A
0258-8021(2016) 05-0577-010
# 中国生物医学工程学会高级会员(Senior member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: lilm@tsinghua.edu.cn

