抗菌增效剂药动学与残留消除研究进展
孙灵灵,袁宗辉,李 梅,黄玲利
(华中农业大学动物医学院国家兽药残留基准实验室,武汉430070)
抗菌增效剂药动学与残留消除研究进展
孙灵灵,袁宗辉,李 梅,黄玲利*
(华中农业大学动物医学院国家兽药残留基准实验室,武汉430070)
摘 要:抗菌增效剂可以增强抗生素的抗菌活性、减少细菌耐药性的产生、提高治疗效果。药动学研究是临床上制定给药方案,评价药效的重要指标;残留消除研究可以了解药物的残留靶组织、残留标识物,进而制定适宜的休药期。作者简述了艾地普林、甲氧苄啶、二甲氧苄啶3种抗菌增效剂的药动学及残留消除规律,着重对比艾地普林与甲氧苄啶在不同动物体内的药动学参数,显示与甲氧苄啶相比艾地普林具有更长的消除半衰期及更大的表观分布容积,且甲氧苄啶在不同动物体内的消除半衰期差异较大,二甲氧苄啶常作为肠道的抗菌增效剂使用。目前多采用高效液相色谱法及和其他色谱联用的方法,对抗菌增效剂进行药动及残留消除研究,并且也证明了该方法专一性好、灵敏度高。当前由于抗生素的不合理使用甚至滥用导致的药物失效以及细菌耐药性的问题越来越普遍,而抗菌增效剂的出现为解决该类问题提供了新的方向。通过对3种抗菌增效剂在不同动物体内的药动学及残留消除研究,有利于深入了解各种药物在不同动物体内共性和差异性规律,以期发现该类药物在临床使用中存在的问题并且不断地完善抗菌增效剂在临床上的应用。
关键词:抗菌增效剂;艾地普林;甲氧苄啶;二甲氧苄啶;药动学;残留消除;分析方法
随着抗菌药物的广泛使用,细菌往往会表现出耐药性,这为临床上疾病的治疗带来了很大的困难,而抗菌增效剂与抗菌药联用后的抗菌增效作用可以减轻并解决这类问题。目前常用的抗菌增效剂有甲氧苄啶、二甲氧苄啶、艾地普林、奥美普林及巴喹普林,他们都属于广谱抗菌药,本身具有一定的抑菌活性,对多数革兰氏阳性和阴性菌都有作用,因细菌对本类药物易产生耐药性,因此极少单独使用,当与磺胺类药及抗生素联用后,具有明显的抗菌增效作用[1]。抗菌增效剂是通过抑制二氢叶酸还原酶的活性,使二氢叶酸不能还原为四氢叶酸,从而妨碍细菌核酸和蛋白质的合成。当前很多抗菌药物被用来治疗各种动物疾病,然而,抗菌增效剂的使用多是凭经验或借鉴人的用药方法,具有很大的盲目性,影响了药物协同作用的防制效果。
临床上,抗菌增效剂种类不多,增效机制各不相同,一种增效剂只能对特定的抗菌药增效,而对其他类抗菌药没有增效作用[2],因此需要对抗菌增效剂的作用特点进行更加详细的研究。进行抗菌增效剂的药动学研究得到的药动学参数可以优化制剂工艺及给药方案、指导剂型、治疗疾病,进而为抗菌增效剂的质量控制保驾护航[3],因此可用药动学原理指导临床药物治疗,调控药物浓度,增强药效、避免或降低毒副反应。另外药物残留降低了畜禽的品质,严重威胁着食用者的健康,因此,进行抗菌增效剂的药动学及残留研究对于药物在临床上进行疾病的预防和治疗及人体的健康安全具有重要的理论与实践意义。
以艾地普林、甲氧苄啶、二甲氧苄啶3种抗菌增效剂为代表,分别对其在不同动物体内的药动学进行文献调研,然后比较同种药物在不同动物种属的药动学参数,得出药物在不同动物体内的共性及差异性规律,得到的药动学参数可以为抑菌效果提供证据并指导临床上制定合理的给药方案。临床上抗菌增效剂常与磺胺类、抗生素类、喹诺酮类药物及中药制剂合用以增强抗菌效果,有研究表明青蒿素与抗菌增效剂联合后抗球虫作用显著增强[4]。抗菌增效剂的副作用小,但大剂量使用易引起叶酸摄取障碍,白细胞、血小板减少,甚至引起中毒、过敏反应或无疗效[5],且有文献报道,甲氧苄啶、二甲氧苄啶具有遗传毒性,如果这些药物在兽医临床上不合理使用或滥用,将不可避免导致用药后在动物性食品中残留,进而给消费者健康带来安全隐患,为了确保动物性食品的安全和人类健康,加强兽药残留监控迫在眉睫。
1 药代动力学研究进展
1.1艾地普林
艾地普林简称ADP,是一种新型的二氢叶酸还原酶抑制剂,同时也是苄胺嘧啶类抗菌增效剂的一种,它最初是由瑞士Roche公司研究,国内是由华中农业大学国家兽药残留基准实验室进行中间体的合成研究,它与甲氧苄啶具有相似的化学结构[6]。由于ADP在动物体内具有不同的药动学特性,这使得它可以单独或和磺胺类药物联合使用。ADP在不同动物体内的药动学参数见表1。通过对比ADP在3月龄与6月龄猪的药动学参数可以看出,两者消除半衰期比较接近,而3月龄猪的清除率是6月龄猪的2倍,这与Sutter等[7]在牛体内观察到的清除率会随着年龄增长而下降的结论是一致的,并且ADP在3月龄猪的清除率较6月龄快。ADP在火鸡体内的消除半衰期(3.3h)比其他种属的短,这可能是由于在家禽体内具有较高的代谢率,使得其半衰期很短,但它仍然是一个有价值的用于禽类感染的抗菌药[8]。ADP在马体内的表观分布容积(9.1L/kg)较大,消除半衰期为11.90h,这表明了该药在马上有较好的抗菌效果,且无副作用[9]。目前还没有关于ADP在人体内的药动学研究,但是通过对猴子药动学的研究可以推断出ADP在人体内的消除半衰期为28~35h,且ADP在猴子体内的清除率为35.07mL/(min·kg),表明在猴子体内的消除过程较快[10]。ADP在正常绵阳体内的消除半衰期(18.33h)比发热绵阳(13.83h)的长,其体内的主要代谢物是N-单脱氧艾地普林和N-双脱氧艾地普林,而在体外多种动物的肝微粒体的主要代谢物是N-双脱氧艾地普林[11]。为了确保ADP在临床上的安全使用,急性口服毒性、亚慢性毒性试验、5个致突变试验的安全性也进行了相关评估,毒理学的安全评价证实了ADP在临床上具有良好的应用前景[12]。对水牛进行药动学研究发现,ADP的消除半衰期(6.14h)是TMP(3.08h)的2倍[13];母牛单次静脉注射ADP和TMP,ADP的分布体积为(6.5±0.6)L/kg,而TMP的仅为(1.1±0.1)L/kg,这反映了ADP较好的组织分布;用放射性标记ADP在山羊体内的药动学研究发现,与TMP相比,ADP具有更长的半衰期和较大的表观分布容积[14];且ADP在不同动物的平均消除半衰期(9.92h)和表观分布容积(10.23L/kg)远远优于TMP(3.33h和2.13L/kg),这表明ADP相对于TMP有较好的组织分布及更强的抗菌活性。
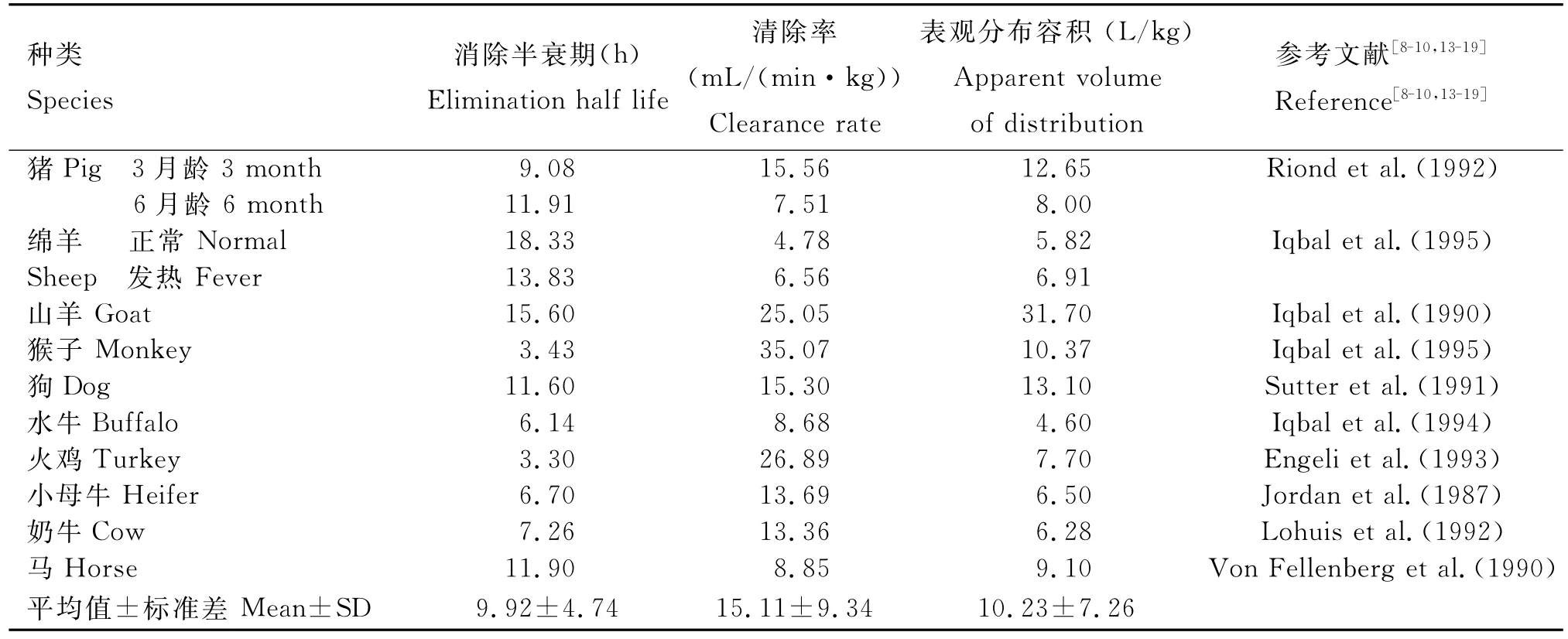
表1 艾地普林在不同动物体内的药动学参数Table 1 Pharmacokinetic parameters of aditoprim in different animals
1.2甲氧苄啶
甲氧苄啶简称为TMP,它可以与磺胺类药物联合使用增加抗菌活性,减少耐药性的产生,也可以与其他抗生素如红霉素、四环素及喹诺酮类抗微生物药联用,王新等[20]发现中药与甲氧苄啶联用后可显著增加小鼠的特异性免疫和非特异性免疫,因此在临床上作为抗菌增效剂广泛使用。利用猪的肝微粒体孵育代谢物首次对TMP和二甲氧苄啶的体外代谢物进行测定,得到了与TMP相关的7种代谢物及与二甲氧苄啶相关的6种代谢物,两者在猪体内具有相似的转化路径,这也为二者的体内代谢提供了研究方向[21]。TMP进入动物机体后,符合一级动力学速率方程[22],在体内吸收快[23],1~2h达到峰值,在全身及组织中广泛分布,在肺脏、肾脏、肝脏中的浓度比血液高10倍左右,故特别适用于呼吸道及泌尿道感染的抗菌治疗[24],乳中浓度为血液中浓度的1.3~3.5倍,胆汁中的浓度是血液中浓度的2倍,亦可穿过胎盘屏障[25],血浆蛋白结合率为30%~40%,并且在不同的种属中半衰期存在差异。TMP在不同动物体内的药动学参数见表2。TMP在人体的消除半衰期为11h,而在其他种类动物的消除半衰期较短,因此临床上常将TMP与其他的抗菌药联用,发挥其较好的抗菌增效作用[26]。TMP在患病家禽体内的消除半衰期和表观分布体积都会下降,并且在家禽体内的清除率很低,这可能是由于机体内某些功能的减弱引起的[27]。由于TMP在猪体内消除半衰期较短,将TMP制成纳米甲氧苄啶,在猪体内的血药-浓度符合一级吸收二室开放模型,且具有吸收、分布及消除慢的特性,这样更容易使药物分布到全身组织中,呈现一种速释-缓释长效的特性,进而提高药物的治疗效果[28],这为兽药在临床上的使用提供了一个方向。对不同动物药动学研究得到的药动学参数分析,可以发现不同动物存在较大的差异,因此可以根据药动学参数,有选择性地用于动物的临床使用,实现药物在临床上较好的治疗作用。
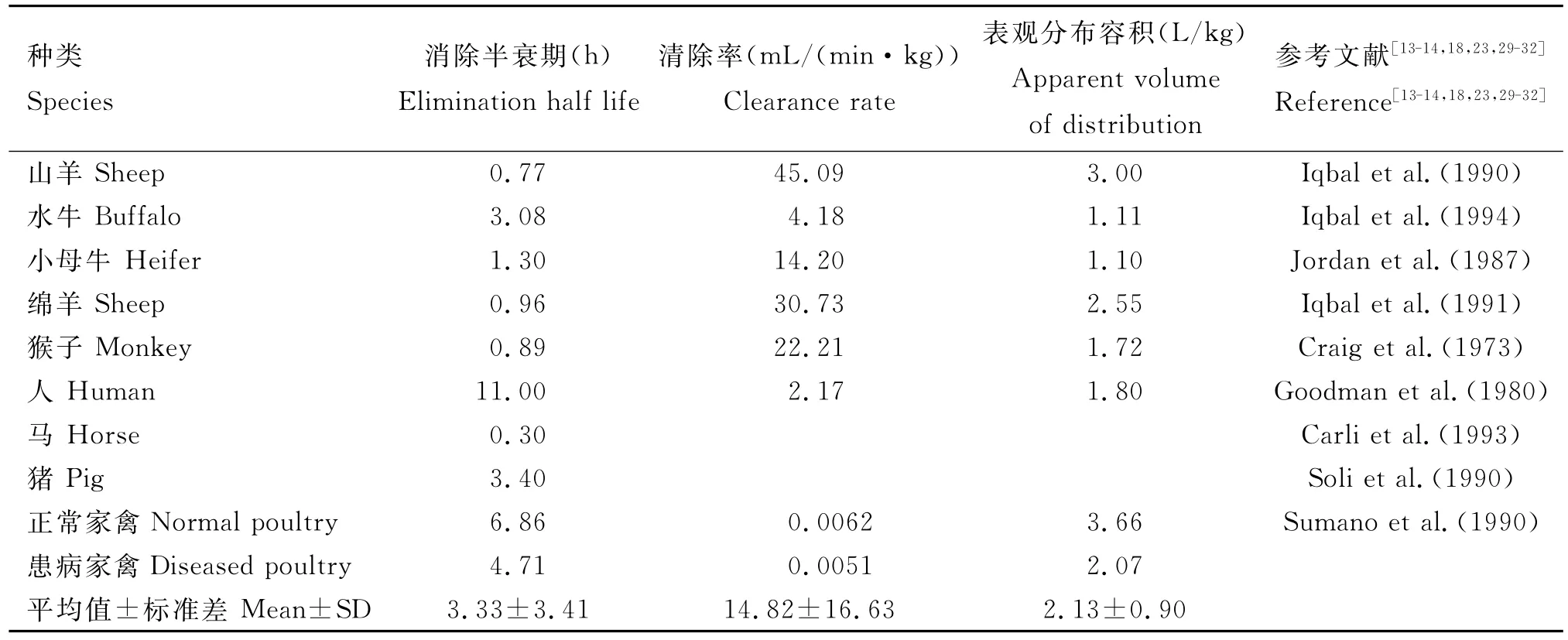
表2 甲氧苄啶在不同动物体内的药动学参数Table 2 Pharmacokinetic parameters of trimethoprim in different animals
1.3二甲氧苄啶
二甲氧苄啶简称为DVD,是动物专用的一种抗菌增效剂,DVD内服吸收较少,其抗菌活性比TMP弱,它在血中的消除半衰期比TMP短,蛋白结合率基本相似[33],最高血药浓度约为TMP的20%,在胃肠道内的浓度较高,因此可作为肠道的抗菌增效剂使用,单独使用时可抗球虫[34],也可和磺胺类药物联用制成新的制剂,进行抗球虫治疗[35]。采用LC-LTQ-Orbitrap的方法得到了DVD在鸡体内的15种代谢物,这也是首次得到DVD的体内代谢物,为进一步的代谢物研究奠定了基础[36]。DVD内服给药及静注给药,在鸡体内的药动学参数[37]见表3。比较二者的药动学参数可以得出,DVD内服吸收虽较少,但在体内分布广泛,且消除非常迅速。

表3 二甲氧苄啶在鸡体内的药动学参数Table 3 Pharmacokinetic parameters of diaveridine in chicken
2 残留消除研究进展
2.1艾地普林
为了避免兽药残留对人的健康造成危害,凡进入食品动物体内的化合物均需规定休药期,而对于残留消除的研究是制定休药期的依据。尽管ADP在兽医临床上具有很广泛的应用前景,但关于其残留消除仍没有相关文献报道。
2.2甲氧苄啶
中国农业部和欧盟都对TMP在动物组织中的最高残留限量做出了规定,中国规定TMP的残留标志物是其原型,其在牛、猪和禽的肌肉、肝脏、肾脏、脂肪中的最大残留限量为50μg/kg,在马的肌肉、肝脏、肾脏、脂肪中的最大残留限量为100μg/ kg。SDZ与TMP联用后在给药后的第5、7、10天屠宰猪在其肾脏中没有发现抗菌残留物[32];TMP和DVD在停药5d后仍可以在鸡体内的可食性组织中检测到[38];磺胺类药物和TMP联用后,1次/1天的给药量,抗菌活性较差,并在最后一次给药后观察到组织、肝脏、肾脏、肌肉中药物的含量很少,因此对于猪口服形式的联合用药的休药期规定不得少于5d[39]。
2.3二甲氧苄啶
对于DVD残留消除的研究,有利于制定该药在不同动物的休药期。目前DVD在动物性食品中的食品安全性标准仅有日本作出规定:在鸡可食性组织中的最高残留限量为50μg/kg。磺胺氯吡嗪钠-二甲氧苄啶在鸡体内的残留消除研究发现,停药4h后DVD在肾脏中的残留最高,肌肉最低,停药后DVD在肝脏中消除最快,在肾脏中最慢,表明肾脏是DVD的残留靶组织,DVD在肾脏中的休药期最长为7.79d[40];DVD在猪组织中消除较快,给药后第10天时所有检测组织中的DVD已全部低于定量限(40μg/kg),DVD在肌肉中消除最快,在肾脏中消除最慢.建议休药期为8d[41];DVD在肉鸡中的残留研究同样表明肾脏是其残留靶组织,在肌肉、肝脏、肾脏、皮脂中的休药期分别为4.77、4.94、6.74和4.58d,在连续7d给药后,建议的休药期为7d[42]。为了便于DVD的临床使用,对其毒性、遗传性、亚慢性毒性和致畸性进行了安全评估,研究表明DVD不产生毒理学效应,且认为该药在老鼠的临床使用上是安全的[43],但是有研究认为DVD的体内及体外哺乳动物细胞有遗传毒性[44]。
3 分析方法研究进展
3.1快速筛选方法
《中华人民共和国兽药典》2005年版规定检测TMP含量的方法为分光光度法[45],与HPLC法相比该法操作较为繁琐,费时费力;双波长分光光度法可以测定DVD和复方磺胺间甲氧嘧啶钠注射液中的TMP的含量,该方法具有检测成本低,所用仪器普及、操作简便、快速、准确可靠、重现性好的特点[46-47];毛细管区带电泳法测定TMP,与光学检测法相比,该方法简便快速,所需设备简单、价廉、便于推广[48];毛细管高频电导法可以测定药物和尿样中的TMP,该方法不仅成本低,样品处理过程简单,而且灵敏度较高、使用非常方便,可用于药物制剂的质量控制和临床检验[49],这些方法都可对抗菌增效剂进行快速分析,具有分析迅速、成本低、操作方便,但是这些方法测量结果不太精确,因此需要寻找新的精确测量药物含量的试验方法。
3.2定量确证方法
高效液相色谱-荧光-紫外法测定动物肌肉组织中TMP的药物残留的检出限为3.5μg/kg,该方法具有简便、灵敏、通用性强的特点,适用于猪肌肉组织中TMP的常规残留检测[50];郑重莺等[51]建立了TMP的液相色谱串联质谱的检测方法,该方法的检出限为1.0μg/kg,线性范围为0~200ng/mL,回收率范围为81.7%~98.0%,该方法具有高灵敏度、高选择性、快速等特点,适合检测实验室的大样品量,实用性好;万译文等[52]也同样建立了高效液相色谱串联质谱测定水中TMP的残留,检出限为0.5μg/kg,定量限为1.0μg/kg,该方法具有很好的选择性和重现性,能很好地对水产品中TMP的残留进行预测。LC-MS法测定TMP含量时,在10~1 000ng/mL浓度范围内呈线性,定量限为10ng/mL,因此可以有效测定小鼠血浆中的TMP含量[53];固相萃取-高效液相色谱法对TMP在家蚕体内的药动学进行的相关研究,当血浆中TMP的质量浓度在0.63~40.00μg/mL范围内,峰面积与药物浓度呈现良好的线性关系,因此能很好地测定血浆中的药物浓度[54];用HPLC法测定TMP和DVD在鸡组织内的残留量,检测限和定量限分别为0.02和0.05mg/kg,且该方法适用于鸡组织中TMP和DVD单个或多个药物残留量的测定[55];罗浩师[56]建立的鸡和猪的肌肉、肝脏、肾脏、脂肪+皮组织及鱼肉+皮组织中检测动物性食品中TMP和DVD的残留的高效液相色谱-串联质谱分析方法中,TMP在各个组织的检测限均为0.6~1μg/kg,定量限为2μg/kg;DVD在各个组织的检测限为0.3~0.5μg/kg,定量限为1μg/kg,该方法灵敏度高,重现性强,适用的动物组织范围较广,且准确度和精密度都能满足中国农业部兽药残留相关文件的要求;用HPLC和紫外检测器测定DVD的含量时,一般是采用C18柱作为固定相,然后再根据分析物的特性选择合适的流动相,样品中的DVD在15~50min内就可以得到快速分离,利用该方法降低消耗,为不能使用仪器或者试验设备的较远地区提供了便利[57];栾明娜等[58]用HPLC法测定溶液中磺胺氯吡嗪钠和DVD含量,采用Sino Chrom ODS-BP色谱柱,DVD在0.3~45.0μg/mL范围内线性关系良好,且可以对2种成分进行检测,简便快捷;孙玉慧等[59]建立固相萃取-高效液相色谱法检测水产品中TMP残留量的分析方法,在0.02~0.20mg/L范围内线性关系良好,方法的检出限为0.02mg/L,该方法具有适合水产品中TMP残留量的日常监测,具有很好的应用前景,这些定量确证方法都可以对抗菌增效剂在一定浓度范围里进行定量确证,目前多采用高效液相色谱及和其他技术联用,该方法具有灵敏性好、适合多种残留量的检测,目前这种方法也得到了很好的应用。
4 结 语
目前,ADP在很多动物体内的药动学研究都有相关的文献报道,并且也证实了其具有较长的消除半衰期和较大的表观分布容积,但是关于ADP的残留消除研究还没有文献报道;TMP长期使用易产生耐药性,因此一般很少单独使用,TMP的残留标识物是其本身,目前也只有关于猪的休药期的制定;DVD在不同动物的体内代谢以及残留消除研究较少,并且也有研究指出其在哺乳类动物细胞内存在遗传毒性,而对于它们含量的测定多采用HPLC法,研究也证明了该方法的精确性及便于测定的优点。目前药动学和残留消除研究的匮乏,只是针对特定的给药剂量和给药途径,适用条件相对局限,如果改变这些条件,之前的研究结果并不一定适用,因此需要寻找只需改变一个或几个可变因素,就可以得出不同给药途径下的药动学及残留消除特征的新方法,同时仍需加强抗菌增效剂的体内体外代谢研究及残留检测技术工作,特别是在方法检出限方面,应进一步提高灵敏度,以制订出药物的最高残留限量标准及休药期,最后还应对药物进行毒理学研究,保证药物在临床上的安全使用并发挥其较好的药效学作用,进而保障食用者的健康。
参考文献:
[1] 薛凤梅.兽用抗菌增效剂[J].养殖技术顾问,2011,5:235.
[2] 王 谦,孙素馨.抗菌增效剂应用进展[J].临床医药实践杂志,2007,S1:485-488.
[3] 陈学宏,伍 微,李英伦.中兽药开展药动学研究的必要性[J].四川畜牧兽医,2006,33(7):22-23.
[4] 马 琰,马庆涛,承 南,等.青蒿素与抗菌增效剂联合抗鸡球虫效果评价[J].中国家禽,2016,38(2):53-55.
[5] Neu H C.The crisis in antibiotic resistance[J].Science,1992,257(5073):1064-1073.
[6] Knoppert N W,Nijmeijer S M,Van Duin C T,et al.Some pharmacokinetic data of aditoprim and trimethoprim in healthy and tick-borne fever infected dwarf goats[J].JVetPharmacolTher,1988,11(2):135-144.
[7] Sutter H M,Riond J L,Wanner M.Comparative pharmacokinetics of aditoprim in milk-fed and conventionally fed calves of different ages[J].ResVetSci,1993,54(1):86-93.
[8] Engeli J,Riond J L,Wanner M.Research note:Pharmacokinetics of aditoprim in turkeys after intravenous and oral administration[J].PoultSci,1993,72(5):979-983.
[9] Von Fellenberg R L,Jordan J C,Ludwig B,et al.Plasma disposition and tolerance of aditoprim in hor-ses after single intravenous injection[J].Zentralbl VeterinarmedA,1990,37(4):253-258.
[10] Iqbal M P,Niazi S K,Mehboobali N,et al.Disposition kinetics of aditoprim in two monkeys in comparison to other mammalian species[J].BiopharmDrug Dispos,1995,16(8):713-718.
[11] Alvinerie M,Sutra J F,Eeckhoutte C,et al.Determination of aditoprim and its oxidative metabolites in plasma and microsomal incubation mixtures by highperformance liquid chromatography[J].JChromatogr,1993,612(1):115-121.
[12] Wang X,Tan Z Q,Pan Y H,et al.Safety assessment of aditoprim acute,subchronic toxicity and mutagenicity studies[J].JApplToxicol,2015,35(11):1415-1426.
[13] Iqbal M P,Ashfaq M K,Niazi S K,et al.Pharmacokinetics of aditoprim and trimethoprim in buffalo calves[J].BiopharmDrugDispos,1994,15(2):173-177.
[14] Iqbal M P,Mahboobali N,Niazi S K,et al.Pharmacokinetics of aditoprim in goats using a radioassay[J].BiopharmDrugDispos,1990,11(6):533-541.
[15] Riond J L,Muller P,Wanner M.The influence of age on the pharmacokinetics of aditoprim in pigs after intravenous and oral administration[J].VetResCommun,1992,16(5):355-364.
[16] Iqbal M P,Niazi S K,Ashfaq M K,et al.Pharmacokinetics of aditoprim in normal and febrile sheep[J].BiopharmDrugDispos,1995,16(4):343-349.
[17] Sutter H M,Ludwig B,Bremer K,et al.Pharmacokinetics of aditoprim in dogs after intravenous and oral administration:A preliminary study[J].J SmallAnimPract,1991,32(10):517-520.
[18] Jordan J C,Klatt P,Ludwig B.Pharmacokinetics of aditoprim,a new long-acting dihydrofolate reductase inhibitor,in heifers[J].ZentralblVeterinarmedA,1987,34(1):33-41.
[19] Lohuis J A,Sutter H M,Graser T,et al.Effects of endotoxin-induced mastitis on the pharmacokinetic properties of aditoprim in dairy cows[J].AmJVet Res,1992,53(12):2311-2314.
[20] 王 新,崔一喆,邵 红,等.中药与甲氧苄啶复方对小鼠血液学和免疫学指标的影响[J].中国畜牧兽医,2011,38(7):50-52.
[21] Liu Z Y,Wu Y,Sun Z L,et al.Characterization ofinvitrometabolites of trimethoprim and diaveridine in pig liver microsomes by liquid chromatography combined with hybrid ion trap/time-of-flight mass spec-trometry[J].BiomedChromatogr,2012,26(9):1101-1108.
[22] Kaplan S A,Weinfeld R E,Abruzzo C W,et al.Pharmacokinetic profile of trimethoprim-sulfamethoxazole in man[J].JInfectDis,1973,128(Suppl):S547-S555.
[23] Craig W A,Kunin C M.Distribution of trimethoprim-sulfamethoxazole in tissues of rhesus monkeys[J].JInfectDis,1973,128(Suppl 3):S575-S579.
[24] 田友道.抗菌增效剂:甲氧苄氨嘧啶[J].医学资料选编,1974,1:40.
[25] Gustafsson A,B°verud V,Franklin A,et al.Repeated administration of trimethoprim/sulfadiazine in the horse—pharmacokinetics,plasma protein binding and influence on the intestinal microflora[J].JVetPharmacolTher,1999,22(1):20-26.
[26] Choi M J,Yohannes S B,Lee S J,et al.Pharmacokinetic interaction of enrofloxacin/trimethoprim combination following single-dose intraperitoneal and oral administration in rats[J].EurJDrugMetabPharmacokinet,2014,39(1):11-16.
[27] Sumano H,Fuentes V,Ocampo L.Pharmacokinetic aspects of a sulphachloropyridazine trimethoprim preparation in normal and diseased fowl[J].BrPoult Sci,1990,31(3):627-634.
[28] 林居纯,杨洪高,邓向东,等.甲氧苄啶不同制剂在猪体内的药动学研究[A].2013年中国畜牧兽医学会兽医药理毒理学分会第十二次学术讨论会论文集[C].2013.
[29] Iqbal M,Mahmood M,Waqar M,et al.Pharmacokinetic data of aditoprim and trimethoprim in local sheep[J].PakistanVetJ,1991,11:172-175.
[30] Goodman L,Gilman A.The pharmacological basis of therapeutics,7th edn Macmillan[M].New York,1980.
[31] Carli S,Sonzogni O,Villa R,et al.Pharmacokinetic profile of sulphamonomethoxine-trimethoprim in horses after intravenous,intramuscular and oral administration[J].ResVetSci,1993,54(2):184-188.
[32] Soli N E,Framstad T,Skjerve E,et al.A comparison of some of the pharmacokinetic parameters of three commercial sulphadiazine/trimethoprim combined preparations given orally to pigs[J].VetRes Commun,1990,14(5):403-410.
[33] 刘昌孝,郑惠芬,资右明.抗菌增效剂DVD和OMP与TMP药物代谢动力学的比较研究[J].中国药学杂志,1985,20(7):413-414.
[34] 王国永,赵振升,张可煜,等.甲氧苄啶、二甲氧苄啶与磺胺氯吡嗪钠联用的抗球虫效果比较[J].中国家禽,2008,30(8):27-29.
[35] Ball S J,Warren E W.Treatment of experimental avian coccidiosis with a soluble combination of sulphaquinoxaline and diaveridine[J].VetRec,1965,77(43):1252-1256.
[36] Wang H,Yuan B,Zeng Z,et al.Identification and elucidation of the structure ofinvivometabolites of diaveridine in chicken[J].JChromatogrBAnalyt TechnolBiomedLifeSci,2014,965:91-99.
[37] 孙晨明.磺胺氯吡嗪钠—二甲氧苄啶混悬液在鸡的抗球虫药效及药动学研究[D].扬州:扬州大学,2012.
[38] Luo H S,Zhang L F,Xue F Q,et al.Simultaneous determination of trimethoprim and diaveridine in tissues of chicken,porcine,and fish by hydrophilic interaction liquid chromatography-tandem mass spectrometry[J].Food AnalMethod,2014,7(2):308-317.
[39] Garwacki S,Lewicki J,Wiechetek M,et al.A study of the pharmacokinetics and tissue residues of an oral trimethoprim/sulphadiazine formulation in healthy pigs[J].J VetPharmacolTher,1996,19(6):423-430.
[40] 郝增坤.磺胺氯吡嗪钠—二甲氧苄啶溶液在鸡的残留消除研究[D].扬州:扬州大学,2012.
[41] 郭红燕,周连根,钟佳莲,等.二甲氧苄啶在猪体内的残留消除[J].华南农业大学学报,2015,36(4):32-35.
[42] Li Y,Bu S.Determination of sulphachloropyrazinediaveridine residues by high performance liquid chromatography in broiler edible tissues[J].JVetMed Sci,2016,77(12):1555-1563.
[43] Wang J,Sun F,Tang S,et al.Acute,mutagenicity,teratogenicity and subchronic oral toxicity studies of diaveridine in rodents[J].EnvironToxicolPharmacol,2015,40(2):660-670.
[44] Ono T,Sekiya T,Takahashi Y,et al.The genotoxicity of diaveridine and trimethoprim[J].EnvironToxicolPharmacol,1997,3(4):297-306.
[45] 中国兽药典委员会.中华人民共和国兽药典[M].北京:北京农业出版社,2005.
[46] 张桂枝,靳双星,焦喜兰.双波长分光光度法测定复方磺胺间甲氧嘧啶钠注射液中两主药的含量[J].西北农业学报,2010,19(4):21-23.
[47] 刘建晖,刘佩玉.双波长分光光度法检测二甲氧苄啶的含量[J].兽药与饲料添加剂,2003,8(3):34-35.
[48] 王桂芳,张守尧,王秉钧.毛细管区带电泳法测定复方磺胺嘧啶片中两组份的含量[J].华西药学杂志,2001,16(2):124-125.
[49] 徐健君,翟海云,陈缵光,等.甲氧苄啶的毛细管电泳快速检测新方法[J].分析试验室,2005,24(10):30-33.
[50] 李 存,江海洋,吴银良,等.高效液相色谱-荧光-紫外法测定动物肌肉组织中多类药物残留[J].分析化学,2009,37(8):1102-1106.
[51] 郑重莺,张海琪,周 燕,等.液相色谱-串联质谱法测定水产品中甲氧苄啶的残留[J].中国渔业质量与标准,2012,2(2):89-93.
[52] 万译文,李小玲,邓克国.高效液相色谱-串联质谱法测定水产品中甲氧苄啶的残留[J].食品研究与开发,2014,13:110-112.
[53] Wang X C,Zhang Y Q,Qin K Y,et al.Simultaneous determination of sulfamethoxazole and trimethoprim in rat plasma by Lc-Esi-Ms and its application to a pharmacokinetic study[J].JLiqChromatogrRT,2012,35(7):951-962.
[54] 孙 波,周洪英,吴洪丽,等.甲氧苄啶在家蚕体内的药代动力学研究[J].蚕业科学,2014,1:59-63.
[55] 苑瑞瑞.鸡组织中二甲氧苄啶和甲氧苄啶残留量的HPLC检测方法研究[D].扬州:扬州大学,2012.
[56] 罗浩师.动物性食品中甲氧苄啶和二甲氧苄啶残留量的测定[D],北京:中国农业科学院,2013.
[57] Kang Y P,Yu J,Huh Y,et al.Development of high performance liquid chromatography-ultraviolet detection method for screening mebendazole,clorsulon,diaveridine,and tolfenamic acid in animal-based food samples[J].DrugTestAnal,2014,6(3):246-256.
[58] 栾明娜,陈大健,韩 薇.磺胺氯吡嗪钠二甲氧苄啶溶液质量标准研究[J].中兽医医药杂志,2016,1:22-24.
[59] 孙玉慧,李天宝,范志超,等.固相萃取-高效液相色谱法测定水产品中甲氧苄啶残留量[J].中国测试,2016,42(2):56-58.
(责任编辑 秦 彤)
中图分类号:S859.7
文献标识码:A
文章编号:1671-7236(2016)12-3141-08
doi:10.16431/j.cnki.1671-7236.2016.12.009
收稿日期:2016-05-04
基金项目:畜禽产品未知危害因子识别与已知危害因子跟踪评估(GJFP 2016008)
作者简介:孙灵灵(1990-),女,河南周口人,硕士生,研究方向:药物代谢动力学,E-mail:1325234067@qq.com
通信作者:*黄玲利(1976-),女,湖北武汉人,副教授,研究方向:药代动力学与兽药残留,E-mail:huanglingli@mail.hzau.edu.cn
Research Progress on Pharmacokinetics and Residue Elimination of Antibacterial Synergist
SUN Ling-ling,YUAN Zong-hui,LI Mei,HUANG Ling-li*
(NationalReferenceLaboratoryofVeterinaryDrugResidues,CollegeofAnimalMedicine,HuazhongAgriculturalUniversity,Wuhan430070,China)
Abstract:Antibacterial synergist can enhance the antibacterial activity of the antibiotics,reduce bacterial resistance and improve treatment effect.Pharmacokinetic study is to develop dosage regimen and evaluate efficacy in clinical.Elimination of residual study can understand drug residual target tissue and residual marker to formulate appropriate withdraw time.This review briefly describes the aditoprim,trimethoprim,diaveridine of three kinds of antibacterial synergist pharmacokinetic and residue elimination rule,emphatically when contrast aditoprim to trimethoprim in the pharmacokinetic parameters of different animals.We can conclude aditoprim with longer elimination half-life and larger apparent volume of distribution,and trimethoprim elimination half-life is different in different animals,diaveridine is often used as intestinal antibacterial synergist.Recently researchers always use high performance liquid chromatography(HPLC)method or chromatographic combination method to study antibacterial synergist on pharmacokinetics and residues elimination research,it shows that the method has good specificity and high sensitivity.Currently due to the irrational use even abuse of antibiotics leading to drug failure and bacterial drug resistance problems,the presence of the antibacterial synergist for solving this problem provide a new direction,and three kinds of antibacterial synergist in different animals pharmacokinetic and residues elimination research is helpful to understand various kinds of drugs commonali-ties and differences in different animals,in order to find problems of this kind of drug in clinical using and continuously perfect applications of antibacterial synergist in clinical.
Key words:antibacterial synerists;aditoprim;trimethoprim;diaveridine;pharmacokinetics;elimination of residual;analytical method

