2014—2015年武汉地区儿童乙型流感病毒检测分析
蓝文华,向 赟,艾洪武,宋德贵,吴建国,熊 鹰,刘 艳,刘映乐
(1.广西师范大学生命科学学院,广西桂林541006;2.武汉市儿童医院,湖北武汉430075;3.武汉大学生命科学学院,湖北武汉430075)
2014—2015年武汉地区儿童乙型流感病毒检测分析
蓝文华1,向 赟2,艾洪武2,宋德贵1,吴建国3,熊 鹰3,刘 艳3,刘映乐3
(1.广西师范大学生命科学学院,广西桂林541006;2.武汉市儿童医院,湖北武汉430075;3.武汉大学生命科学学院,湖北武汉430075)
采用微量细胞板培养法分离流感病毒,RT-PCR、巢式PCR鉴定INFB及其HA1基因,运用Clustax、Mega 6.0、Megalign软件分析HA1核苷酸序列及氨基酸序列。结果:2014年4月—2015年3月共收集到发热呼吸道样本1 002株,分离到47株INFB阳性,分离出INFB阳性高峰出现在2014年8月和2015年1月,13~24个月儿童INFB阳性率最高, 0~6个月儿童阳性率最低。INFB患儿与患儿的性别及科室来源无显著关系,87.23% INFB患儿出现了发热、咳嗽症状。HA1片段分析结果表明,检测到的INFB属于Victoria系,与参考株B/Brisbane/60/2008核苷酸同源性在86.1%~88.0%,与B/HubeiJingzhouSongzi/1302/2010核苷酸同源性在86.1%~89.5%。3个氨基酸位点发生转换。结论:武汉地区儿童感染的INFB属于Victoria系,与北半球国际疫苗株B/Brisbane/60/2008、B/Texas/AF2741/2010以及湖北省INFB代表毒株B/Hubei JingzhouSongzi/1302/2010具有较高的亲缘关系,未发现新变种。
INFB;RT-PCR;巢式PCR;HA1基因
乙型流感病毒(influenza B virus,INFB)是引发人类流行性感冒的重要病原之一,往往导致局部范围爆发[1]。INFB属于正粘病毒科流感病毒属,为宿主广泛的单股负链RNA病毒(ss-RNA)。血凝素蛋白(HA)是INFB最主要的表面抗原,同时也是辨别受体结构的连接位点[2]。HA水解为HA1和HA2是病毒感染的先决条件,HA1基因的多变性是INFB易于产生抗原性变化的分子基础[3-4]。依据INFB抗原和基因特性的差别,INFB被分为2个谱系:Yamagata系和Victoria系[5]。1994年,湖北省武汉市被国家流感中心选定为全国重点流感监测点[6]。武汉市儿童医院作为湖北省武汉市全国监测网络哨点医院,开展武汉地区儿童INFB分子流行病学的调查研究将有助于揭示该病毒流行趋势以及病原的变异变迁规律,并及早发现INFB的变异毒株,为INFB疫情的预警及防控、流感疫苗开发提供有利的科学依据。因此,本研究对2014年3月29日—2015年3月28日(一个流感监测年度)武汉市儿童医院患儿呼吸道样本进行INFB检测及其HA1基因特征分析,现将结果报告如下。
1 材料
1.1 病例来源
样本采集地:武汉市儿童医院。样本采集时间:2014年3月29日—2015年3月28日。本研究共采集到符合发热呼吸道症候群病例定义的呼吸道样本1 238株,剔除样本信息不全者样本,剩余1 002株符合实验样本要求。
1.2 遴选标准
样本由经过监测技术平台培训后的武汉市儿童医院护士采集。样本需符合病例定义*“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项传染病监测技术平台项目内部资料《发热呼吸道症候群监测方案》2012版有关章节。,具体如下:A.急性感染表现(至少符合1项):(1)发热;(2)WBC升高或降低,或WBC分布异常;(3)寒颤;(4)体温降低。B.呼吸道临床表现(至少符合1项):(1)咽部不适、咽干或咽痛;(2)鼻塞、流涕;(3)鼻/咽/喉明显充血、水肿;(4)咳嗽(新发或咳嗽加重);(5)咳痰;(6)气短;(7)听诊呼吸音异常(湿啰音、干啰音、哮鸣音、浊音);(8)胸痛。
1.3 主要实验仪器与试剂
水浴锅(ISOTEMP),冷冻离心机(Thermo),凝胶成像系统(BIO-RAD),电泳仪(北京君意东方电泳设备公司),移液枪(eppendorf),电子天平(SOPTOP),PCR仪(BIO-RAD),漩涡振荡器(其林贝尔仪器制造有限公司),mini离心机(SCILOGEX)。
胰酶,青、链霉素母液,D-MEM培养基(gibco),Hank’s平衡液(Hyclone),胎牛血清(四季青),DMSO(BIOSHARP),RNA提取试剂盒(康为世纪),dNTPs(TIANGEN),逆转录酶(RPOMEGA),RNA酶抑制剂(Thermo),通用引物(上海英骏有限公司),PCR引物(北京奥科鼎盛生物科技有限公司),胶回收试剂盒(OMEGA)。
INFB(乙型流感病毒)、MDCK(狗肾细胞)均由武汉大学病毒实验室提供。
2 方法
2.1 病毒分离
样本采集后保存于4 ℃冰箱,运送过程保证其温度在4 ℃。样本送达实验室后,取1 200 μL到EP管中(不足1 200 μL的用PBS补足,干痰液样本先用等量胰酶消化),加入12 μL双抗,3 000 G,5 min离心,200 μL每管分装于5个冻存管中(一管用于检测,其余保存于-70 ℃冰箱中)。流感病毒扩增、分离采用微量细胞板培养法①:将MDCK接种于T25细胞培养瓶中,37 ℃、体积分数为5% CO2条件下培养,待细胞长至75%~90%时,使用Hank’s液清洗细胞3遍,加入经过4 ℃、2 000 r/min、20 min离心处理的分装样本200 μL,加入1 mL Hank’s液或者病毒生长液,“十字”晃匀,置于37 ℃、体积分数为5% CO2培养箱中吸附1~2 h,其间取出晃匀2次,使病毒均匀吸附。用无菌移液管吸去Hank’s液或病毒生长液,均匀清洗细胞1~2次,加入5 mL病毒生长液于细胞培养瓶中,置于37 ℃、体积分数5% CO2恒温培养箱中培养。
次日起观察细胞病变情况,当76%~100%细胞呈现细胞病变后收集病变细胞及生长液,收集前将细胞放置于-80 ℃冰箱冻融1~2次。收集的细胞及生长液混合物进行分装,部分冻存于-80 ℃冰箱,部分做红细胞凝集实验(血凝滴度≥1∶8进行病毒鉴定实验,血凝滴度<1∶8时,用MDCK继续传代)。培养7 d后无细胞病变,将培养细胞收获,盲传3代,无细胞病变且红细胞凝集实验结果为阴性则视为病毒分离阴性。
2.2 核苷酸序列测定
2.2.1 INFB NP基因鉴定
INFB NP基因核苷酸序列扩增采用巢式PCR,序列检测引物参考文献[5]:
RT-PCR引物 1:5′-GAACTCRTYCYWWATSWCAAWGRRGAAAT-3′
2:5′-ACAGAGATAAAGAAGAGCGTCTACAA-3′
3:5′-ATKGCGCWYRAYAMWCTYARRTCTTCAWAIGC-3′
巢式PCR引物 4:5′-GATCAAGTGAKMGRRAGYMGRAAYCCAGG-3′
5:5′-AAATTGGAATTTGTTCCTTTCAAGGGACA-3′
6:5′-TCTTCAWATGCARSWSMAWKGCATGCCATC-3′
7:5′-CTTAATATGGAAACAGGTGTTGCCATATT-3′
RT-PCR反应条件:逆转录48 ℃ 90 min,94 ℃ 3 min,94 ℃ 30 s,55 ℃ 1 min,72 ℃ 30 s, 45 cycle,72 ℃ 10 min,4 ℃ 10 min。巢式PCR反应条件:95 ℃ 4 min,94 ℃ 30 s,55 ℃ 1 min,72 ℃ 30 s, 35 cycle,72 ℃ 10 min,4 ℃ 10 min。
2.2.2 INFB HA1基因序列测定
INFB HA1基因的核酸扩增及序列测定引物使用软件Primer3设计,HA1-F:5′-GAAG GCAATAATTGTACT-3′,HA1-R:5′-ACCAGCAATAGCTCCGAA-3′。反应条件:98 ℃ 3 min,98 ℃ 30 s,50 ℃ 1 min,72 ℃ 30 s,34 cycle,72 ℃ 10 min,4 ℃ 10 min。PCR产物经20 g/L琼脂糖凝胶电泳,胶回收试剂盒纯化PCR产物,纯化产物送至北京擎科新业生物技术有限公司武汉分部测序。
2.3 核苷酸序列分析
参照序列:INFB Yamagata系标准参照毒株B/Yamagata/16/88(GenBank:M58419.1),Victoria系标准参照毒株B/Victoria/2/87(GenBank:AF102022.1)。其他用于参照INFB代表毒株包括WHO推荐的2003—2015年北半球国际疫苗株: B/Shanghai/361/2002 (GenBank:EF45 6794.1)、B/Malaysia/2506/2004 (GenBank:EU124275.1)、B/Florida/4/2006(GenBank:KP4615 01.1)、B/Brisbane/60/2008(GenBank:FJ766842.1)、B/Texas/AF2741/2010(GenBank:CY08436 0.1)、B/Massachusetts/02/2012(GenBank:KC892118.1),近年来NCBI收录的湖北省INFB代表毒株:B/HubeiYichangWujiagang/158/2009(GenBank:KP460290.1)、B/HubeiWujiagang/1172/2006(GenBank:KP461042.1)、B/HubeiWujiagang/180/2006(GenBank:KP461552.1)、B/HubeiSongzi/33/2007(GenBank:KP460057.1)、B/HubeiJingzhouSongzi/340/2008(GenBank:KP461418.1)、B/HubeiQiaokou/121/2008(GenBank:KP461382.1)、B/HubeiWuhanHongshan/114/2009(GenBank:KP459946.1)、B/HubeiWuhanJiangan/126/2009(GenBank:KP460033.1)、B/HubeiWuhanJiangan/1149/2010(GenBank:KP459655.1)、B/HubeiJingzhouSongzi/1302/2010(GenBank:KP459458.1)。
2.4 统计学分析
流行病学信息的数据分析采用EXCEL软件(2010版)、SPSS软件(19.0版)进行。序列比对和系统进化树采用Clustax、Mega 6.0软件,核苷酸氨基酸序列分析采用Megalign软件。
3 结果
3.1 INFB流行病学调查
3.1.1 INFB病例时间分布
2014年3月29日—2015年3月28日共采集到符合发热呼吸道症候群病例且信息完整样本1 002株,分离到INFB 47株(分离率为4.69%)。每月分离样本如图1所示:4月、11月均未分离到INFB阳性样本,复查后结果一致;INFB的流行呈现双峰特征,分别出现在2014年8月和2015年1月,在随后的9月和次年2月阳性率逐渐降低。结果表明在冬夏两季,INFB更容易流行,在春秋两季活动较少。
3.1.2 INFB年龄分布
将采集到的病例样本按患儿年龄0~6个月、7~12个月、12~24个月、25~36个月、37~48个月、48~60个月、>60个月共7个年龄组进行分析[7],结果如图2所示:本实验中7个年龄组患儿均有感染INFB病例,其中患儿年龄在13~24个月阳性检出率最高,在0~6个月期间感染人数最少且阳性检出率最低。
3.1.3 INFB性别比例及科室来源
根据患儿INFB的检测结果,将以上研究对象分为INFB阳性组和阴性组,结果:INFB阳性组47例,阴性组955例。运用SPSS软件独立样本T检验得到性别比例P=0.533>0.05,两者无显著性差异,无统计学意义,INFB感染患儿与患儿的性别无显著关系。同样通过INFB阳性组和阴性组的数据进行独立样本T检验得到样本科室来源P=0.302>0.05,说明INFB感染患儿与科室来源无显著的关系。
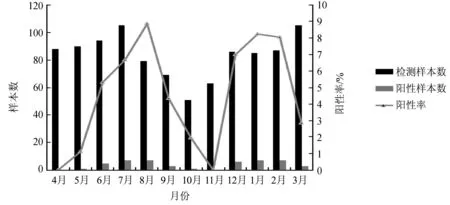
图1 每月分离样本图Fig.1 Separation of samples every month
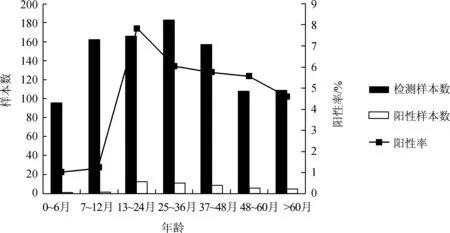
图2 患儿各年龄组感染INFB病例Fig.2 INFB infection cases among all age groups of children
3.1.4 INFB临床症状分析
对鉴定为INFB感染的患儿,对其发热、咳嗽、流涕、咽喉痛、咳痰、胸痛、呼吸急促、呼吸困难、头痛、乏力、腹痛、腹泻临床症状进行分析。本组实验中患儿表现的临床症状:发热症状占87.23%、咳嗽症状占100%、流涕症状占8.51%、咽喉痛占36.17%、呼吸急促占12.77%、腹痛占2.13%、腹泻占4.26%;本组实验未发现有呼吸困难、头痛、乏力等症状。运用SPSS软件独立样本T检验对INFB阳性组和阴性组进行综合分析,患儿表现出的12种临床症状显著性差异P值(P<0.05无显著差异性,P≥0.05有显著差异性)如表1所示。结果表明:INFB患儿与发热、咳嗽、咽喉痛有显著差异性,具有统计学意义;咳痰、流涕、胸痛、呼吸急促、头痛、呼吸困难、乏力、腹痛、腹泻症状和INFB患儿无显著差异性,无统计学意义。详见表1。
3.2 HA种系分析
47株鉴定为INFB的cDNA经过HA1引物PCR扩增后,测序共得到5株INFB的HA1基因序列。根据流感命名标准顺序,将该5株INFB样本分别命名为B/Wuhan/421/2014、B/Wuhan/59/2014、B/Wuhan/515/2014、B/Wuhan/617/2014、B/Wuhan/627/2014。HA1基因进化系统树结果显示:5株INFB全部为Victoria系,与WHO推荐的北半球国际疫苗株2014—2015年B/Brisbane/60/2008和2012—2013年B/Texas/AF2741/2010以及NCBI收录的湖北省INFB代表毒株B/Hubei JingzhouSongzi/1302/2010距离较近。可见:WHO推荐的北半球2014—2015年国际疫苗株B/Brisbane/
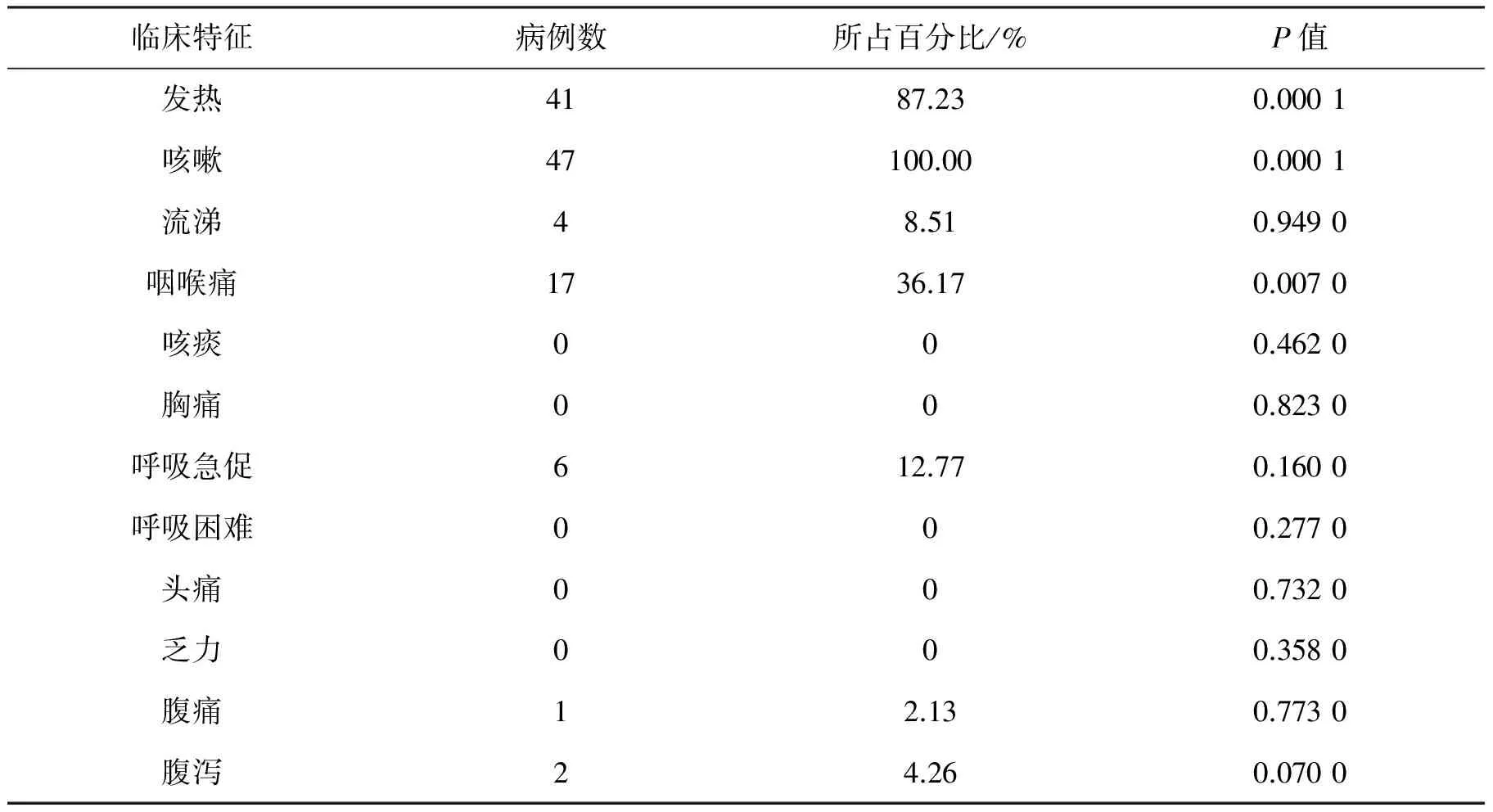
表1 INFB感染病例临床症状
60/2008和2012—2013年国际疫苗株B/Texas/AF2741/2010以及2010年湖北荆州地区INFB毒株与2014—2015年武汉市儿童感染的INFB具有较高的亲缘性;2014—2015年武汉市儿童感染的INFB可能是由2010年湖北省荆州市松滋市INFB毒株进化而来。基因进化系统树分析结果见如图4。
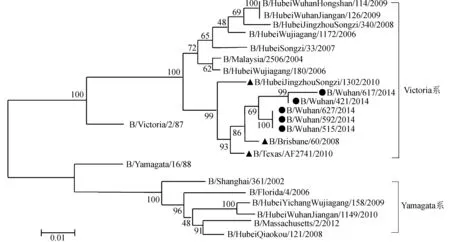
注:●为样本毒株;▲较高亲源性毒株;●Samples of the strain;▲High source sex strain。图4 INFB HA1基因进化系统树Fig.4 Influenza B virus HA1 gene evolutionary tree
3.3 HA1核苷酸序列分析
将5株INFB阳性样本与HA1基因进化系统树中亲缘性较高的毒株B/Brisbane/60/2008、B/Texas/AF2741/2010、B/HubeiJingzhouSongzi/1302/2010进行核苷酸序列比对,结果显示:5株INFB阳性样本之间的核苷酸同源性较高,在96.9%~99.4%;与2014—2015年WHO推荐的北半球国际疫苗株B/Brisbane/60/2008核苷酸同源性在86.1%~88.0%;与2012—2013年WHO推荐的北半球国际疫苗株B/Texas/AF2741/2010核苷酸同源性在86.0%~88.0%;与NCBI收录的湖北省INFB代表毒株B/HubeiJingzhouSongzi/1302/2010核苷酸同源性在86.1%~89.5%。结果详见图5。
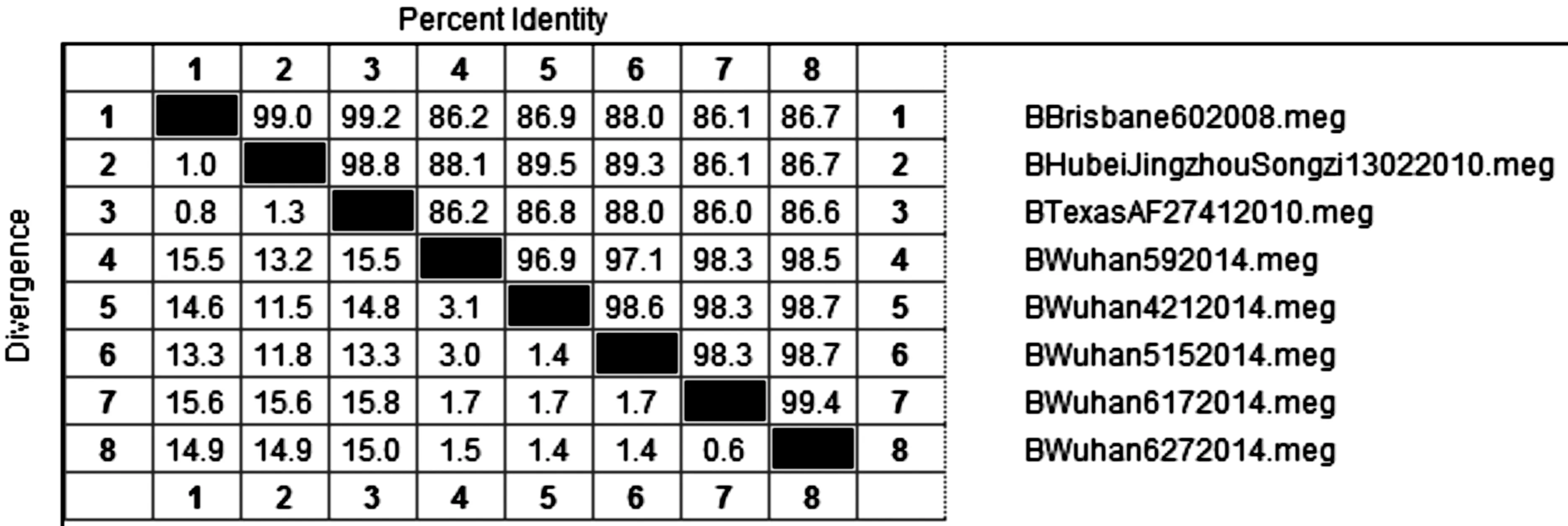
图5 核苷酸同源性对比(%)Fig.5 Nucleotide homology comparison(%)
3.4 HA1氨基酸序列分析
将5株INFB感染患儿样本和2014—2015年WHO推荐的疫苗株B/Brisbane/60/2008的核苷酸序列推导出氨基酸序列进行比对,结果显示(图6):5株INFB感染患儿样本与疫苗株B/Brisbane/60/2008相比,共发生了3处氨基酸替换,分别是第76位赖氨酸(K)→精氨酸(R)、第108位异亮氨酸(I)→缬氨酸(V)、第236位亮氨酸(L)→脯氨酸(P)。根据相关文献报道[8-9]:INFB HA1基因需在2~3个抗原决定簇上出现4个及以上氨基酸序列发生改变时,才能够确定一个新的变种。本组实验由此判定未发现新的变种。
4 讨论
INFB具有较强的感染力,不仅可通过空气飞沫直接传播,还能通过公共物品的间接接触传播[10-11]。本研究采集了2014年3月29日—2015年3月28日武汉市儿童医院患儿的呼吸道样本,研究结果显示:在该流感监测年度,除4月和11月未分离到INFB阳性样本外,其他月份均有INFB阳性检出;患儿感染INFB呈现双峰特征,分别出现在2014年8月和2015年1月,在随后的9月和次年2月阳性率逐渐降低,与相关报道相似[12];武汉市夏季湿热冬季干冷的气候特征,可能是INFB流行呈现双峰特征的重要原因之一。
INFB一直是武汉市流感流行的重要组成部分。虽为局部流行,但亦造成了较大的经济损失[13]。INFB抗原的突变性,是人们在接种疫苗后仍然能够被感染或者重复感染的主要原因,令人猝不及防。哨点监测作为预防和控制INFB流行的重要措施,也是进行流感流行预测和预警的基础[14]。本研究显示:发热、咳嗽、咽喉痛是患儿感染INFB的首要临床特征,13~24个月患儿感染INFB的概率比其他年龄段高。因此提醒监护人在发现儿童,特别是13~24个月的儿童,有发热、咳嗽、咽喉痛症状时,应及时就医。
一直以来,人们对INFB HA1基因的变异研究多侧重于长期的、整体的演变特征分析,缺乏短期的、局部的特征探讨,因此了解INFB局部流行演变情况具有重要意义。HA1基因分析结果表明:本研究检测的INFB均为Victoria系,与湖北省INFB代表毒株B/HubeiJingzhouSongzi/1302/2010同源性在86.1%~89.5%,该INFB可能为2010年湖北省荆州市松滋市INFB毒株进化而来。氨基酸序列对比结果表明:与2014—2015年WHO推荐疫苗株B/Brisbane/60/2008相比,本研究检测到的INFB只有3个氨基酸序列改变且核苷酸同源性较高,在86.1%~88.0%,疫苗株与流行株吻合性较好,因此预计接种本年度的流感疫苗对INFB流行株有较好的预防效果。但应在今后流感监测工作中进一步加强INFB HA1基因变异研究,注意氨基酸序列变异积累导致的新变种,为预测INFB的流行及INFB的预防和控制提供科学依据。
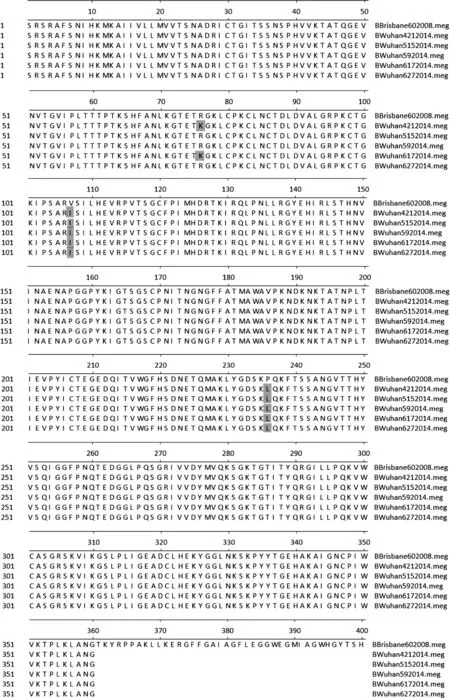
图6 氨基酸序列分析Fig.6 Amino acid sequence analysis
[1] 刘海燕, 林新勤, 唐昭, 等. 流感病毒研究概况[J]. 右江民族医学院学报, 2006, 27(6):909-911.
[2] 林丽华,谢剑锋,郑奎城.乙型流感病毒凝素和神经氨酸酶基因变异的研究进展[J].海峡预防医学杂志,2016(4):13-16.
[3] 杨帆, 廖国阳. 乙型流感病毒检测方法的研究进展[J]. 国际检验医学杂志, 2013, 10:29.
[4] COIRAS M T, PÉREZ-BREA P, GARCA M L, et al. Simultaneous detection of influenza A, B, and C viruses, respiratory syncytial virus, and adenoviruses in clinical samples by multiplex reverse transcription nested-PCR assay[J]. J Med Virol, 2003, 69:132-144.
[5] 黄文林.分子病毒学[M].2版.北京:人民卫生出版社,2006:434-439.
[6] 刘传楠, 朱洪浩. 1994—1995 年度武汉市流感监测概况[J]. 湖北预防医学杂志, 1996, 7(2):1-2.
[7] 谢正德, 肖艳, 刘春艳, 等. 儿童急性下呼吸道感染病毒病原学 2007—2010 年监测[J]. 中华儿科杂志, 2011, 49(10):745-749.
[8] CHARLAND K M L, BUCKERIDGE D L, STURTEVANT J L, et al. Effect of environmental factors on the spatio-temporal patterns of influenza spread[J]. Epidemiology and Infection, 2009, 137(10):1377-1387.
[9] CHEN G W, SHIH S R, HSIAO M R, et al. Multiple genotypes of influenza B viruses cocirculated in Taiwan in 2004 and 2005[J]. Journal of Clinical Microbiology, 2007, 45(5):1515-1522.
[10] 高燕,方立群,张勇,等.中国大陆季节性流感活动的时空分布特征[J].中华流行病学杂志,2009,30(11):1097-1110.
[11] 何翠, 张磊, 李科, 等. 北京地区 2009—2010 年乙型流感病毒的流行特征及 HA1 基因片段特性分析[J]. 中国预防医学杂志, 2010(10):995-999.
[12] 于娟, 饶华祥, 李红, 等. 青海省 2011—2012 年乙型流感病毒 HA1 基因特性研究[J]. 中国人兽共患病学报, 2014, 30(1):32-35.
[13] 方斌,刘琳琳,李翔,等.2010—2015年湖北省乙型流感病毒流行和进化分析[J].疾病监测,2016,31(7):554-560.
[14] 肖芳,李健雄,周珺,等.2013—2014年江西省乙型流感病毒HA1基因特性分析[J].中国卫生检验杂志,2015(17):2943-2946.
(责任编辑 马殷华)
Distribution and Analysis of Children’s Influenza B virusin Wuhan during 2014-2015
LAN Wenhua1, XIANG Yun2, AI Hongwu2, SONG Degui1, WU Jianguo3,XIONG Ying3, LIU Yan3, LIU Yingle3
(1. College of Life Science, Guangxi Normal University, Guilin Guangxi 541006, China; 2. Wuhan Children’s Hospital,Wuhan Hubei 430075, China; 3. College of Life Science, Wuhan University, Wuhan Hubei 430075, China)
Using micro plate method to isolate the influenza virus, Influenza B virus and its HA1 gene were identified by RT-PCR and Nested-PCR,The nucleotide sequence of HA1 gene were analyzed by Clustax, Mega6.0,Megalign. Results:47 influenza B positive samples were isolated from 1 002 fever samples collected from April, 2014 - to March, 2015. The highest isolation rate was found in August 2014, and January, 2015. The highest influenza B positive was found in 13~24 months old children,and the lowest positive rate was found in 0~6 months old children. There is no significant difference among children patients with influenza B virus infection in either-gender or departments source:87.23% of children of the Influenza B virus infection show the symptoms of fever and cough. HA1 fragment analysis indicates the isolated influenza B virus belongs to the Victoria strain, and shows a 86.1%~88.0% homology to the reference strain, B/Brisbane/60/2008 in nucleotide sequence. Three amino acids of the isolated strain were different from the reference strain. Conclusion:Influenza B virus isolated in Wuhan belongs to the Victoria strain, which has high homology with the international vaccine strain B/Brisbane/60/2008 and B/Texas/AF2741/2010 in the northern hemisphere and INFB representative strains in Hubei province. No new strain was found.
INFB; RT-PCR; nested PCR; HA1 gene
10.16088/j.issn.1001-6600.2016.04.022
2016-04-09
广西科学研究与技术开发计划项目基金资助(桂科重 14121003-3-1);国家科技重大专项课题基金资助(2012ZX10004207)
宋德贵(1954—),男,广西博白人,广西师范大学教授。E-mail:sondegui@163.com
R373.1
A
1001-6600(2016)04-0143-08

