补肾活血方在兔胫骨截骨延长过程中对TGF-β2基因表达的影响
庞卫祥许 超徐在强於秀玲
补肾活血方在兔胫骨截骨延长过程中对TGF-β2基因表达的影响
庞卫祥1许 超2徐在强1於秀玲1
目的探讨补肾活血方在牵张骨区域对转化生长因子-β2(TGF-β2)基因表达的影响。方法取健康雄性新西兰大耳白兔随机分为假手术组、模型组、补肾活血方组,造模完成后,假手术组不予任何药物灌胃;模型组以生理盐水灌胃;补肾活血方组采用中药灌胃。牵张成骨8周后处死,取各组兔右侧胫骨标本,进行HE染色病理组织形态观察、免疫组织化学检测、RT-PCR实验、影像学观察等。结果影像学、病理组织形态观察可见补肾活血方组兔截骨断端有新生骨生成,骨小梁排列、密度及面积较模型组整齐。模型组TGF-β2生长因子几乎没有(-)或仅有微弱表达(+/-),而补肾活血方组在间质细胞、骨细胞、成骨细胞及骨基质中TGF-β2均有表达;补肾活血方组与假手术组TGF-β2基因mRNA表达量明显高于模型组(0.512±0.080、0.546±0.087比0.381±0.093,孕<0.05)。结论 补肾活血方对兔截骨延长区TGF-β2基因表达具有明显的调控作用,通过对成骨细胞、骨基质等影响,刺激TGF-β2的分泌和合成,有利于新骨的生成。
兔;截骨延长;补肾活血方;TGF-β2;胫骨;基因表达;影响
自上世纪90年代McCarthy等[1]第一次成功采 用截骨手术后,该技术因手术操作简单易行,创伤性较小,周围组织、血管等亦能得到良好改善的优点,迅速得到推广。在牵张成骨过程中,涉及多种生长因子相互作用,其中转化生长因子-β2(TGF-β2)尤其重要。转化生长因子-β(transforming growth factorβ,TGF-β)由骨组织中的成骨细胞、破骨细胞及骨髓细胞等通过其特有的特性合成,是一种重要的骨生长调节因子,与多种调节生长因子协同作用,使成骨细胞聚集,从而促进骨的再生和修复[2-3]。但到目前为止,还没有形成统一的牵张成骨的分子学机制。本实验运用放射学检查、组织学检测等研究延长区骨愈合的过程,免疫组化检测及RT-PCR探讨延长区TGF-β2的表达情况。
1 实验材料
1.1 实验动物 健康雄性新西兰大耳白兔24只,体质量2.5~3.0kg,3月龄。购于浙江省实验动物中心,动物合格证号:SCXK(浙)2009-0015。饲养于浙江省中医药研究院,每个标准铁笼饲养1只,喂养清洁饲料由浙江省中医药研究院提供,温度22±1℃,相对湿度50%~70%,每1h换风15~20次,光照150~200Lx,12h明暗交替,噪音<50dB,自由摄食饮水,设有温度、湿度、光照、压力梯度等自动控制和显示系统,使用许可证:SYXK(浙)2008-0215。
1.2 实验器材 本实验所采用的骨延长器是张家港市富康医械制造有限公司制造的外固定器,为单边外固定支架系统。骨牵引针螺钉直径2.0mm,长度10cm,T型上钉器一套,螺杆外径为1.0cm,长度8cm,螺纹距为1mm/2圈,每延长一圈螺杆肢体延长0.5mm。
1.3 实验试剂与药物 10%水合氯醛(浙江省中医院制剂室)、3%戊巴比妥钠(上海博蕴生物科技有限公司)、庆大霉素(浙江瑞新药业)、10%甲醛溶液(浙江衢州巨化试剂有限公司)、进口脱钙液(北京中杉金桥生物技术有限公司)、TGF-β2抗体(北京中杉金桥生物技术有限公司)、SP试剂盒(北京中山技术有限公司)、RNA抽提和逆转录试剂盒(美国Invitrogen公司)、PCR试剂与引物(上海申友合成)等。补肾活血方:熟地黄9g,枸杞、杜仲(姜制)、炒山药、桃仁、制附子各6g,山茱萸、肉桂、炙甘草、红花各3g(中药材由浙江中医药大学药学院提供,中药制剂由浙江杭州红叶制药有限公司制备,每毫升含生药2g)。
2 实验方法
2.1 兔胫骨截骨延长术牵张成骨实验动物模型制备完全随机方法将24只新西兰大白兔分为假手术组、模型组和补肾活血方组,每组8只。3%戊巴比妥溶液1mL/kg静脉注射麻醉后,保持手术区无污染,将兔左侧卧位于手术台上,将右后肢脱毛、消毒、铺无菌单。胫骨结节下方1cm处行前内侧切口纵行切开皮肤深达骨膜。假手术组仅将胫骨中段肌肉组织切断,庆大霉素加生理盐水冲洗后缝合。模型组和补肾活血方组于骨膜下剥离,低速电钻垂直胫骨,在胫骨结节水平及其下方2cm处穿入两组直径1.2mm克氏针,后拔出克氏针,将外固定器置于胫骨(直径2.0mm,深度为15mm),用线锯于上两组克氏针之间横行锯断胫骨,同时截断腓骨,对位后安放自行设计单边外固定器使其固定,庆大霉素加生理盐水冲洗后,直视下将截骨断端解剖对位加压固定,逐层缝合组织。术后均给予青霉素肌肉注射40万U/只,1天1次,连续5天;每日予以PVP碘伤口消毒,连续5天。
2.2 给药方式 假手术组:术后不予任何灌胃处理。模型组:自截骨术后第1天,给予生理盐水8mL/只灌胃,1天1次,连续灌胃4周。补肾活血方组:大白兔口饲给药剂量均按成人日用临床剂量,经人-大白兔体表面积比值折算成8mL/只,自截骨术后第一天起灌胃,1天1次,连续灌胃4周。
2.3 实验标本的采集及制片 造模8周后,取右侧胫骨全段(新鲜样本)后处死所有实验动物,解剖胫骨,剔净周围软组织,尽量完整保留骨痂部分组织。取胫骨延长区标本放入10%中性甲醛缓冲溶液固定,进口脱钙液脱钙,常规脱水、浸蜡、包埋、切片、HE染色,光镜观察骨小梁及骨形态基质,并通过组织学观察截骨端的愈合情况,光镜下观察牵张骨区域骨细胞坏死、核浓缩情况。
2.4 免疫组织化学检测 取造模8周后的胫骨组织切片,用3%过氧化氢封闭内源酶,正常羊血清封闭非特异性染色,按常规SP方法兔疫组化染色。据Tavkli的免疫染色评分系统进行观察分析[4]。“+++”、“++”、“+”分别代表染色的强、中、弱,“-”代表染色为阴性,“+/-”代表不确定或极微阳性染色。
2.5 RT-PCR实验 先采用Trizol一步法提取组织的总mRNA,再根据Revertaid TM First Strand cDNA Synthesis Kit说明书,以总mRNA为模板合成相应的互补cDNA,反应体系为30μL,反应条件为70℃变性5min,42℃反转录1h,最后70℃ 5min灭活反转录酶。最后进行cDNA的PCR扩增,反应体系为50μL,反应条件为94℃预变性5min,94℃变性30s,52℃退火30s,72℃延伸30s,共循环29次,最后72℃再延伸5min(CR扩增的目的基因为TGF-β2,以GAPDH为内参),对比各组mRNA的表达量。本实验采用的引物为TGF-β2上游5’-CTCGTCACTCGGGTCGTAAT-3’、下游5’-CCAGACCATGATCACACAG G-3’;β-actin上游5’-GCACCGTCAAGGCTAGAAC-3’、下游5’-TGGTGAAGACGCCAGTGGA-3’。
2.6 放射学检测 取延长区标本,做好标记。拍摄标准的新西兰大耳白兔右侧胫骨侧位数字放射线片,观察标本截骨延长区对位、连接情况、周围骨痂生长情况和新生骨生成,同时观察截骨延长区域骨皮质、骨截面情况。
2.7 统计学方法 应用SPSS17.0统计软件,计量资料以均数±标准差(±s )表示,多样本比较采用单因素方差分析(One-way ANOVA),方差齐性采用LSD法,不同分组观察时采用方差分析,方差不齐采用Dunnett's T3,以孕<0.05为差异有统计学意义。
3 结果
3.1 免疫组织化学观察 在牵张成骨区新生骨组织中,模型组TGF-β2生长因子几乎没有(-)或仅有微弱表达(+/-)。而补肾活血方组在间质细胞、骨细胞、成骨细胞及骨基质中对TGF-β2生长因子均有表达,表达水平不同,且于成骨细胞中呈强阳性(+++),见表1。
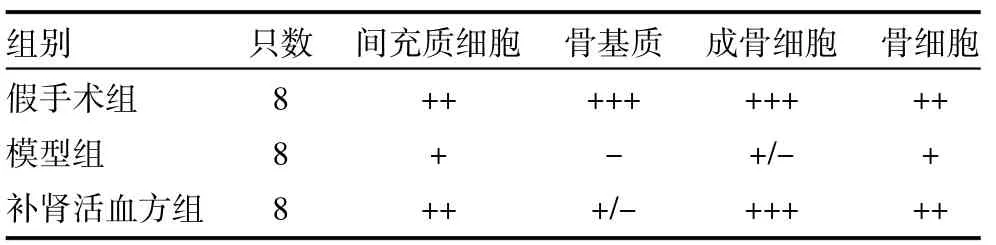
表1 TGF-β2染色分级比较
3.2 TGF-β2基因表达 RT-PCR检测结果显示,补肾活血方组与假手术组TGF-β2基因mRNA表达量明显高于模型组(孕<0.05),见表2。
表2 TGF-β2基因mRNA表达量比较(±s)
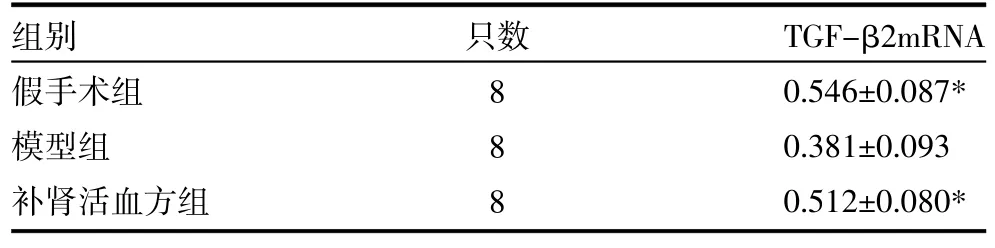
表2 TGF-β2基因mRNA表达量比较(±s)
注:与模型组比较,*孕<0.05
组别假手术组模型组补肾活血方组只数8 8 8 TGF-β2mRNA 0.546±0.087* 0.381±0.093 0.512±0.080*
3.3 右侧胫骨标本X片影像观察结果 造模8周后,模型组有少量骨痂生成,形成不规则的骨痂连接,截骨面较为模糊;而补肾活血方组在截骨断端可见有规则的骨痂连接,骨皮质清晰可见,有新生骨生成,与自身组织融合较好,见图1(插页)。
3.4 组织病理学观察 假手术组骨皮质连续完整较好、致密均匀,软骨面光滑,骨小梁粗细适中、均匀,排列整齐,无断裂、稀疏变窄等改变,无炎性区域出现,与主应力的方向一致。模型组右侧胫骨外侧骨皮质结构不完整,骨小梁粗细、排列较假手术组与补肾活血方组明显不均匀、紊乱,与主应力的方向不一致,大量内侧骨皮基质破坏,软骨基质不均匀,骨小梁稀疏,有些区域呈连续性小梁,少量软骨细胞生成,有大量炎性反应伴骨吸收。见图2(插页)。
4 讨 论
牵张成骨是在特定机械张力作用下的特殊骨再生技术,涉及多种生长因子相互作用。近年来,关于转化生长因子TGF-β调节骨生长、骨愈合过程的机制是研究的重点,其中转化生长因子-β2(TGF-β2)在牵张成骨中占有非常重要的地位。本实验通过相关检测证实补肾活血中药组中TGF-β2基因的表达量显著高于模型组,说明TGF-β2基因在中药组中的高表达与补肾活血中药在牵张成骨中的作用密不可分。RT-PCR检测结果显示,补肾活血方组与及假手术组TGF-β2基因的mRNA表达量明显高于模型组(孕<0.05)。因此,我们认为良好的牵张成骨效果获益于补肾活血中药对转化生长因子(TGF-β2)基因的明显调控作用。
许兵等[5]研究证明,补肾活血颗粒可提高雌激素水平,由此促进骨的生成,增加骨量。臧洪敏等[6]将不同浓度的补肾活血方应用于临床研究对比,结果大量矿化结节形成,从而获得良好的骨形态表现。本实验通过组织学观察显示,模型组少量软骨细胞生成,有大量炎性反应伴骨吸收。骨小梁扭曲明显,甚至断裂,其骨小梁间隙增宽或骨小梁变细薄,密度较低或面积低于其余两组;而补肾活血方组骨小梁排列、密度及面积较模型组整齐,其骨小梁间隙虽有增大,但无模型组明显,牵张成骨区部分骨细胞坏死,部分细胞核浓缩、破裂,甚至消失。伴有少量炎性细胞、软骨细胞生成,血管数量增多,明显网状新骨生成。临床上活血化瘀是牵张成骨的早期治疗原则,本实验结果提示,补肾活血方促进TGF-β2的分泌而对成骨细胞的增殖、分化起到重要推动作用。说明本实验通过补肾活血中药的干预,使成骨细胞不断增多,加速合成、分泌TGF-β2生长因子。
以往研究[7]亦表明TGF-β2可促进骨细胞增殖与分化,通过成骨细胞调节骨重建,TGF-β2在创伤愈合、新骨组织修复重建及新生骨形成中都起着至关重要的作用。Yeung HY等[8]关于TGF-β2在牵张成骨骨痂和骨折时骨痂表达的对比研究,显示TGF-β2均有高表达迹象。吴巍等[9]研究表明TGF-β2在牵张成骨的过程中已成为新骨生成的重要驱动因素,成骨细胞在受到牵张机械力作用下数目大量增加,与此同时,该转化生长因子的表达也相应增加。可见通过补充其它细胞因子激活的已分化细胞是TGF-β2对骨形成的基本作用。TGF-β2与其它多种调节生长因子共同作用参与细胞分化,使成骨细胞聚集,从而促进骨的再生和修复,Schliephake H[10]研究证实多种生长因子共同参与牵张成骨的过程,但具体的生物学分子机制还不明确。本实验在免疫观察中显示,模型组TGF-β2生长因子几乎没有(-)或仅有微弱表达(+/-),而补肾活血方组在间质细胞、骨细胞、成骨细胞及骨基质中对TGF-β2生长因子均有表达,表达水平不同,且于成骨细胞中呈强阳性(+++)。说明TGF-β2的表达由牵张两侧向牵张中心移行,对成骨细胞的生成有促进作用。也说明补肾活血方中药可促进成骨细胞、骨细胞及骨基质等生成,从而加速TGF-β2生长因子的合成分泌,对TGF-β2基因表达有明显的调控作用。
利用影像学评价牵张间隙内新生骨骨组织,推断新骨生成,国内已有相关文献报道。李华[11]在牵张成骨新生骨评价方法的研究及应用进展已有明确表述。因此,本实验从影像学检查观察,模型组有少量骨痂生成,形成不规则的骨痂连接,截骨面较为模糊;而补肾活血方组在截骨断端可见有规则的骨痂连接,骨皮质清晰可见,有新生骨生成,与自身组织融合较好。由此可推断,补肾活血方在截骨延长术过程中能积极促进TGF-β2基因表达,从而促进新骨的生成。崔明军等[12]在山羊下颌骨牵张成骨的影像学观察研究中也证实了其成骨效果。邵桢等[13]在下颌骨牵张成骨实验中得出TGF-β2持续高表达,尤其于新骨小梁成骨细胞带,同其它因子共同刺激成骨细胞合成。
综上所述,补肾活血中药通过补肾壮骨、活血化瘀,减少炎性渗出,促进血液循环,使成骨细胞、软骨细胞等骨细胞活性始终处于活跃状态,TGF-β2分泌增加,促进牵张成骨效果,利于新骨生成,为临床应用补肾活血复方提供可靠的理论依据,也为中医药应用于牵张成骨提供理论依据。
[1]McCarthy JG,Schreiber J,Karp N,et al.Lengthening the human mandible by gradual distraction[J].Plast Reconstr Surg,1992,89(1):1-10.
[2]Erebacher A,Filvaroff EH,Ye JQ,et al.Osteoblastic responses to TGF-beta during bone remodeling[J].Mol Biol Cell,1998,9(7):1903-1918.
[3]TaKai H,Kanematu M,Yano K,et al.Transforming growth factor-beta stimulates the production of osteoprotegerin osteoclastogenesis inhibitory factor by bone marrow stromal cell[J].J Biol Chem,1998,273(42):27091-27096.
[4]Tavkoli K,Yu Y,Shasid S,et al.Expression of growth factors in the mandibular distraction zone:a sheep study[J].Bri J plast surg,1999,52(6):434-439.
[5]许兵,方剑利,刘慧,等.补肾活血方对去势大鼠骨质疏松的影响[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(3): 177-182.
[6]臧洪敏,陈君长,刘亦恒,等.补肾活血方对大鼠成骨细胞增殖分化及矿化的影响[J].中国中西医结合杂志,2005,25(12):1112-1114.
[7]Wildemann B,Schmidmaier G,Brenner N,et al.Quantification,localization,and Expression of IGF-I and TGF-beta1 during growth factor-stimulated fracture healing[J].TissueInt,2004,74(4):388-397.
[8]Yeung HY,Lee KM,Fung KP,et al.Sustained expression of transforming-growth-factor-betal by distractionduring distraction osteogenesis[J].Life Sci,2002,71(1):67-79.
[9]吴巍,姚欣欣,朱辛奕,等.TGF-β在骨组织中作用的研究进展[J].吉林医药学院学报,2009,30(1):45-47.
[10]Schliephake H.B one growth factors in m axillofacial skeletal reconstruction[J].Int J Oral Maxillofac Surg,2002,31 (5):469-484.
[11]李华.牵张成骨新生骨评价方法的研究及应用进展[J].山东医药,2012,52(14):94-95.
[12]崔明军,徐克,孙婷婷,等.山羊下颌骨牵张成骨的影像学观察[J].南通大学学报,2011,31(6):430-432.
[13]邵桢,刘彦普,刘宝林,等.下颌骨牵张成骨的组织学观察及转化生长因子β1表达[J].中华创伤杂志,2001,17 (7):395-397.
(收稿:2016-02-07 修回:2016-04-29)
Impact of Bushen Huoxue Decoction on the Expression of TGF-β2 Gene of Rabbits after Tibial Lengthen-ing Osteotomy
PANG Weixiang1,XU Chao2,XU Zaiqiang1,YU Xiuling1.1 Zhejiang Chinese Medical University,Hangzhou(310053),China;2 Department of Osteotology,the Second Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou(310005),China
ObjectiveTo investigate the effect of Bushen huoxue decoction on the expression of TGF-β2 gene in distraction area after tibial osteotomy.MethodsHealthy male New Zealand big-eared rabbits were randomly divided into sham-operation group,model group and Bushen huoxue decoction group.After operation,sham-operation group was not given any drug;model group was given normal saline by lavage;and Bushen huoxue decoction group was administered with the Chinese medicine by lavage.After 8 weeks of distraction osteogenesis,all rabbits were sacrificed to make tibial specimens for the histopathologic morphology observation with H-E staining,immunohistochemical detection,RT-PCR experiments,and imaging observation.ResultsImaging and histopatholigic morphology observation showed that new bone formation was observed in Bushen huoxue decoction group and that compared with model group,rabbits trabecular bone in Bushen huoxue decoction group were neatly arranged,the bone density and area were close to normal.The expression of TGF-β2 gene was nearly not observable in model group,while it was observed in mesenchymal cells,osteocytes,and osteoblasts in Bushen huoxue decoction group. The mRNA expression of TGF-β2 gene in Bushen huoxue decoction group and sham-operation group was higher than that in model group(0.512 0.080,0.546 0.087 vs 0.381 0.093,孕<0.05).ConclusionBushen huoxue decoction can regulate the expression of TGF-β2 gene in osteoblasts and bone matrix during distraction osteogenesis to accelerate new bone formation.
rabbit;distraction lengthening;Bushen huoxue decoction;TGF-β2;tibia;gene expression;effect
浙江省中医药科技计划项目(No.2012ZB058)
1浙江中医药大学(杭州 310053);2浙江中医药大学第二附属医院骨二科(杭州 310005)
许超,Tel:13336047228;E-mail:docxuchao@126.com

