大鼠鼻窦黏膜干细胞的分离培养和成骨能力研究
姒蜜思赖恺晨石 珏夏佳佳程志鹏
大鼠鼻窦黏膜干细胞的分离培养和成骨能力研究
姒蜜思1赖恺晨2石 珏3夏佳佳4程志鹏1
目的明确大鼠鼻窦结构,尝试体外分离培养鼻窦黏膜干细胞,检测其多向分化能力,为口腔颌面部骨缺损修复治疗的体外研究寻找新的种子细胞。方法选用3月龄SD大鼠,进行口腔颌面部和鼻窦解剖,制作冠状位石蜡切片观察鼻窦形态和黏膜成分。取鼻窦内衬黏膜,改良酶消化法进行间充质干细胞(SMSCs)分离培养,检测其成克隆能力,使用流式细胞术进行间充质干细胞表面标志物鉴定。油红O染色检测SMSCs的成脂肪能力,茜素红染色和碱性磷酸酶(ALP)活性测试检验SMSCs的成骨能力,并与大鼠牙龈来源间充质干细胞(GMSCs)、大鼠骨髓来源间充质干细胞(BMSCs)比较。结果SD大鼠具有结构清晰的上颌窦,窦腔内衬黏膜呈现典型的三层结构。使用该内衬黏膜能够成功分离培养出具有多向分化能力和成克隆能力且带有间充质干细胞表面标志物的SMSCs细胞。在成骨培养基诱导下,SMSCs胞外基质矿化能力与GMSCs和BMSCs相比差异无统计学意义(孕>0.05)。但14天时SMSCs的ALP活性显著大于GMSCs(孕<0.05)。结论SD大鼠鼻窦内衬黏膜可成功分离培养出具有体外成骨能力的间充质干细胞,为口腔颌面部骨组织工程研究提供新的细胞选择。
大鼠;鼻窦黏膜;间充质干细胞;细胞培养;细胞分化;骨组织工程
上颌后牙区骨量不足是口腔种植修复治疗中的常见问题,临床上常使用提升上颌窦黏膜进行骨增量的方法来保证种植体的成功植入。虽然上颌窦黏膜提升术的治疗方法多样,但窦腔内成骨效果并不稳定[1]。研究[2-3]表明,上颌窦黏膜中可能存在具有成骨潜力的间充质干细胞(SMSCs),对窦腔内新骨生成起到关键作用。如何激发SMSCs的成骨潜力,加速上颌窦黏膜下骨新生,保证上颌后牙区种植体功能长期稳定是目前国际研究的热点。然而,由于伦理学限制,很难取得健康人上颌窦黏膜组织用于体内外研究。寻找易于获取、与人相近的动物替代模型,并使用便捷可靠的方法对SMSCs进行分离和体外培养,全面了解其细胞特征和成骨分化能力,是相关研究开展的基础。本研究观察和分析大鼠鼻窦的解剖结构和黏膜成分,并从大鼠鼻窦黏膜中尝试分离SMSCs,研究其细胞行为和多向分化能力,并与骨髓来源和牙龈来源的间充质干细胞(BMSCs和GMSCs)进行比较。本研究拟从微观角度对临床和动物研究中观察到的上颌窦黏膜成骨作用做出初步解释,并为进一步利用SMSCs作为种子细胞、开发适用于口腔及头面部骨缺损修复的新型组织工程材料做好准备。
1 材料与方法
1.1 实验材料和仪器 实验动物:3月龄雄性SD大鼠8只,平均体质量250g,由上海斯莱克实验动物有限公司提供(许可证号:SCXK沪2012-0002),饲养于浙江大学动物中心。主要试剂:α-MEM培养基(美国Gibco公司)、胎牛血清(美国Gibco公司)、Dispase酶(美国Sigma公司)、I型胶原酶(美国Sigma公司)、流式细胞分析单克隆抗体(美国R&D Systems公司)、甲苯胺蓝染色液、茜素红染色液、油红O染色液、碱性磷酸酶(ALP)检测试剂盒、BCA蛋白浓度测定试剂盒等(均购自江苏碧云天生物技术公司)。主要仪器:流式细胞分析仪(FC500MCL,美国Beckman Coulter)、体视显微镜(日本Olympus)、倒置光学显微镜(日本Olympus)、细胞培养箱(美国Thermo公司)、多光谱酶标系统(Tecan,infinite,m200,瑞士TECAN)等。
1.2 实验方法
1.2.1 大鼠鼻窦及内衬黏膜的观察分析 取3月龄雄性SD大鼠,水合氯醛过量麻醉处死后,在体式显微镜下截取整个头骨和上颌,尽量剔除外表面软组织。使用10%福尔马林固定,酒精脱水,二甲苯透明,浸蜡包埋后行冠状位切片固定。制作好的石蜡切片使用苏木精-伊红(HE)染色,显微镜下观察鼻窦结构和内衬黏膜成分。
1.2.2 大鼠SMSCs的分离培养 (1)改良酶消化法原代培养:取3月龄雄性SD大鼠5只,按上述方法处死后,在75%酒精中浸泡消毒约5min后移至超净台,并解剖鼻腔及鼻旁窦。小心剥离鼻窦腔内衬黏膜,置于含抗生素的磷酸缓冲液(PBS)中反复冲洗,加4mg/mL的Dispase,置于37℃、5%CO2培养箱中消化30min。体式显微镜下分离弃去上皮层,并将剩下的组织尽可能剪碎,加入3mg/mL的I型胶原酶置培养箱中继续消化20min。加入含10%胎牛血清(FBS)的α-MEM培养液,置于培养箱中培养,每3天换液1次,直至细胞生长达80%融合(此时为P0)。(2)单克隆培养:取上述P0细胞,消化后制成单细胞悬液,调整细胞密度并接种于96孔板中,保证每孔1~2个细胞,当细胞汇合长至孔底1/2时,将细胞消化转移至25cm2培养瓶扩大培养(P1)。
1.2.3 大鼠SMSCs表面标志物鉴定 使用流式细胞分选技术(FACS)检测间充质干细胞相关表面标志物。使用的细胞表面特异性单克隆抗体有:CD14、CD34、CD45、CD90、CD105、STRO-1。
1.2.4 大鼠SMSCs成克隆能力分析 取P2代SMSCs细胞,按1×103个/皿接种于10cm的培养皿中,加10%FBS的α-MEM培养液常规培养14天,使用4%多聚甲醛室温固定、甲苯胺蓝染色后观察细胞克隆形态。大于50个细胞的集落记为1个克隆,计算细胞克隆形成效率。克隆形成率=细胞克隆形成数/接种细胞数×100%。
1.2.5 大鼠SMSCs、GMSCs和BMSCs的多向分化能力比较
1.2.5.1 大鼠 GMSCs和 BMSCs获取 在获取SMSCs的同时进行大鼠GMSCs和BMSCs分离。按上述方法处死3月龄SD雄性大鼠后,切取双侧磨牙周围牙龈组织。使用改良酶消化法(同SMSCs)进行GMSCs原代培养。同时无菌取出完整胫骨和股骨,剔除软组织及两端部分骨组织,露出骨髓腔。用一次性无菌注射器吸取新鲜α-MEM培养基反复冲洗骨髓腔,将细胞冲洗液置培养皿中进行BMSCs原代培养。获取原代GMSCs和BMSCs后再进行单克隆培养和表面标志物鉴定。
1.2.5.2 成骨分化能力鉴定 在α-MEM培养基中加入10mmol/Lβ-甘油磷酸钠、50μmol/L维生VC、0.1μmol/L地塞米松、10%FBS制成成骨诱导培养基。使用α-MEM培养基作为非诱导性对照培养基。将P2代SMSCs、GMSCs和BMSCs按5×104个/孔分别接种于6孔板中,使用成骨诱导培养基和非诱导性培养基培养。在培养的第7天和第14天使用碱性磷酸酶检测试剂盒和BCA蛋白浓度测定试剂盒测定ALP浓度和总蛋白浓度,按ALP/BCA计算出ALP的相对浓度,代表培养物的ALP活性。在培养的第21天使用茜素红染色观察胞外基质矿化情况。
1.2.5.3 成脂分化能力鉴定 在α-MEM培养基中加入1μmol/L地塞米松、0.5mmol/L甲基黄嘌呤异丁酯、10μmol/L胰岛素、200μmol/L吲哚美辛、10%FBS制成成脂诱导培养基。使用α-MEM培养基作为非诱导性对照培养基。将P2代SMSCs、GMSCs和BMSCs按5×104个/孔分别接种于6孔板中,使用成脂诱导培养基和非诱导性培养基培养28天。使用4%多聚甲醛室温固定、0.05%油红O染色后观察培养物中脂滴形成情况。
1.3 统计学方法 应用IBM SPSS 20.0软件进行数据分析,计量数据以(±s) 表示。检验数据正态性和方差齐性,并使用One-way-ANOVA进行组间比较,需多重比较时使用Bonferroni法。检验水准α=0.05。
2 结果
2.1 大鼠鼻窦结构及内衬黏膜成分 大体解剖见SD大鼠鼻道外侧有“小室”样的鼻旁窦结构,与鼻道间有不完整的薄层骨壁相隔。鼻道和鼻窦腔内面有薄纱状内衬黏膜,表面有少量黏液。显微镜下观察大鼠头骨冠状位切片,可见鼻道旁鼻窦样结构(大鼠上颌窦,图1A,见封二),与鼻道有交通。鼻窦内衬黏膜呈现典型的三层结构,自腔内面至骨面依次为:假复层纤毛柱状上皮、富含血管和小腺体的黏膜下层、紧贴骨面的骨膜样结构(图1B,见封二)。
2.2 大鼠SMSCs表面标志物和成克隆能力 FACS结果表明,从5只SD大鼠获取的SMSCs细胞表面标志物CD14、CD34、CD45表达阴性,CD90、CD105、STRO-1表达阳性,见表1。培养12天后,细胞呈长梭形,形态类似成纤维细胞,核呈椭圆形,能形成典型的干细胞克隆形态(图1C,见封二),克隆成形率平均为29.3%。
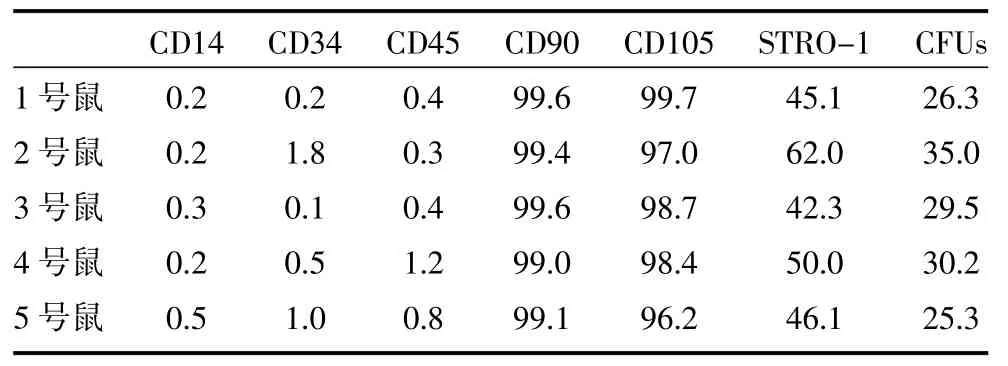
表1 大鼠鼻窦黏膜干细胞(SMSCs)表面标志物表达(%)和成克隆能力(%)
2.3 大鼠SMSCs、GMSCs和BMSCs的多向分化能力比较 茜素红染色结果表明大鼠SMSCs胞外基质矿化能力与GMSCs和BMSCs相当。三种细胞均能在成骨诱导培养情况下形成大量的矿化结节(图2,见封二),说明三种细胞体外成骨能力基本相似。7天和14天时三种细胞诱导组ALP活性均显著高于非诱导对照组(孕<0.05)。三种细胞相比较,诱导组7天时ALP活性无显著差异(孕>0.05),14天时SMSCs的ALP活性显著大于GMSCs(孕<0.05),但与BMSCs相比无显著性差异(孕>0.05),见图3(封二)。使用成脂诱导基培养28天后,油红O染色结果表明大鼠GMSCs胞内外形成大量橘色脂滴,但SMSCs和BMSCs的脂滴形成较少(图2,见封二)。说明GMSCs成脂肪能力较强,而SMSCs和BMSCs成脂肪能力较弱。
3 讨 论
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新能力,并具有多向分化潜力的干细胞。它对骨组织、软骨组织、脂肪、肌肉、肌腱、韧带等的发育和修复有重要作用[4]。虽然目前MSCs在骨组织工程和细胞治疗领域的研究和应用受到广泛关注,但可用于研究的MSC种类却较少。最常用的是骨髓来源的间充质干细胞(BMSCs),其次是从脂肪组织、牙髓组织和脐带及血管周围细胞等来源的MSCs。对于颌面部器官来源的MSCs却知之甚少[5]。由于口腔种植修复相关上颌窦提升术的发展需要,近期陆续有研究从人上颌窦黏膜固有层中发现了一种新的间充质干细胞种类——SMSCs[2-3],成为上颌窦内成骨研究的重大突破。SMSCs与颌面部来源的其他间充质干细胞一样,来源于外胚层的神经嵴部分,并能在一定条件的刺激下分化为成骨细胞,参与到成骨过程中。
本研究使用组织学方法对大鼠鼻道和鼻窦结构进行了分析,证实大鼠存在相对完整的上颌窦样结构。在鼻窦内表面存在完整的内衬黏膜,其三层结构与先前研究报道的人上颌窦黏膜成分一致[6]。这为从大鼠鼻窦黏膜中分离出SMSCs提供了理论前提。本研究接下来使用了改良酶消化法成功体外分离培养出大鼠SMSCs,并证明其具有多向分化能力,并能表达符合MSCs鉴定标准的细胞表面标志物[4]。在体外成骨能力方面,SMSCs与牙龈来源的GMSCs和骨髓来源的BMSCs能力相当。kim等[6]和Graziano等[7]从人和其他动物上颌窦黏膜中分离出的SMSCs也表现出与本研究相似的体外成骨能力。证明大鼠SMSCs与人或其他动物来源的SMSCs一样,可用于骨再生研究。
另一方面,本研究结果还表明,与BMSCs、尤其是GMSCs相比,SMSCs显示出较弱的体外成脂分化能力。SMSCs在体外较难被诱导分化为脂肪组织。先前研究报道,呼吸道来源的MSCs与BMSCs相比,增殖速度和向成骨细胞分化的倾向性上虽然有明显优势,但不易被诱导分化为软骨细胞和脂肪细胞[8]。这也进一步说明了不同来源的MSCs具有不同的细胞特征,也可能具有不同的多向分化能力[4]。故在不同的部位使用与该部位同源的MSCs可能获得更好的效果[9]。
本研究结果还发现,SMSCs在成骨诱导7天和14天时ALP活性维持在一个稳定的水平。且在14天时,SMSCs的ALP活性显著高于牙龈来源的GMSCs(孕<0.05),甚至高于BMSCs(孕>0.05)。这说明与其他来源的MSCs相比,SMSCs骨再生相关蛋白(ALP)的活性维持时间较长,可能在较长时间内(14天)维持高水平的骨再生能力。这一结果不仅能对临床上观察到的上颌窦内长时间持续成骨现象做出解释,并对寻找更适合此区域的骨增量方法提供了新的研究方向。
但也有研究不认同上颌窦黏膜的成骨能力。Scala等[10-11]利用灵长类动物进行单纯上颌窦提升术而不植入任何骨材料时发现,虽然在上颌窦腔内产生了一定量的新生骨,但这种新生骨只存在于靠近原有窦底的种植体两侧,而种植体根尖部分始终没有新骨生成。也有研究提出,SMSCs只有在某些特殊培养情况中才表现出向成骨细胞分化的潜力[7]。因而推测SMSCs的成骨分化是有条件的,可能受到一些细胞因子的调控。但究竟是哪些因子参与此作用,其调控机制又如何,需要进一步研究。
本研究结果证明,SD大鼠鼻窦内衬黏膜可成功分离培养出具有体外成骨能力的间充质干细胞,为口腔颌面部骨组织工程研究提供新的细胞选择。
[1]Pjetursson BE,Tan WC,Zwahlen M,et al.A systematic review of the success of sinus floor elevation and survival of implants inserted in combination with sinus floor elevation [J].Journal of clinical periodontology,2008,35(8 Suppl): 216-240.
[2]Srouji S,Kizhner T,Ben David D,et al.The Schneiderian membrane contains osteoprogenitor cells:in vivo and in vitro study[J].Calcified tissue international,2009,84(2): 138-145.
[3]Srouji S,Ben-David D,Lotan R,et al.The innate osteogenic potential of the maxillary sinus(Schneiderian)membrane: an ectopic tissue transplant model simulating sinus lifting [J].International journal of oral and maxillofacial surgery,2010,39(8):793-801.
[4]Keating A.Mesenchymal stromal cells:new directions[J]. Cell stem cell,2012,10(6):709-716.
[5]Jakob M,Hemeda H,Bruderek K,et al.Comparative functional cell biological analysis of mesenchymal stem cells of the head and neck region:potential impact on wound healing,trauma,andinfection[J].Head&neck,2013,35(11): 1621-1629.
[6]Kim SW,Lee IK,Yun KI,et al.Adult stem cells derived from human maxillary sinus membrane and their osteogenic differentiation[J].The International journal of oral&maxillofacial implants,2009,24(6):991-998.
[7]Graziano A,Benedetti L,Massei G,et al.Bone production by human maxillary sinus mucosa cells[J].Journal of cellular physiology,2012,227(9):3278-3281.
[8]Delorme B,Nivet E,Gaillard J,et al.The human nose harbors a niche of olfactory ectomesenchymal stem cells displaying neurogenic and osteogenic properties[J].Stem cells and development,2010,19(6):853-866.
[9]Zhang W,Zhang X,Wang S,et al.Comparison of the use of adipose tissue-derived and bone marrow-derived stem cells for rapid bone regeneration[J].Journal of dental research,2013,92(12):1136-1141.
[10]Scala A,Botticelli D,Rangel IG,et al.Early healing after elevation of the maxillary sinus floor applying a lateral access:a histological study in monkeys[J].Clinical oral im-plants research,2010,21(12):1320-1326.
[11]Scala A,Botticelli D,Faeda RS,et al.Lack of influence of the Schneiderian membrane in forming new bone apical to implants simultaneously installed with sinus floor elevation:an experimental study in monkeys[J].Clinical oral implants research,2012,23(2):175-181.
(收稿:2016-06-01 修回:2016-06-28)
Isolation and Osteogenic Differentiation of Mesenchymal Stem Cells Derived from Rat Sinus Membrane
SIMisi1,LAI Kaichen2,SHI Jue3,XIA Jiajia4,CHENG Zhipeng1. 1 Department of Implantology,Stomatology Hospital affiliated to School of Medicine,Zhejiang University,Hangzhou(310000),China;2 Faculty of Stomatology and Dentistry,School of Medicine,Zhejiang University,Hangzhou(310000),China;3 Department of Oral and Maxillo-Facial Surgery,Stomatology Hospital affiliated to School of Medicine,Zhejiang University,Hangzhou(310000),China;4 Department of Stomatology,Binjiang Branch of Second Affiliated Hospital,School of Medicine,Zhejiang University, Hangzhou(310000),China
ObjectiveTo investigate the anatomy of rat sinus in order to isolate mesenchymal stem cells (MSCs)from rat sinus membrane and compare its differentiation capability with MSCs derived from other tissues.MethodsEight Sprague-Dawley rats of 3 months were sacrificed.Paraffin sections of rat skulls with HE staining were prepared for anatomic structure observation.MSCs were isolated from the lining membrane of the rat sinus by modified enzyme digestion(SMSCs).The cell surface markers were characterized by flow cytometric analysis.The self-renewal capability was tested by colony-forming units(CFUs)assay.Its potential of osteogenic and adipogenic differentiation were analyzed by Alizarin red staining,alkaline phosphatase(ALP)activity and Oil red O staining, whose results were compared with gingival and bone marrow derived MSCs(GMSCs and BMSCs).ResultsAn obvious structure of paranasal sinus and its three-layer lining membrane were observed on sections of rat skull.SMSCs with multi-lineage differentiation and colony-forming capability were isolated from rat sinus membrane.After certain days of osteogenic induction,the extra-cellular calcification showed no significant differences among SMSCs, GMSCs and BMSCs(孕>0.05).But the ALP activity of SMSCs at 14 days was significant higher than that of GMSCs.ConclusionSMSCs of comparable osteogenic potential can be isolated and cultured in vitro from the sinus membrane of Sprague-Dawley rats.This might provide a new cell resource for future studies on bone regenerationin oral and maxillo-facial surgery.
rats;sinus membrane;mesenchymal stem cells;cell culture;differentiation;bone regeneration
浙江省教育厅科研项目(No.Y201431418);国家自然科学基金青年项目(No.81401774)
1浙江大学医学院附属口腔医院口腔种植科(杭州 310000);2浙江大学医学院口腔医学系(杭州 310000);3浙江大学医学院附属口腔医院口腔颌面外科(杭州 310000);4浙江大学医学院附属第二医院滨江分院口腔科(杭州 310000)
姒蜜思,E-mail:mickeysimisi@hotmail.com

