超声辅助双酶法制备RS3型籼米抗性淀粉工艺参数优化
欧阳梦云,王 燕,林亲录
(1.湖南农业大学食品科技学院,湖南长沙 410128; 2.长沙凯雪粮油食品有限公司,湖南长沙 410008)
超声辅助双酶法制备RS3型籼米抗性淀粉工艺参数优化
欧阳梦云1,王 燕1,林亲录2
(1.湖南农业大学食品科技学院,湖南长沙 410128; 2.长沙凯雪粮油食品有限公司,湖南长沙 410008)
以微波预糊化籼米淀粉为原料,采用超声波间歇式辅助,异淀粉酶和普鲁兰酶分步脱支酶解制备了RS3型籼米抗性淀粉。以RS3产率为考察指标,在单因素实验的基础上,利用响应面法对制备RS3型籼米抗性淀粉的工艺参数进行了优化。结果表明,在淀粉乳质量分数10%、异淀粉酶酶解温度50 ℃、异淀粉酶酶解pH5.0、普鲁兰酶酶解温度60 ℃、普鲁兰酶酶解pH4.5、超声功率70 W条件下,最佳工艺条件为:异淀粉酶添加量16 U/g,异淀粉酶酶解时间3 h,普鲁兰酶添加量8 U/g,普鲁兰酶酶解时间2.2 h,超声时间7 min,超声间歇时间2.3 h。在最佳条件下,RS3型籼米抗性淀粉产率可达18.19%。
超声辅助,异淀粉酶,普鲁兰酶,RS3
抗性淀粉(RS)在健康人体小肠中不被消化,以其类似膳食纤维的生理功能可改善肠道代谢,降低大肠癌、肥胖的发病风险,又以其具有类似胰岛素的生理功能可一定程度地调节血糖,制成功能性食品可供糖尿病病人食用[1-2]。最受食品科学家及营养学家关注的是RS3(回生或重结晶淀粉),这类淀粉即使经加热处理,也难以被淀粉酶类消化。籼米因其粗糙的口感、易碎、较差的加工品质和易陈化等劣势,商品价值极低。大量研究表明,籼米淀粉组分中的直链淀粉含量远高于粳米和糯米,是极好的生产抗性淀粉的原料,而自然条件下籼米淀粉中仅含抗性淀粉1.0%~2.1%[3]。目前制备RS3型抗性淀粉的原料以马铃薯和玉米为主[4-5],近几年创新的制备方法有超声法、酸解-微波法、压热-酶法、挤压法等[6-10]。本文以微波预糊化籼米淀粉为原料,超声间歇辅助异淀粉酶和普鲁兰酶分步脱支制备RS3型籼米抗性淀粉的研究还未见报道。微波处理使淀粉颗粒膨化,以异淀粉酶和普鲁兰酶专一性切割支链淀粉的α-1,6糖苷键,使易于聚集重结晶的直链淀粉增多,从而提高RS3产率。此方法避免了目前研究中使用液化酶导致直链淀粉损失且产生大量糊精影响RS3生成等负面影响,可为RS3型籼米抗性淀粉的制备新工艺提供参考。
1 材料与方法
1.1 材料与仪器
籼米碎米 湖南邵阳,将籼米粉碎过40目筛,参考文献[12]制备籼米淀粉;异淀粉酶(50000 U/g) 天津拓程生物科技有限公司;普鲁兰酶(1000ASPU/mL) 江苏锐阳生物科技有限公司;葡萄糖淀粉酶(≥100 Units/mg) 上海瑞永生物科技有限公司;耐高温a-淀粉酶(≥4000 U/g) 上海瑞永生物科技有限公司;胃蛋白酶(≥1200 U/g),其他试剂(化学纯) 国药集团化学试剂有限公司。
B-260恒温水浴锅 上海亚荣生化仪器厂;EG23B-DC(F)美的微波炉 广东美的微波炉制造有限公司;KQ-100DE型数控超声波清洗器 昆山市超声仪器有限公司;DHG-9240A电热恒温鼓风干燥箱 上海飞越实验仪器有限公司;UV-2450紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 籼米淀粉微波预糊化 根据前期实验,结合文献[12],微波预糊化实验方案为:40目的籼米淀粉调节水分含量至30%后,经微波炉50%火力微波处理2 min。
1.2.2 RS3型籼米抗性淀粉的制备 称取适量微波预糊化后的籼米淀粉,用pH为5.0的磷酸盐缓冲溶液配制质量分数为30%的淀粉乳,水浴加热至50 ℃,加入异淀粉酶20 U/g,在70 W超声功率下,每间隔0.5 h超声8 min,异淀粉酶酶解2 h后,85 ℃恒温水浴条件下灭酶10 min,冷却至室温,用0.1 mol/L HCl调pH至4.5,水浴加热至60 ℃,恒温,加入普鲁兰酶20 U/g,在70 W超声功率下,每间隔0.5 h超声8 min,普鲁兰酶酶解2 h后,85 ℃恒温水浴条件下灭酶10 min,冷却至室温,将酶解后淀粉乳迅速置于4 ℃冰箱回生24 h。
1.2.3 RS3型抗性淀粉含量的测定 RS3型抗性淀粉的测定参考Goni法[11]。葡萄糖标准曲线的绘制参考3,5-二硝基水杨酸比色法[12]。葡萄糖标准曲线为:
y=1.0104x+0.00861,R2=0.99702
1.2.4 超声辅助双酶法制备RS3型籼米抗性淀粉的工艺参数优化
1.2.4.1 单因素实验 分别考察各单因素淀粉乳质量分数(10%、20%、30%、40%、50%)、超声时间(2、5、8、10、12 min)、超声功率(50、60、70、80、90 W)、超声间歇时间(0.5、1.0、1.5、2.0、2.5 h)、异淀粉酶添加量(0、10、20、30、40 U/g)、异淀粉酶酶解时间(1、2、3、4、5 h)、普鲁兰酶添加量(0、10、20、30、40 U/g)、普鲁兰酶酶解时间(1、2、3、4、5 h)对RS3型籼米抗性淀粉产率的影响。单因素实验时,其余条件固定为:淀粉乳质量分数30%,超声时间8 min,超声间歇时间0.5 h,异淀粉酶添加量20 U/g,异淀粉酶酶解时间2 h,普鲁兰酶添加量20 U/g,普鲁兰酶酶解时间2 h。
1.2.4.2 响应面实验设计 根据单因素实验结果,结合响应面实验设计原理,选择异淀粉酶添加量、异淀粉酶酶解时间、超声时间、普鲁兰酶添加量、普鲁兰酶酶解时间、超声间歇时间6个因素为关键工艺参数对制备工艺进行优化,为减少实验次数而不影响分析精度,以RS3产率为响应值,建立二次响应面回归模型,固定普鲁兰酶添加量为6 U/g,普鲁兰酶酶解时间为2.0 h,超声间歇时间为2.0 h,进行第一次响应面实验优化RS3型籼米抗性淀粉制备工艺,因素水平表如表1。固定异淀粉酶添加量为16 U/g,异淀粉酶酶解时间为3.0 h,超声时间为5 min,进行第二次响应面实验优化RS3型籼米抗性淀粉制备工艺,因素水平表如表2。
表1 第一次响应面实验因素与水平
Table 1 Factors and levels of first response surface test
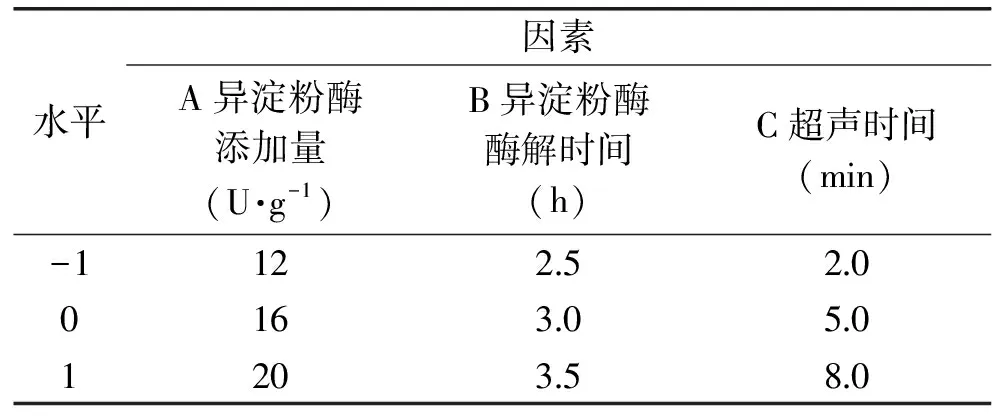
水平因素A异淀粉酶添加量(U·g-1)B异淀粉酶酶解时间(h)C超声时间(min)-112252001630501203580
表2 第二次响应面实验因素与水平
Table 2 Factors and levels ofsecond response surface test
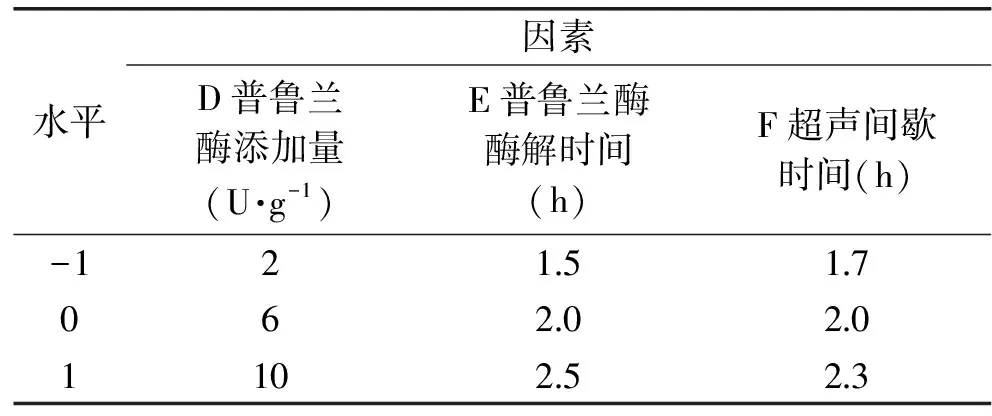
水平因素D普鲁兰酶添加量(U·g-1)E普鲁兰酶酶解时间(h)F超声间歇时间(h)-1215170620201102523
1.2.5 数据处理 所有实验均重复3次,各项指标数据均采用Origin7.5软件处理作图,Design-Expert8.0.6软件进行方差分析和响应面分析。p<0.01表示具有极显著差异,p<0.05表示有显著差异。
2 结果与分析
2.1 单因素实验
2.1.1 不同超声功率对籼米RS3产率的影响 由图1可知,当超声功率低于70 W时,RS3产率随着功率的增大而显著增加。这是因为在超声主动力空化机制的作用下,异淀粉酶和普鲁兰酶的酶分子构象改变,酶活性提高,振荡过程中酶与支链淀粉充分接触,脱支效果显著。经糊化后的淀粉乳冷藏老化过程中直链淀粉大量聚集形成重结晶,形成抗性淀粉。当超声功率高于70 W时,RS3产率随着功率的增大而大幅度降低。其原因可能是超声引起的高强度机械振荡作用使部分淀粉颗粒破裂,直、支链淀粉都发生了一定程度地降解,大强度的空化效应作用于直链淀粉分子内C-C键,导致直链淀粉链长过短,不利于RS3的形成。因此,适宜的超声功率为70 W。
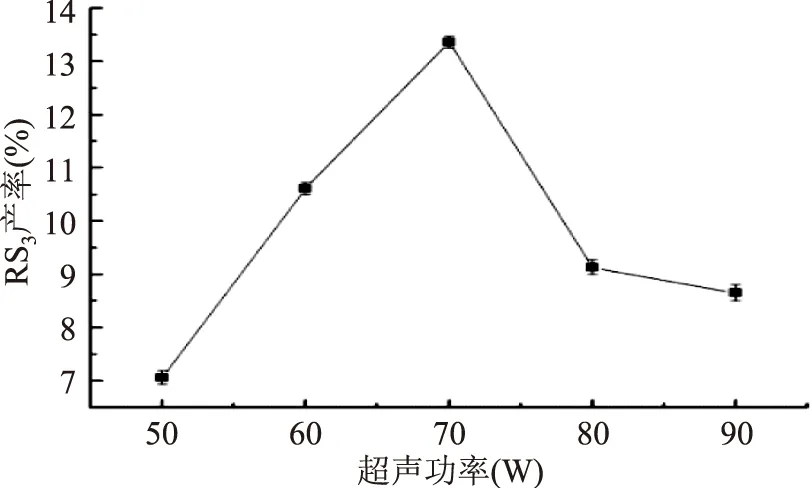
图1 超声功率对RS3型籼米抗性淀粉产率的影响Fig.1 Effect of ultrasonic power on yield of indica rice resistant starch of type RS3
2.1.2 不同超声时间对RS3型籼米抗性淀粉产率的影响 由图2可知,当超声时间短于5.0 min时,RS3产率随着超声时间的增长而增加,在5.0 min时出现峰值,维持更长时间的超声作用后,RS3产率略有降低随后迅速下降,分析原因,可能是超声波在淀粉乳体系中传播时,空化效应和机械振动产生的能量不断被淀粉分子吸收而使体系温度升高,高温下,酶活性受影响,部分酶失活。淀粉分子于高温下也会发生降解,生成的小分子糊精和糖类也阻碍了RS3形成。因此,适宜的超声时间为5.0 min。
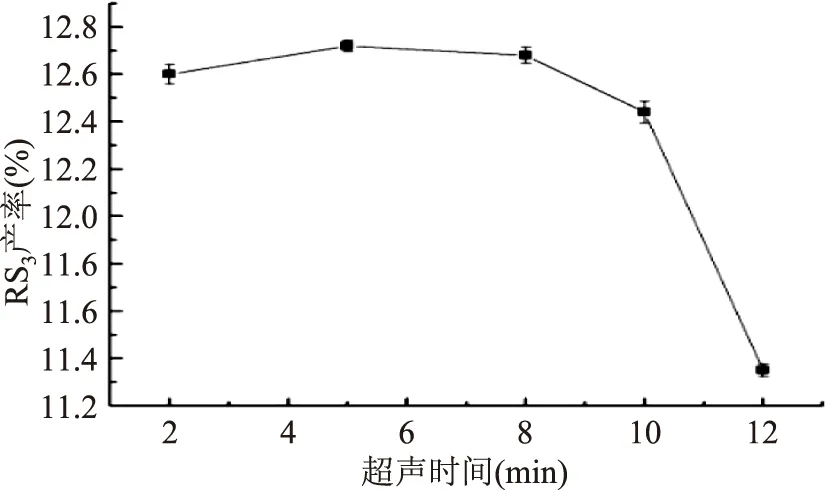
图2 超声时间对RS3型籼米抗性淀粉产率的影响Fig.2 Effect of ultrasonic treatment time on yield of indica rice resistant starch of type RS3
2.1.3 不同超声间歇时间对RS3型籼米抗性淀粉产率的影响 由图3可知,当超声间歇时间为2.0 h时,RS3产率达最大值12.98%;当超声间歇时间小于2.0 h时,RS3产率随超声间歇时间的延长而增加。酶作为催化剂在与底物专一性结合后发挥酶解作用生成产物需要一定的时间,超声间歇时间长,酶解体系有了充足的反应时间,所以RS3产率提高。因此,适宜的超声间歇时间为2.0 h。
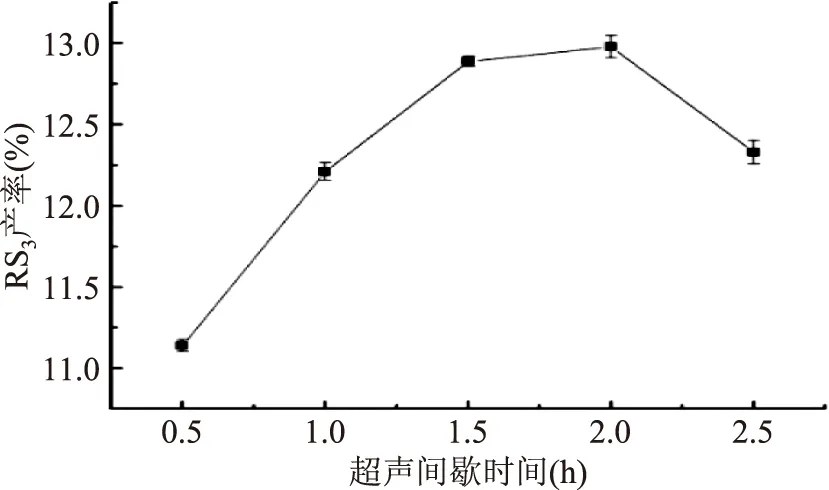
图3 超声间歇时间对RS3型籼米抗性淀粉产率的影响Fig.3 Effect of ultrasonic intermittent time onyield of indica rice resistant starch of type RS3
2.1.4 不同淀粉乳质量分数对RS3型籼米抗性淀粉产率的影响 由图4可知,RS3产率随着淀粉乳质量分数的增大而降低。可能是因为淀粉乳质量分数过高而使体系黏度增大,即使超声波的作用会使体系发生高频振荡,但超声结束后,体系黏度仍然大,淀粉分子间结合紧密,游离在淀粉分子附近的水分子难以进驻淀粉分子的结晶区,导致淀粉糊化不完全。体系黏度大也阻碍了直链淀粉分子间运动,降低了分子间碰撞几率,导致生成的抗性淀粉结构疏松,淀粉酶仍能通过分子间间隙作用于淀粉分子进行酶解,致使RS3产率呈下降趋势[15]。因此,适宜的淀粉乳质量分数为10%。
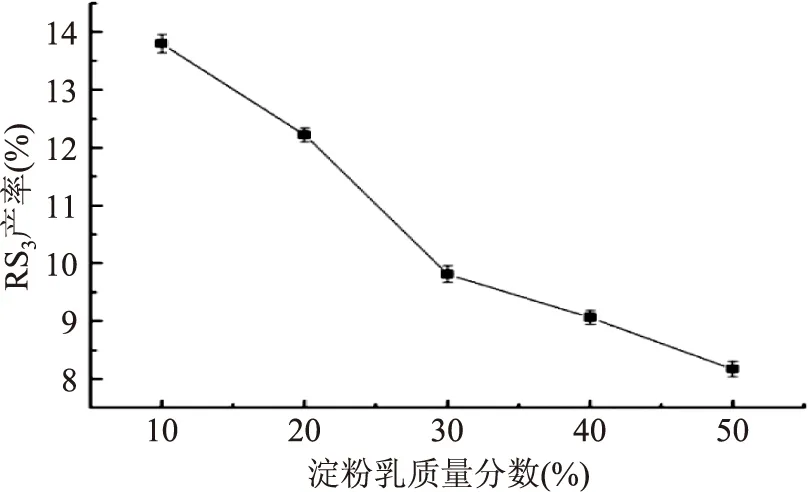
图4 淀粉乳质量分数对RS3型籼米抗性淀粉产率的影响Fig.4 Effect of starch mass fraction on yield of indica rice resistant starch of type RS3
2.1.5 不同异淀粉酶添加量对RS3型籼米抗性淀粉产率的影响 由图5可知,当异淀粉酶添加量小于20 U/g时,RS3产率增加迅速;当异淀粉酶添加量为20 U/g时,RS3产率达最大值11.54%;当异淀粉酶添加量大于20 U/g时,随着酶添加量的继续增大,RS3产率反而降低。可能是因为继续添加异淀粉酶导致支链淀粉过度脱支,老化回生时直链淀粉聚集结构不紧密,得到的部分抗性淀粉仍能被糖化酶酶解,从而导致RS3产率下降。因此,适宜的异淀粉酶添加量为20 U/g。

图5 异淀粉酶添加量对RS3型籼米抗性淀粉产率的影响Fig.5 Effect of isoamylase amount onyield of indica rice resistant starch of type RS3
2.1.6 不同异淀粉酶酶解时间对RS3型籼米抗性淀粉产率的影响 由图6可知,当酶解时间小于3.0 h时,体系中的RS3增加幅度大,在3.0 h时达到最大值11.43%;当酶解时间超过3.0 h后,RS3产率随酶解时间的增加而降低。分析原因可能是支链淀粉被过度脱支,生成的直链淀粉链长过短,老化回生时直链淀粉分子间运动过快,没有充足的接触时间发生聚集[16],所以RS3产率降低。因此,适宜的异淀粉酶酶解时间为3.0 h。
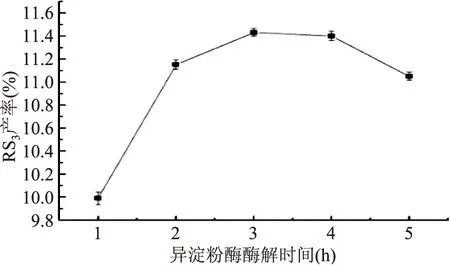
图6 异淀粉酶酶解时间对RS3型籼米抗性淀粉产率的影响Fig.6 Effect of isoamylase hydrolysis time onyield of indica rice resistant starch of type RS3
2.1.7 不同普鲁兰酶添加量对RS3型籼米抗性淀粉产率的影响 淀粉乳经异淀粉酶酶解后继续使用普鲁兰酶进行脱支处理。由图7可知,当普鲁兰酶添加量为10 U/g时,RS3产率达最大值13.79%,随后下降迅速。分析原因可能是此时生成的直链淀粉聚合度(DP)太小或直链淀粉分子链长不合要求,分子链过长导致分子间产生较大的斥力,直链淀粉发生重结晶困难,分子链过短导致分子间运动频率加快,但碰撞聚集在一起达到稳定的概率很小,所以RS3产率降低。因此,适宜的普鲁兰酶添加量为10 U/g。

图7 普鲁兰酶添加量对RS3型籼米抗性淀粉产率的影响Fig.7 Effect of pullulanase amount on yield of indica rice resistant starch of type RS3
2.1.8 不同普鲁兰酶酶解时间对RS3型籼米抗性淀粉产率的影响 由图8可知,当普鲁兰酶酶解时间为2.0 h时,RS3产率达最大值12.41%,随着酶解时间继续延长,RS3产率却降低。普鲁兰酶的脱支作用在一定时间内可以迅速增加体系中直链淀粉含量,从而提高RS3产率,继续延长脱支反应时间,支链淀粉被过度降解,形成的直链淀粉链长过短,导致RS3产率降低。因此,适宜的普鲁兰酶酶解时间为2.0 h。

图8 普鲁兰酶酶解时间对RS3型籼米抗性淀粉产率的影响Fig.8 Effect of pullulanase hydrolysis timeon yield of indica rice resistant starch of type RS3
2.2 二次响应面优化RS3型籼米抗性淀粉制备工艺参数
2.2.1 第一次响应面优化RS3型籼米抗性淀粉制备工艺参数 第一次响应面实验设计与结果见表3。
表3 第一次响应面实验设计与结果
Table 3 Experimental design and results for first response surface test
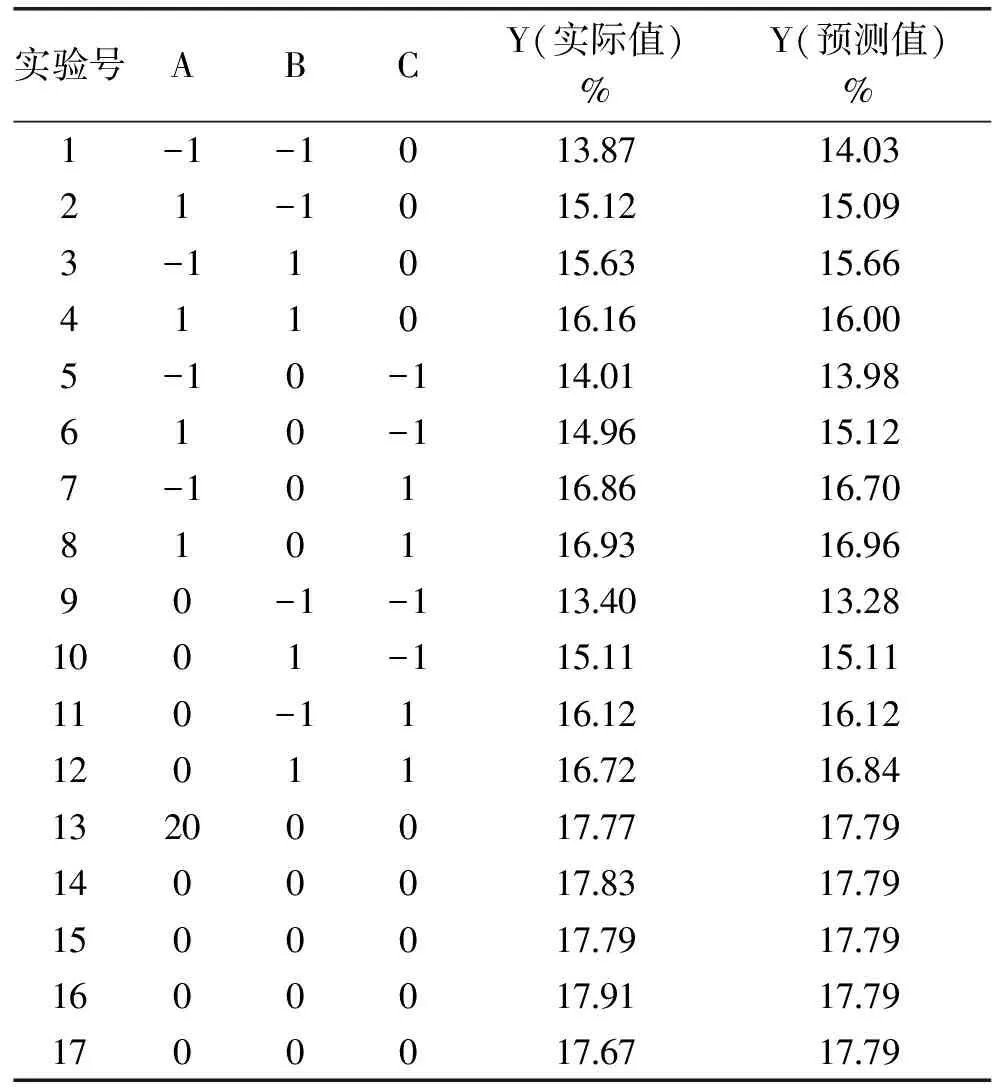
实验号ABCY(实际值)%Y(预测值)%1-1-101387140321-10151215093-110156315664110161616005-10-114011398610-1149615127-1011686167081011693169690-1-1134013281001-115111511110-11161216121201116721684132000177717791400017831779150001779177916000179117791700017671779
对表3实验数据进行二次多元回归拟合,获得A、B、C对RS3产率(Y)的二次回归模型方程为:
Y=17.79+0.35A+0.64B+1.14C-0.18AB-0.22AC-0.28BC-1.12A2-1.48B2-0.98C2
表4 第一次响应面实验方差分析
Table 4 Analysis of variance for the first response surface test

来源平方和自由度均方F值p值显著性A0981098421000003∗∗B326132614022<00001∗∗C10471104744958<00001∗∗AB013101355700504AC019101983200235∗BC0311031132300083∗∗A2531153122822<00001∗∗B2917191739393<00001∗∗C2405140517398<00001∗∗模型35969417165<00001∗∗残差01670023失拟项0133004457400623净误差00314768×10-3总和361216


图9 超声时间(C)与异淀粉酶添加量(A)交互作用对RS3型籼米抗性淀粉产率影响的响应面Fig.9 Response surface plot of effect of interation between ultrasonic treatment time(C)and isoamylaseamount(A) on yield of indica rice resistant starch of type RS3
如图9、图10可知,响应面和下方等高线都可反映RS3产率在超声时间方向的曲线较异淀粉酶添加量和异淀粉酶酶解时间方向的更为陡峭合密集,与表4方差分析表一致。RS3产率随着超声时间的延长,呈先增加后降低的趋势。这可能是因为,在较短的时间内维持超声处理,超声引起的高频振荡促使淀粉分子与酶的接触,适当的超声处理还提高了酶的活性,超声时间继续延长,产生的空化效应和热效应增强,淀粉分子发生一定程度地降解,酶的活性也受到影响。
2.2.2 第二次响应面优化RS3型籼米抗性淀粉制备工艺参数 第二次响应面实验设计与结果见表5。
表5 第二次响应面实验设计与结果
Table 5 Experimental design and results of second response surface test
对表5实验数据进行二次多元回归拟合,获得D、E、F对RS3产率(Y)的二次回归模型方程为:
表6 第二次响应面实验方差分析
Table 6 Analysis of variance for second response surface test

来源平方和自由度均方F值p值显著性D1741174494700002∗∗E953195327100<00001∗∗F772177221968<00001∗∗DE022102261500422∗DF0921092262200014∗∗EF00961009627301422D2595159516926<00001∗∗E2683168319433<00001∗∗F20661066188100034∗∗模型3492938811036<00001∗∗残差02570035失拟项0193006342800968净误差005840015总和351616
Y=17.32+0.47D+1.09E+0.98F+0.23DE+0.48DF-0.1EF-1.19D2-1.27E2-0.40F2
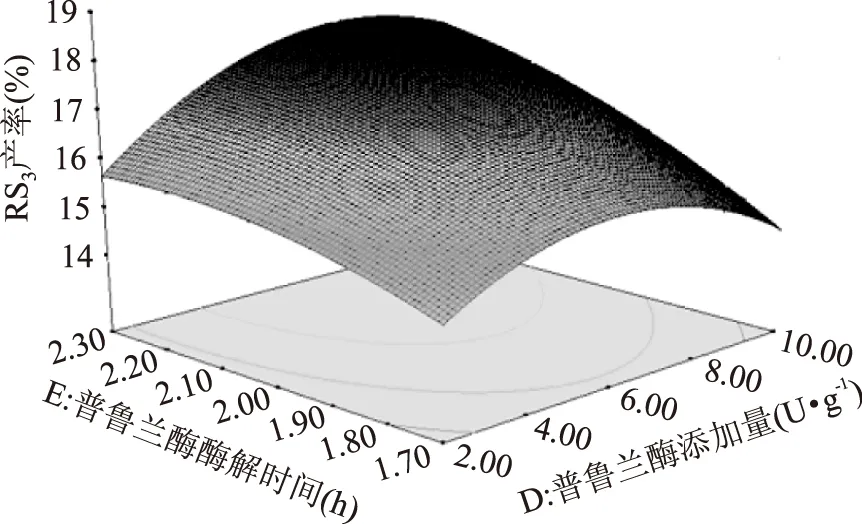
图11 超声间歇时间(F)与普鲁兰酶添加量(D)交互作用对RS3型籼米抗性淀粉产率影响的响应面Fig.11 Response surface plot ofeffect of interation between ultrasonic intermittent time(F)and pullulanase amount(D) on yield of indica rice resistant starch of type RS3
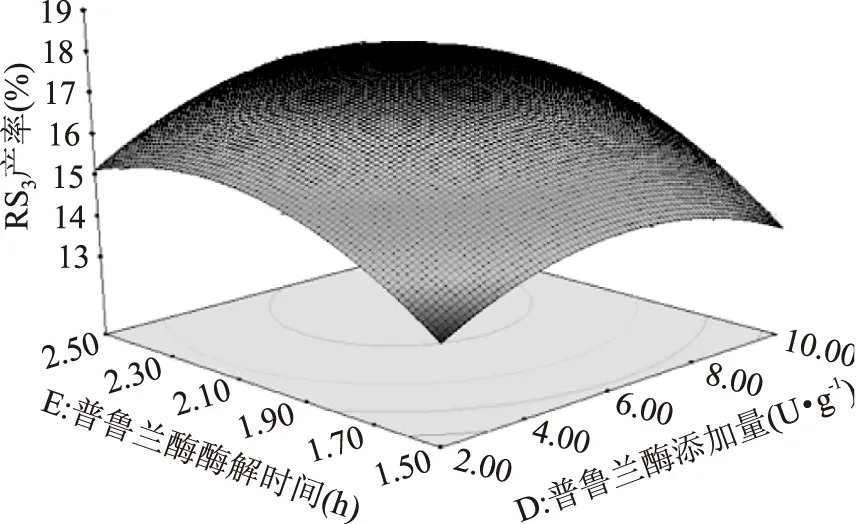
图12 普鲁兰酶添加量(D)与普鲁兰酶酶解时间(E)交互作用对RS3型籼米抗性淀粉产率影响的响应面Fig.12 Response surface plot of effect of interation between the pullulanase amount(D)and pullulanase hydrolysis time(E) on yield of indica rice resistant starch of type RS3
如图11,图12可知,响应面曲线和下方等高线都可反应RS3得率在普鲁兰酶酶解时间方向的曲线较普鲁兰酶添加量和超声间歇时间方向的更为陡峭和密集,说明普鲁兰酶酶解时间对RS3产率的影响更显著,与表6方差分析表一致。RS3产率随着普鲁兰酶酶解时间的增长,呈先增加后降低的趋势,这可能是因为随着酶解反应的进行,支链淀粉过度脱支,生成的直链淀粉链长过短,影响了RS3产率。
2.2.3 回归模型的验证 对二次响应面回归模型进行分析后,得到最大RS3产率对应的各因素水平为:异淀粉酶添加量16.36 U/g,异淀粉酶酶解时间3.08 h,普鲁兰酶添加量7.75 U/g,普鲁兰酶酶解时间2.20 h,超声时间6.65 min,超声间歇时间2.3 h,预测值最高可达18.30%。考虑到实际操作的可行性,将各因素水平分别调整为:异淀粉酶添加量为16 U/g,异淀粉酶酶解时间为3 h,普鲁兰酶添加量为8 U/g,普鲁兰酶酶解时间为2.20 h,超声时间为7.0 min,超声间歇时间为2.3 h。
为了检测模型的可靠性,将优化后各因素水平按1.2.2所述的条件进行3次从重复性实验,RS3产率的实测值为18.19%,与预测值接近,表明建立的模型对RS3得率具有良好的预测性。
3 结论
采用二次响应面法对超声波间歇式辅助双酶法制备RS3型籼米抗性淀粉工艺参数进行了优化,建立了RS3产率回归模型。第一次响应面实验各因素对RS3型籼米抗性淀粉产率影响的主次顺序为超声时间(C)>异淀粉酶酶解时间(B)>异淀粉酶添加量(A);第二次响应面实验各因素对RS3型籼米抗性淀粉产率影响的主次顺序为普鲁兰酶酶解时间(E)>超声间歇时间(F)>普鲁兰酶添加量(D)。超声波间歇式辅助双酶法制备RS3型籼米抗性淀粉的最佳工艺参数为:异淀粉酶添加量16 U/g,异淀粉酶酶解时间3.0 h,普鲁兰酶添加量8 U/g,普鲁兰酶酶解时间2.20 h,超声时间7.0 min,超声间歇时间2.3 h。在最佳条件下RS3产率可达18.19%。通过响应面分析所建立的二次回归模型在实验范围内表现出良好的预测性,可为RS3型籼米抗性淀粉的制备、提升籼米碎米附加值及其应用领域提供参考。
[1]Johnston K L,Thomas E L,Bell J D,et al. Resistant starch improves insulin sensitivity in metabolic syndrome[J]. Diabetic Medicine A Journal of the British Diabetic Association,2010,27(4):391-397.
[2]Kwak J H,Paik J K,Kim H I,et al. Dietary treatment with rice containing resistant starch improves markers of endothelial function with reduction of postprandial blood glucose and oxidative stress in patients with prediabetes or newly diagnosed type 2 diabetes[J]. Atherosclerosis,2012,224(2):457-464.
[3]Hu P,Zhao H,Duan Z,et al. Starch digestibility and the estimated glycemic score of different types of rice differing in amylose contents[J]. Journal of Cereal Science,2004,40(3):231-237.
[4]张焕新,于博,金征宇. 响应面法优化玉米抗性淀粉制备工艺[J]. 食品科学,2011,32(22):11-15.
[5]李周勇,韩育梅,夏德冬. 马铃薯抗性淀粉的微波预处理条件及性质研究[J]. 食品研究与开发,2014,35(2):1-6.
[6]Zhang H,Jin Z. Preparation of products rich in resistant starch from maize starch by an enzymatic method[J]. Carbohydrate Polymers,2011,86(4):1610-1614.
[7]Niu L L,Zhang S G,Guo Y Q,et al. Effect of microwave heat-moisture treatment on resistant starch content and properties of potato starches[J]. Science & Technology of Food Industry,2013,34(14):156-155.
[8]Zhang Z,Xia D D,Wang L. Optimization of parameters for preparation of maize retrograded starch by acid-microwave method[J]. Science & Technology of Food Industry,2014,35(12):282-286.
[9]吴亨,尹秀华,谢丽燕,等. 酶法联合压热-冷却循环处理制备抗性淀粉[J]. 现代食品科技,2014(5):245-250.
[10]张钟,夏丹丹,王丽. 酸解-微波法制备RS3型玉米抗性淀粉工艺参数优化[J]. 食品工业科技,2014,35(12):282-286.
[11]杨建雄.生物化学与分子生物学实验技术教程[M].北京:科学出版社,2009.
[12]张晓,任清.压热酶脱支重结晶法制备甜荞抗性淀粉的工艺优化及颗粒形貌[J].食品科学,2013,34(8):64-69.
[13]GoniI,Garcia-diz L,Manas E. Analysis of resistant starch:a method for foods and food product[J].Food Chemistry,1996,56(4):445-449.
[14]李周勇,韩育梅,夏德冬.马铃薯抗性淀粉的微波预处理条件及性质研究[J].食品研究与开发,2014,35(2):1-6.
[15]Mun S H,Shin M. Mild hydrolysis of resistant starch from maize[J]. Food Chemistry,2006,96(1):115-121.
[16]Englyst H N,Cummings J H. Digestion of the polysaccharides of some cereal foods in the human small intestine[J]. American Journal of Clinical Nutrition,1985,42(5):778-87.
Optimization for parameters of indica rice resistant starch of type RS3prepared by ultrasonicauxiliary and dualenzyme method
OUYANG Meng-yun1,WANG Yan1,LIN Qin-lu2
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,China; 2.Changsha KaiXue grain and oil food co.,LTD,Changsha 410008,China)
The indicaresistant starch of type RS3was prepared using indica starchpregelatinized by microwave as a material by means of the ultrasonic intermittent auxiliary and step debranchingenzymatic hydrolysis of isoamylase and pullulanase. Based on the single factor experiments,the yield of indica rice resistant starch of type RS3was the response value,a response surface methodology was used to optimize the parameters of indica rice resistant starch of type RS3. The results showed that under the conditions:starch mass fraction,10%;isoamylasehydrolysis temperature,50 ℃;isamylase hydrolysis pH,5.0;pullulanase hydrolysis temperature,60 ℃;pullulanase hydrolysis pH,4.5;ultrasonic power,70 W,the optimal parameters were obtained as follows:isoamylase amount,16 U/g;isoamylasehydrolysis time,3 h;pullulanase amount,8 U/g;pullulanasehydrolysis time,2.2 h;ultrasonic treatment time,7 min;ultrasonic intermittent time,2.7 h. Under these conditions,the yield of indica rice resistant starch of type RS3was 18.19%.
ultrasonicauxiliary;isoamylase;pullulanase;indica RS3
2016-06-03
欧阳梦云(1992-),女,在读硕士研究生,研究方向:食品化学与营养,E-mail:296471174@qq.com。
*通讯作者:王燕(1968-),女,博士,教授,研究方向:食品化学与营养,食品添加剂,E-mail:693675748@qq.com。
“长沙市主食产业化工程技术研究中心”资助项目。
TS236.9
B
1002-0306(2016)23-0176-07
10.13386/j.issn1002-0306.2016.23.025

