高分辨率显微内镜成像系统的构建与初步应用
屈亚威,谈 涛,张 宇,舒 娟,刘敏黎,张 玲,刘海峰
武警总医院消化科,北京市,100039
高分辨率显微内镜成像系统的构建与初步应用
【作 者】屈亚威,谈 涛,张 宇,舒 娟,刘敏黎,张 玲,刘海峰
武警总医院消化科,北京市,100039
高分辨率显微内镜(HRME)是基于高分辨率光纤和分子成像技术研发的一种新的成像方法,能够对组织进行实时成像。该文通过对HRME系统中激发光传导部、荧光图像传像部、光纤快速交换部和图像采集部等组成元件和光路的设计与优化,构建了一套HRME成像系统。利用HRME系统对动物胃肠道黏膜进行成像观察,结果表明HRME实现组织虚拟病理学成像具备可行性,为进一步临床研究奠定了基础。HRME作为一种即时组织病理学成像方法,有望成为组织即时诊断的一种新模式。
高分辨率显微内镜;系统构建;成像;可行性
0 引言
随着内镜技术的快速发展,显微内窥技术在临床上具有广阔的应用前景,如共聚焦激光显微内镜(confocal Laser endomicroscopy, cLe)[1]。cLe是通过放大的方式对黏膜层的细胞结构实时观察,实现内镜下的虚拟组织病理成像,展现了良好的应用前景[1-2]。但由于cLe是通过对多个点进行二维扫描的方式而获得图像,这种逐点扫描的成像方法需要较长的扫描曝光时间,因此降低了帧频率并且会出现伪影[1-3]。针对上述问题,新的荧光内窥式显微成像模式为我们提供了新的思路。高分辨率显微内镜(High Resolution Microendoscopy,HRMe)是一种新的荧光内窥式显微成像模式,有望在实现即时显微成像的同时获得高质量的成像效果[4-6]。课题组自主研发了一套HRMe成像系统,本文就HRMe成像原理、HRMe组成元件、光路设计及初步应用等方面做简要介绍。
1 HRMe系统成像原理和荧光造影剂
1.1 成像原理
HRMe通过LeD光源发出的激发光经滤光片过滤,形成455 nm的窄谱段激发光,激发光经高分辨率光纤传导至喷洒染色剂的生物组织产生515 nm的荧光。荧光信号再通过高分辨率光纤返回,由物镜放大后,通过二向色镜将激发光和荧光分开,只将荧光信号传导至ccD芯片上进行成像,从而得到被检测组织的细胞学图像,见图1。
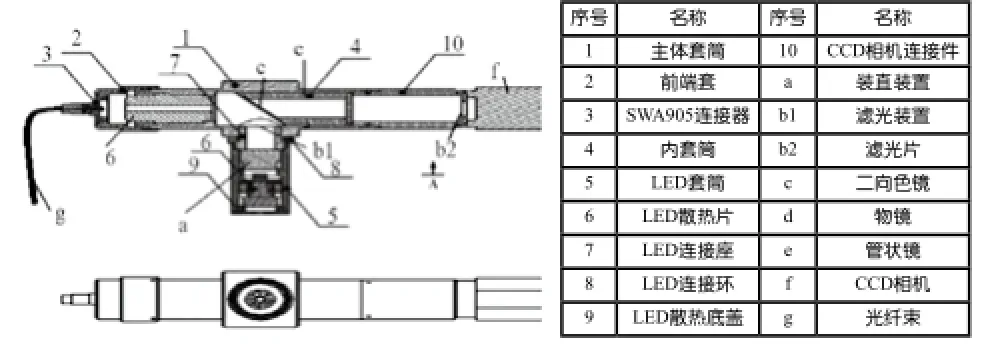
图1 HRMe系统结构原理图Fig.1 Structure diagram of HRMe system
1.2 荧光造影剂
HRMe系统常用的荧光造影剂是原黄素和盐酸吖啶黄,其对组织有较高的亲和力。原黄素已被FDa批准为实验试剂,在欧洲、亚洲和澳大利亚等广泛应用,无严重不良反应,安全性较高。原黄素激发光和发射光波长分别是为445 nm和515 nm,可与细胞核内的DNa、RNa结合后染色,局部喷洒原黄素后几秒内即可被吸收,使黏膜上皮细胞核显影,显像的细胞核表现为发亮的区域,不显色的部分为发暗的区域。
2 HRMe系统组成
系统的主要组成元件包括一个440~480 nm的LeD光源、一根长1.8 m(内含30 000根单丝)的高分辨率光纤、一根长1.8 m(内含10 000根单丝)的高分辨率光纤、10×显微镜镜头、20×显微镜镜头、500 nm二向色镜、滤光片以及一个科学级ccD相机,见图2和图3。

图2 HRMe系统三维模型图Fig.2 Three dimensional model diagram HRMe system

图3 HRMe系统实物图Fig.3 Physical picture of HRMe system
3 HRMe系统光路设计
光路设计是HRMe系统的核心部分,其主要包含激发光传导部、荧光图像传像部、光纤快速交换部和图像采集部。
3.1 激发光传导部
激发光源为波长440~480 nm的LeD光源,其发出的全波段激发光经过准直装置a和滤光装置b1过滤后,发射出波长455 nm的平行激发光。激发光入射到透光率为500 nm的二向色镜的镜面c上,通过折射将激发光经过光纤快速交换部d出射到高分辨率光纤中,形成满足原黄素产生激发荧光的窄谱段激发光。
3.2 荧光图像传像部
荧光造影剂经激发光照射后,产生荧光。荧光信号首先经高分辨率光纤束g传导进入主光路,高分辨率光纤束末端通过SMa905接口3与前端套筒2固定,同时通过旋转前端套筒2进行调焦。荧光信号通过显微镜镜头后透过500 nm的二向色镜c,再经过滤光片b2过滤掉背景光后投射到ccD相机靶面上。
3.3 光纤快速交换部
主要包含两种不同型号的高分辨率光纤束(FIGH-30-650S和FIGH-30-350S),10×显微镜镜头、20×显微镜镜头,两组前端套筒组成。当使用FIGH-30-650S型光纤束时,选取10×显微镜镜头及对应的前端套筒;如果需要更换为FIGH-30-350S型光纤束,只需要将10×显微镜镜头拆下安装上20×显微镜镜头及对应前端套筒即可。
3.4 图像采集部
图像采集主要由科学级ccD相机(f)和计算机软件完成。相机分辨率为2 456×2 048,成像帧率为17 帧/s,ccD靶面尺寸为2/3 inch (1inch=25.4 mm)。
4 HRMe系统的初步应用研究
4.1 研究方法
选择日本大耳白兔为研究对象。动物经麻醉、固定、切开、解剖胃肠道、暴露胃肠道组织和清洗等实验步骤后,制备胃肠道黏膜标本,备用。标本局部喷洒0.01%原黄素盐酸盐2~3 mL,大约30 s后将光纤头端以不同角度观察组织表面,进行成像。成像结束后,组织行病理检查。
4.2 结果
HRMe根据细胞核大小、密度、分布、腺体结构等指标,可以清晰地辨别不同部位的胃肠道黏膜。胃底黏膜:可见大量排列紧密的腺体,胃小凹开口呈类椭圆形或长形分枝状,周边裂隙呈线样,细胞核排列规则。胃窦黏膜:胃小凹开口呈不规则形或管状,腺腔呈裂隙状,小凹周围细胞排列规则,细胞核小且分布密集。小肠黏膜:可见绒毛呈宽大的指状,立体感明显,呈簇状排列,间隙呈裂隙状。大肠黏膜:可见排列规则的大量菊花样圆形隐窝,大小基本一致,隐窝间隙清晰可见,腺体排列规则。病理结果与HRMe结果相一致,见图4。
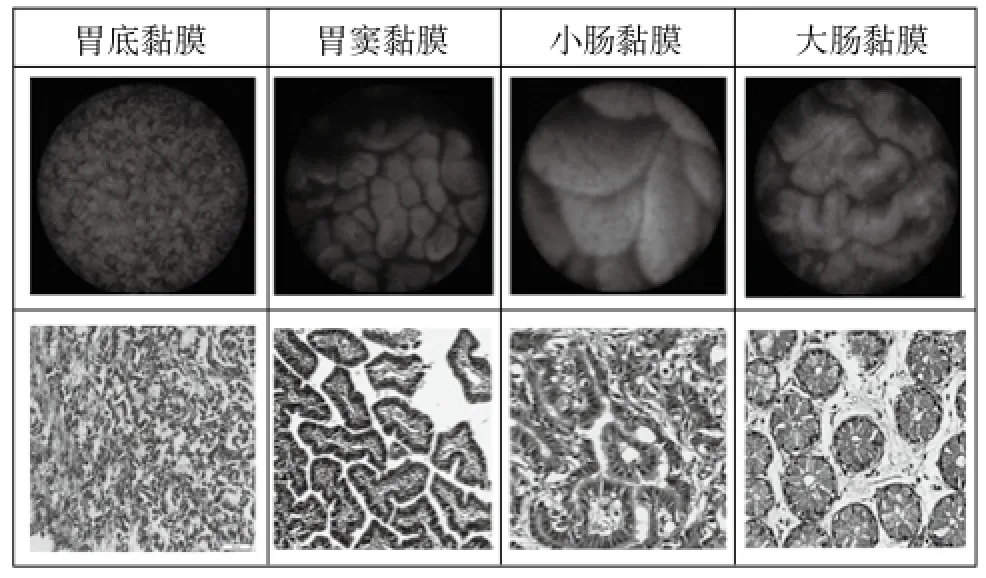
图4 动物胃肠道黏膜HRMe图片和病理图片的比较Fig.4 comparation of HRMe images and pathological images for animal gastrointestinal mucosa
5 讨论
根据光的折射和全反射原理,光在光导纤维中传导损耗低,通过传像光纤可以实现异地成像,因而光纤在医学内窥成像领域展现了良好的应用前景。随着技术的发展及光学分子成像需求的增长,基于光纤的光学成像设备得到了快速发展。现有光纤荧光成像设备光路主要为共通道方式,即通过同一根光纤传导激发光和荧光,透过二向色镜将激发光与荧光分开,从而只将荧光传导到ccD相机进行成像[7]。Sharon等[8]设计了用于检测小鼠体内结肠肿瘤的多光谱扫描纤维内镜。Pierce等[9]结合高分辨率光纤的性能和共通道荧光内镜的光路配置,开发了一种基于高分辨率光纤的共通道内窥显微成像模式,在此基础上组装了HRMe,对培养皿中细胞生长情况进行显微动态观察,取得了良好的效果。HRMe作为实时组织病理学成像方法,迅速成为显微内窥镜领域的热点[10-13]。
依据HMRe的成像原理及成像需求,多位学者研制了多种不同光路设计及硬件配置的HRMe设备。Zhong等[14]采用电子倍增耦合元件、30 000像元的高分辨率光纤、10×显微物镜组装了信号高敏感型HRMe。Shin等[15]采用30 000像元的高分辨率光纤、20×的物镜、150 mm管状透镜、商用数码相机组成便携式HRMe。Pillai等[16]在光纤的头端连接GRIN棱镜,使用光电倍增管(PMT)采集图像。Muldoon等[17]的设备采用了10×的物镜、倍率镜、30 000像元的高分辨率光纤、工业级ccD相机。我们的设备采用了20×显微镜头、二向色镜、长1.8 m的30 000像元(或10 000像元)、科学级ccD相机等元件,制成一套新的HRMe成像设备。该设备具有信号稳定、传输速度快和运动伪影少等特点,具有良好应用前景。
我们构建的HRMe成像设备优势在于:(1) 设计安装双光纤快速交换部,通过该部分可以在主光路不变的条件下快速切换30 000像元与10 000像元两种光纤束,从而保证不损坏光纤束;由于最后投影到ccD靶面上的图像大小相同,而30 000像元光纤束的截面积是10 000像元光纤束截面积的3.45倍,所以在同一主光路中使用10 000像元光纤束所得到的图像放大倍数为30 000像元光纤束的3.45倍,通过双光纤快速交换部实现了放大倍数的快速切换;(2)全套光路采用一体化设计,光路准直不需要经过三维组合平移台的调节;采用SMa905接口固定光纤束,使其连接更加牢固,操作更加简便;(3)激发光源部增加了准直装置,使单位面积激发光的能量分布更为平均,从而避免由于激发光强度不同导致产生假阳性信号;(4)采用科学级ccD相机进行图像采集,具有较高的灵敏度和信噪比,同时可以调节曝光时间和成像帧率。
为了验证HRMe系统的成像效果及对于实现组织虚拟病理学成像的可行性,利用HRMe系统对动物胃肠道黏膜进行了成像观察。动物胃肠道黏膜成像结果表明HRMe能够对不同部位胃肠道黏膜进行实时病理学成像,由于胃黏膜胃小凹形态与小肠、大肠黏膜腺体不相同,所以HRMe的图像特点各不相同,凭借HRMe图像可以区分胃肠道不同部位的黏膜。上述结果表明HRMe作为一种新型内镜技术可以实现组织的虚拟病理学成像,展现了HRMe实现“光学活检”的可行性,为进一步临床研究奠定基础[18-20]。
综上所述,HRMe作为一种新兴的成像工具,能够实现细胞水平成像,通过该成像技术可以对组织进行实时病理学成像[21-23]。利用自主研发的HRMe成像系统进行了临床前的研究,结果进一步验证了该成像系统对实现组织虚拟病理学成像的可行性,展现了良好的应用前景。光路设计的优化、硬件设备和成像软件的不断升级,探索与临床内窥镜结合的条件将是未来研究的重点。
[1] Kiesslich R, Burg J, Vieth M, et al. confocal laser endoscopy for diagnosing intraepithelial neoplasias and colorectal cancer in vivo[J]. Gastroenterology, 2004, 127(3): 706-713.
[2] Pohl H, Rosch T, Vieth M, et al. Miniprobe confocal laser microscopy for the detection of invisible neoplasia in patients with Barrett’s esophagus[J]. Gut, 2008, 57(12): 1648-1653.
[3] 范晓飞, 戈之铮, 薛寒冰, 等. 共聚焦激光显微内镜在内镜黏膜下剥离术后残留和复发病变诊断中的应用价值[J]. 胃肠病学, 2012, 17(8): 462-465.
[4] Louie JS, Richards-Kortum R, anandasabapathy S. applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia[J]. clin Gastroenterol Hepatol, 2014, 12: 1789-1792.
[5] Pierce Mc, Guan Y, Quinn MK, et al. a pilot study of low-cost, high-resolution microendoscopy as a tool for identifying women with cervical precancer[J]. am assoc cancer, 2012, 5: 1273-1279.
[6] chang SS, Shukla R, Polydorides aD, et al. High resolution microendoscopy for classification of colorectal polyps[J]. endoscopy, 2013, 45: 553-559.
[7] Flusberg Ba, cocker eD. Fiber-optic fuorescence imaging[J]. Nat Meth, 2005, 2(12): 941-950.
[8] Miller SJ, Lee cM, Joshi BP, et al. Targeted detection of murinecolonic dysplasia in vivo with fexible multispectral scanning fber endoscopy[J]. J Biomed optics, 2012, 17(2): 021103.
[9] Fujimoto JG. optical coherence tomography for ultrahigh resolution in vivo imaging[J]. Nat Biotechnol, 2003, 21(11): 1361-1367.
[10] Pierce M,Yu D, Richards-Kortum. High-resolution fber-optical microendoscopy for in situ imaging[J]. J Visual exp, 2011, 11(47): 1-4.
[11] Pierce Mc, Vila PM, Kingsley MJ. accuracy and interrater reliability for the diagnosis of Barrett’s neoplasia among users of a novel, portable high-resolution microendoscope[J]. Diseas esophagus, 2014, 27: 55-62.
[12] Quinn MK, Bubi Tc, Pierce Mc, et al. High-resolution microendoscopy for the detection of cervical neoplasia in lowresource settings[J]. PLoS one, 2012, 7(9): e44924.
[13] Levy LL, Jiang N, Smouha e, et al. optical imaging with a high resolution microendoscope to identify cholesteatoma of the middle ear[J]. Laryngoscope, 2013, 123(4): 1016-1020.
[14] Zhong W, celli JP, Rizvi I, et al. In vivo high-resolution fluorescence microendoscopy for ovarian cancer detection and treatment monitoring[J]. Brit J cancer, 2009, 101(12), 2015-2022.
[15] Shin D, Pierce Mc, Gillenwater aM, et al. a fiber-optic fuorescence microscope using a consumer-grade digital camera for in vivo cellular imaging[J]. PLoS one, 2010, 5(6): e11218.
[16] Pillai S, Lorenser D, Sampson D. Deep-tissue access with confocal fuorescence microendoscopy through hypodermic needles[J]. opt Soc am, 2011, 19(8): 7213-7221.
[17] Muldoon TJ, anandasabapathy S, Maru D, et al. High-resolution imaging in Barrett’s esophagus: a novel, low-cost endoscopic microscope[J]. Gastrointest endosc, 2008, 68(4): 737-744.
[18] Parikh ND, Perl D, Lee MH, et al. In vivo diagnostic accuracy of high-resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study[J]. am J Gastroenterol, 2014, 109(1): 68-75.
[19] Muldoon TJ, Roblyer D, Williams MD, et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope[J]. Head Neck, 2012, 34: 305-312.
[20] Vila PM, Park cW, Pierce Mc, et al. Discrimination of benign and neoplastic mucosa with a high-resolution microendoscope[J]. ann Surg oncol, 2012, 19: 3534-3539.
[21] 王雪珊, 徐为然, 张帆, 等. 新型高清显微内镜在食管早期肿瘤诊断中的价值初探[J]. 中华消化内镜杂志, 2012, 29: 24-28.
[22] Regunathan R, Woo J, Pierce Mc, et al. Feasibility and preliminary accuracy of high-resolution imaging of the liver and pancreas using FNa compatible microendoscopy (with video) [J]. Gastrointest endosc, 2012, 76(2): 293-300.
[23] Muldoon TJ, Roblyer D, Williamset MD, et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope[J]. Head Neck, 2012, 3: 305-312.
Construction and Preliminary Application of High Resolution Microendoscopy Imaging System
【 Writers 】QU Yawei, TAN Tao, ZHANG Yu, SHU Juan, LIU Minli, ZHANG Ling, LIU Haifeng
Gastroenterology of General Armed Police Hospital, Beijing, 100039
high resolution microendoscopy, system construction, imaging, feasibility
R318.6
A
10.3969/j.issn.1671-7104.2016.03.002
1671-7104(2016)03-0161-03
2015-12-17
首都临床特色应用研究(Z141107002514099)
屈亚威,e-mail: qyw198553@163.com
刘海峰,e-mail: haifengliu333@163.com
【 Abstract 】High Resolution Microendoscopy (HRME) is a new imaging method which based on high resolution fber and molecular imaging technology and it is possible to organize real-time imaging. After design and optimization of excitation light conduction part, fuorescent image transfer unit, optical fast switching unit and image capture unit, we constructe a HRME imaging system. We make an imaging observation of animal gastrointestinal tract by using HRME system and the results show that the feasibility of virtual pathology of HRME which lay the foundation for further clinical research. As an instant histopathological imaging method, HRME is expected to become a new immediate diagnosis model.

