基于微流控和机器视觉的红细胞变形性测量系统
侯建勋,申世铉
1 深圳市药品检验研究院(深圳市医疗器械检测中心),深圳市,518057
2 韩国高丽大学机械工学系,首尔市,136713,韩国
基于微流控和机器视觉的红细胞变形性测量系统
【作 者】侯建勋1*,申世铉2
1 深圳市药品检验研究院(深圳市医疗器械检测中心),深圳市,518057
2 韩国高丽大学机械工学系,首尔市,136713,韩国
红细胞变形性主要取决于其细胞膜和细胞质的组成成分,包括血红素及其他成份。现行大部分红细胞变形性测量装置在测试后均需清洗过程,浪费人力和时间。该文介绍了一种基于微流控和机器视觉的红细胞变形性测量系统,其采用一次性可抛型微流控测试通道和传统的激光衍射法。为了验证该系统的准确性和重复性,分别用该系统(RSD)和已成功商用的类似系统(LORCA)对同一健康血样进行红细胞变形性测试,两者测得的红细胞变形性评价指数(拉伸系数EI)呈现出很好的一致性。
红细胞;变形性;微流控;机器视觉
0 引言
红细胞的变形性是指红细胞在外力作用下改变自身形状的能力,其主要取决于红细胞的几何结构、细胞膜和内液组成等因素,是直接影响血液循环尤其是微循环的重要因素之一,是血液流变学中重要的研究对象。多项研究表明,红细胞变形性的降低与多种循环系统疾病存在着重要的联系,如动脉硬化[1]、血栓症[1]、糖尿病[2]、高血压[3]以及贫血[4]等。因此,测量和研究红细胞的变形性对于预防医学和临床医学具有重要的意义和价值。
迄今为止,红细胞变形性的测量方法主要有:粘性测量法、激光衍射法、微管吸吮法、电导法等,其中激光衍射法为目前采用较广泛、研究最多的方法[5-7],并已有成功商用机型,如LoRca(荷兰R&R公司)和RHeoDYN SSD(德国Myrenne公司)。本文所述红细胞变形性测量系统也是基于激光衍射法,其基本方法验证及更多实验研究可参见我们较早发表的论文[8],本文主要就利用Labview和NI vision改进的基于微流控和机器视觉的测量系统RSD及其方法予以说明。
1 方法
1.1 系统原理
本文所述红细胞变形性测量系统(以下简称RSD)的主要组成部件为:激光二极管(波长635 nm,功率1.5 mW)、ccD摄像头、衍射投影屏、压力传感器、负压装置以及微流控测量通道(以下简称微通道,由透明聚苯乙烯材料通过微注塑成型)等,如图1所示。测试液为静脉血红细胞由5.5%的PVP磷酸盐缓冲生理盐水溶液稀释至比积(Hct)0.5%所获得的红细胞悬浮液,该比积为现有方法试验条件下,最大限度降低血样量并保证准确度的最优试验值[5]。测试开始前,将500 μL的测试液置于微通道左侧的进液腔;测试开始时,与微通道右侧废液腔由电磁阀相连的负压装置将产生负压,电磁阀打开,由此产生的压差将使测试液流过微通道(长:40 mm,宽:4 mm,高:200 μm)。随着测试液不断流向废液腔,微通道两侧的压差逐渐减小直至测试液停滞流动,压力传感器将实时记录该压差,其间,激光二极管(635 nm,1.5 mW)产生的激光穿过微通道中剪切流动的红细胞,由此产生的衍射光斑投影到衍射投影屏并由ccD摄像头实时采集。

图1 RSD测量系统结构组成图Fig.1 The schematic of RSD system
如图2所示,微通道中测试液所承受剪切力呈指数减小。测试开始时,剪切力较高,微通道内红细胞拉伸程度较大,其衍射光斑呈扁长椭圆状;测试中,随着剪切力的减小,微通道内红细胞拉伸程度降低,衍射光斑逐渐趋于圆形;测试结束时,剪切力已近消失,微通道内红细胞基本无拉伸,衍射光斑近似圆形。本方法中用来作为评价红细胞变形性的变形指数eI(elongation Index)与LoRca(荷兰R&R公司)所采用参数基本一致,已为业界广泛接受,且可由下式定义:
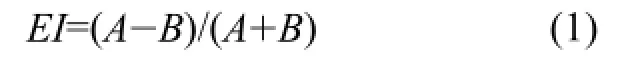
将衍射光斑视为椭圆,式中A和B分别为椭圆长轴和短轴的长度。基于Labview和NI Vision的实时数据采集和图像处理程序可得出A和B并计算变形指数EI,因EI为无量纲参数,本方法所采用机器视觉图像采集和处理过程中可省略校准,全程共耗时约30 s。
1.2 数据处理
由上可见,整个测试过程得到的是沿同一时间轴实时变化的一组压力数据和一组衍射光斑图像。压力数据是指废液腔(由胶塞密封且经由电磁阀与负压装置可控相通)与进液腔(与大气相通)间的压差,由压力传感器实时测量采集,测得数据经计算可得出微通道内测试液所承受的平均剪切力。该计算过程可自编程后在Labview中调用code Interface Node来实现,基于现行设计,微通道中剪切力范围为0~30 Pa。
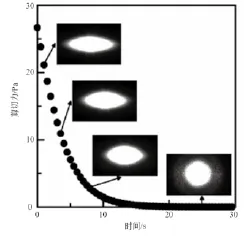
图2 红细胞变形衍射光斑Fig.2 Diffraction patterns of RSD

图3 椭圆拟合及边界点获取过程图Fig.3 operation for ellipse ftting and boundary points catching
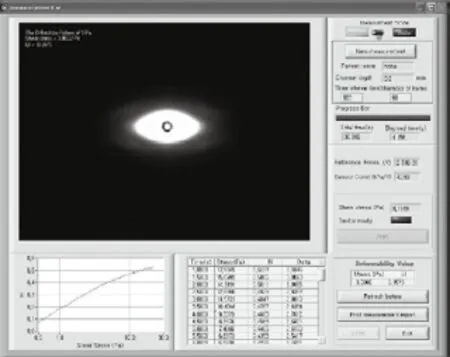
图4 RSD测量系统控制软件用户界面Fig.4 User interface of RSD program
衍射光斑图像在剪切力较高时呈现扁长椭圆形,随着剪切力的逐渐降低而趋于圆形,其图像处理基于NI Vision模块提供的各种图像处理函数,主要有以下三个过程:首先,利用clamp函数从水平和垂直两个方向上获取椭圆边界点,见图3;其次,将这些边界点输入到ellipse fitting函数中进行椭圆拟合,并得到拟合所得椭圆的长短轴数据;最后,利用前面所述公式计算EI。以上过程均可由Labview模块化编程自动完成,并经由用户界面显示数据、绘制图线、打印结果,见图4。
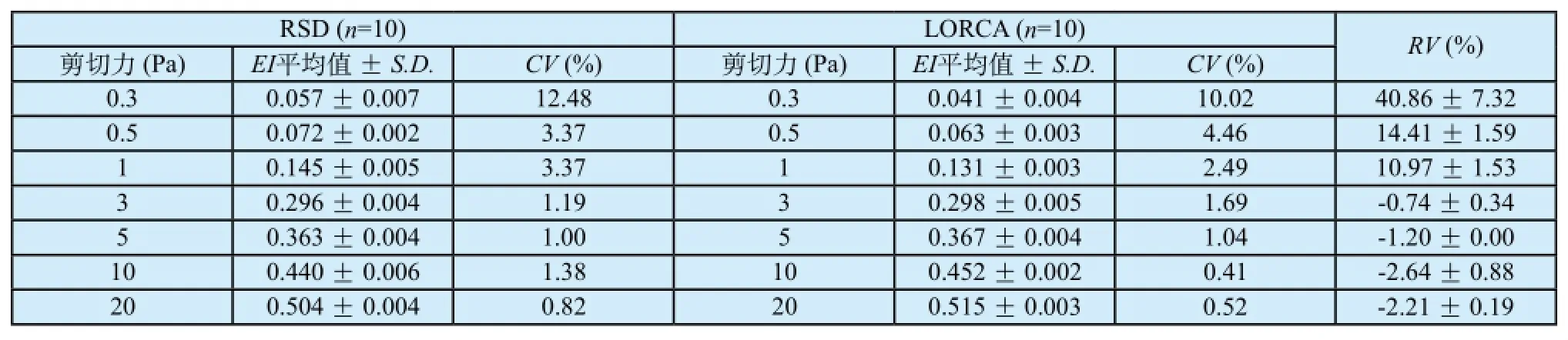
表1 同一血样通过RSD和LoRca测得eI平均值的对比分析*Tab.1 Mean values of eI for normal red blood cells measured with RSD and LoRca*
2 对比及结论
为了验证本系统的准确性,同一静脉血样同时在RSD和LoRca上进行了红细胞变形性测试,其结果见图5。两台设备测试方法均基于激光衍射法,数据处理算法和系统结构存在显著不同,但测试结果却十分吻合。此外,为进一步验证本系统的重复性,同一静脉血样在RSD和LoRca上分别进行了10次红细胞变形性测试,并对所得EI平均值进行对比分析,结果见表1。可见两台设备上获得的测试数据十分接近,随着剪切力的增加,EI平均值的变异系数CV值均呈下降趋势,且从剪切力大于1 Pa开始,两组数据的相对误差在2.7%以内。基于激光衍射法设计的红细胞变形性测试装置广泛采用剪切力为3 Pa时的EI值为评价红细胞变形性的关键指标,RSD和LoRca的测试结果在此指标位置分别为0.296和0.298(见表1),相对偏差在1%以内,十分接近。
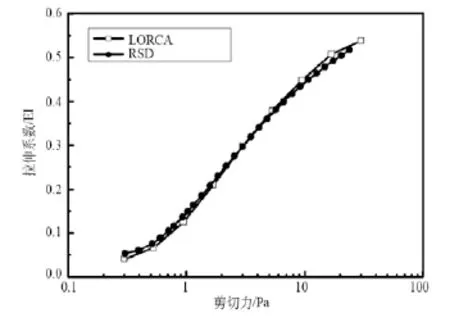
图5 同一血样基于RSD与LoRca测试结果的对比Fig.5 comparison of EI for normal sample measured with RSD and LoRca
基于以上对比,可见RSD与已成功商用机型LoRca的表现十分相近,具有很好的一致性、准确性和重复性。而其优势主要体现在:①与LoRca所采用的杯状固定测试容器相比,RSD采用由透明聚苯乙烯材料通过微注塑成型的一次性可抛微流控测试通道,价格低廉,测试完毕可直接作为医用废弃物处理,不需要清洗,避免样品交叉干扰,并减少测试人员劳动强度,提高工作效率;②一次测试仅需不到5 μL血样,可使用血糖仪一次性采血针获得,样品准备过程操作简单,且一次测试耗时在30 s以内;③机型结构相对简单,造价成本相对较低,有助于红细胞变形性即时检验(PocT)走进中小医疗机构,在糖尿病、心脑血管疾病诊断方面发挥作用。
[1] Drozdz W, Panek J, Lejman W. Red cell deformability in patients with chronic atheromatous ischemia of the legs[J]. Med Sci Monit, 2001, 7: 933-939.
[2] Testa I, Manfrini S, Gregorio F, et al. Red blood cell deformability in diabetic retinopathy[J]. Biorheology, 2003, 32: 389-395.
[3] Vaya a, Martinez M, Garcia J, et al. Hemorheological alterations in mild essential hypertension[J]. Throm Res, 1992, 66: 223-229.
[4] Huang Z, Hearne L, Irby ce, et al. Kinetics of increased deformability of deoxygenated sickle cells upon oxygenation[J]. Biophys J, 2003, 85: 2374-2383.
[5] Shin S, Ku YH, Park MS, et al. Slit-flow ektacytometry: Laser diffraction in a slit rheometer[J]. cytometry Part B clin cytometry, 2005, 65(1): 6-13.
[6] Groner W, Mohandas N, Bessis M. New optical technique for measuring erythrocyte deformability with the ektacytometer[J]. clin chem, 1980, 26: 1435-1442.
[7] Bessis M, Mohandas N, Feo c. automated ektacytometry: a new method of measuring red cell deformability and red cell indices[J]. Blood cells, 1980, 6: 315-327.
[8] Shin S, Hou JX, Suh JS, et al. Validation and application of a microfuidic ektacytometer (RheoScan-D) in measuring erythrocyte deformability[J]. clin Hemorheol Microcircul, 2007, 37: 319-328.
The Erythrocyte Deformability Measuring System Based on Microfuidic and Machine Vision
【 Writers 】HOU Jianxun1, SHIN Sehyun2
1 Shenzhen Institue for Drug Control (Shenzhen Testing Center of Medical Devices), Shenzhen, 518057
2 School of Mechanical Engineering, Korea University, Seoul, 136713, Korea
erythrocyte, deformability, microfuidic, machine vision
R 318.11
A
10.3969/j.issn.1671-7104.2016.03.005
1671-7104(2016)03-0173-03
2016-02-19
侯建勋,博士,e-mail: houhit@qq.com
【 Abstract 】The erythrocyte deformability mainly depends on the composition of the membrane and cytoplasm, which consist of hemoglobin and other constituents. The most of current devices to measure erythrocyte deformability require washing process after the measurement which is labor-intensive and time-consuming. This article introduces an improved measuring system based on microfuidic and machine vision (RSD) which adopts disposable microfuidic channel and conventional laser-diffraction technique to determine erythrocyte deformability. To validate the accuracy and repeatability of RSD, several experiments are conducted to determine deformability of normal erythrocytes measured by RSD and a conventional ektacytometer(LORCA). The measured Elongation Index (EI) by RSD, which is a parameter directly related to erythrocyte deformability, is in excellent agreement with it measured by LORCA.

