嗜水气单胞菌双重荧光定量PCR检测方法的建立与初步应用
高智玲,纪 雪,郭学军,陈 萍,刘彦晶,刘 军,祝令伟,周 伟,冯书章,孙 洋
嗜水气单胞菌双重荧光定量PCR检测方法的建立与初步应用
高智玲1,2,纪 雪1,郭学军1,陈 萍2,刘彦晶3,刘 军1,祝令伟1,周 伟1,冯书章1,孙 洋1
目的 建立快速准确检测致病性嗜水气单胞菌的双重荧光定量PCR方法。方法针对嗜水气单胞菌的16S rDNA和气溶素基因aerA的序列设计特异性引物及TaqMan探针,优化双重荧光定量PCR反应条件,并结合常规PCR方法及分离培养鉴定对临床样品进行检测和对比验证。结果荧光定量PCR反应体系对质粒标准品的敏感性为10拷贝/反应,是常规PCR检测方法的100倍;该方法检测12种其他种属细菌时未出现假阳性;对实际样品的检测结果其敏感性同样高于普通PCR,定量检测目的基因的拷贝数与样品中目的菌的分离率成正比。结论本方法敏感性高,特异性好,可用于致病性嗜水气单胞菌感染的诊断、疾病防控及流行病学研究。
嗜水气单胞菌;荧光定量PCR;检测;应用
Supported by the National Science and Technology Major Project of China (No. 2013ZX10004-217-002) and the Scientific and Technological Development Project of Jilin Province (Nos. 20140101032JC and 20150101110 JC) Corresponding author: Sun Yang, Email: sunyang10@hotmail.com
嗜水气单胞菌是一种革兰氏阴性杆菌,可从水、鱼、无脊椎动物、土壤及食物中分离出来,往往与其他疾病关联而发生继发性感染[1]。近年来,由于其对人类及水生动物的潜在致病性而备受世界关注。对于人类,嗜水气单胞菌可以引发多种疾病,从轻微的胃肠、伤口感染到危及生命的败血症及坏死性筋膜炎[2],对于鱼类,可引发出血病、红鳍病及败血症等疾病。目前,嗜水气单胞菌所引起的疾病已成为威胁我国水产养殖业的重要传染病,给我国水产养殖业造成了严重的经济损失[3]。因此,建立一种快速、准确的诊断方法显得尤为重要。实时荧光定量PCR是近年发展起来的一种新技术,与普通PCR相比,具有自动化程度高、快速、敏感、特异性好的特点[4],现已被广泛应用于生命科学研究的各个领域,例如细胞因子[5]、基因表达[6]、病毒筛选[7]和细菌病原体检测[8]等。本研究旨在建立基于TaqMan探针的双重实时荧光定量PCR方法,可同时完成嗜水气单胞菌的快速检测及毒力确认,为预防和监测致病性嗜水气单胞菌病的流行提供有效的检测方法。
1 材料与方法
1.1 菌株及样品 嗜水气单胞菌质控菌株ATCC7966、大肠杆菌DH5α及特异性检测所用菌株均为本实验室保存。鱼类样品采集于长春周边养鱼场及水产市场。
1.2 主要试剂与仪器 PCR扩增预混液Premix PrimeSTAR HS、T4 DNA连接酶、DL2000 DNA Marker及PMD18-T载体购自大连宝生物工程有限公司;DNA凝胶回收试剂盒购自天根生化科技有限公司;细菌基因组提取试剂盒和质粒提取试剂盒购自OMEGA公司;荧光定量PCR试剂盒为TaKaRa公司产品。实时定量PCR扩增仪(ABI StepOne Plus),核酸蛋白检测仪(Quawell Q5000)。
1.3 引物及探针的设计及合成 参考文献[9],针对嗜水气单胞菌属特异性16S rDNA基因片段,合成了引物和TaqMan探针,报告基团为FAM,淬灭基团为TAMRA。同时用Premier 5.0生物软件针对嗜水气单胞菌气溶素基因设计特异性引物和探针,报告基团为VIC,淬灭基团为BHQ1。引物、探针由invitrogen公司合成(表1)。
表1 引物及探针序列
Tab.1 Sequences of primers and probes

Primer/probeSequences(5′-3′)Productsize(bp)AH16SrDNA⁃FGGCCTTGCGCGATTGGATAT103AH16SrDNA⁃RGTGGCTGATCATCCTCTCAGAAH16SrDNA⁃PFAM⁃CAGGTGGGATTAGCTAGTTGGTGAGG⁃TAMRAAHaerA⁃FGCTCCAAGATCCCGGTGAAG146AHaerA⁃RGCGGTTGTCCGGATGGGTATAHaerA⁃PVIC⁃CGAGCTCTACAAGGCTGACATCTCCT⁃BHQ1
1.4 质粒标准品模板的制备 以ATCC7966基因组DNA为模板,扩增嗜水气单胞菌16S rDNA基因特异性片段和气溶素基因片段,凝胶回收试剂盒回收扩增的目的片段,与pMD18-T载体连接,分别转化DH5α感受态细胞,阳性克隆提取质粒,作为荧光定量PCR模板。
1.5 双重TaqMan实时荧光定量PCR反应条件的优化 荧光定量PCR反应体系为20 μL,反应条件为95 ℃预变性15 min,95 ℃,1s;60 ℃,20s,40个循环。设立阴性对照(去离子水)。分别以0.3 μL、0.5 μL、0.7 μL的引物及探针进行反应(各条引物、探针使用液均为10 μmol/L),以确定最佳引物浓度及探针浓度。
1.6 标准曲线的建立 重组质粒以核酸蛋白检测仪测定核酸浓度,根据重组质粒的碱基数计算分子质量,换算单位体积拷贝数。将质粒标准品10倍梯度稀释(109拷贝/μL~100拷贝/μL),分别取2 μL作为模板进行荧光定量PCR扩增,进而建立标准曲线。
1.7 特异性试验 以不同种属(嗜水气单胞菌ATCC7966、杀鲑气单胞菌、豚鼠气单胞菌、维氏气单胞菌、鼠伤寒沙门氏菌、肠球菌、铜绿假单胞菌、大肠杆菌、猪霍乱弧菌,肺炎克雷伯菌、不动杆菌、链球菌、及嗜麦芽寡养单胞菌)细菌基因组DNA为模板,进行双重嗜水气单胞菌TaqMan荧光定量PCR扩增,同时设阴性对照,鉴定其特异性。
1.8 重复性试验 以3个不同浓度的2种质粒标准品(107copies/μL、105copies/μL及103copies/μL)为模板,进行荧光定量PCR重复性试验。
1.9 敏感性试验 将109~100 copies/μL的质粒标准品进行双重TaqMan荧光定量PCR,并同时进行普通PCR,比较2种方法的检出限,确定敏感性指标。
1.10 实际样品的检测 73份淡水鱼鳃拭子及肠道内容物样品悬液以细菌基因组提取试剂盒抽提DNA制备模板,双重TaqMan荧光定量PCR进行检测,同时以普通PCR方法扩增。参考文献[10]方法,73份样品进行致病性嗜水气单胞菌的分离培养及鉴定。
2 结 果
2.1 双重TaqMan实时荧光定量PCR最佳反应体系的确定 经过对退火温度、模板、引物和探针的浓度进行优化,确定双重TaqMan 荧光定量PCR 20 μL反应体系的最佳组成为:Premix Ex Taq 10 μL,ROX 2 μL,引物、探针各0.5 μL,ddH2O 3 μL,模板2 μL。
2.2 标准曲线的建立 以优化的荧光定量PCR方法对梯度稀释的质粒标准品进行扩增,建立荧光定量PCR标准曲线(图1),16S rDNA基因及Aero基因扩增方程式分别为y=-3.393x+38.879和y=-3.19x+38.567,相关系数R2达到0.998及1。

图1 荧光定量PCR标准曲线Fig.1 Standard curves of fluorescence quantitative PCR
2.3 特异性检测 沙门氏菌、肠球菌和大肠杆菌等其他种属细菌的扩增结果均为阴性,仅嗜水气单胞菌呈现良好的扩增曲线,证明了该双重荧光定量PCR方法的特异性。
2.4 重复性试验 3个梯度的质粒标准品重复扩增4次,双重荧光定量PCR扩增曲线重叠性好,Ct值误差不到1个循环,变异系数(CV)在0.18%~0.55%之间,具有较高的可重复性,保证了检测结果的可靠性和稳定性(表2)。
表2 荧光定量PCR重复性试验结果
Tab.2 Results of reproducibility test
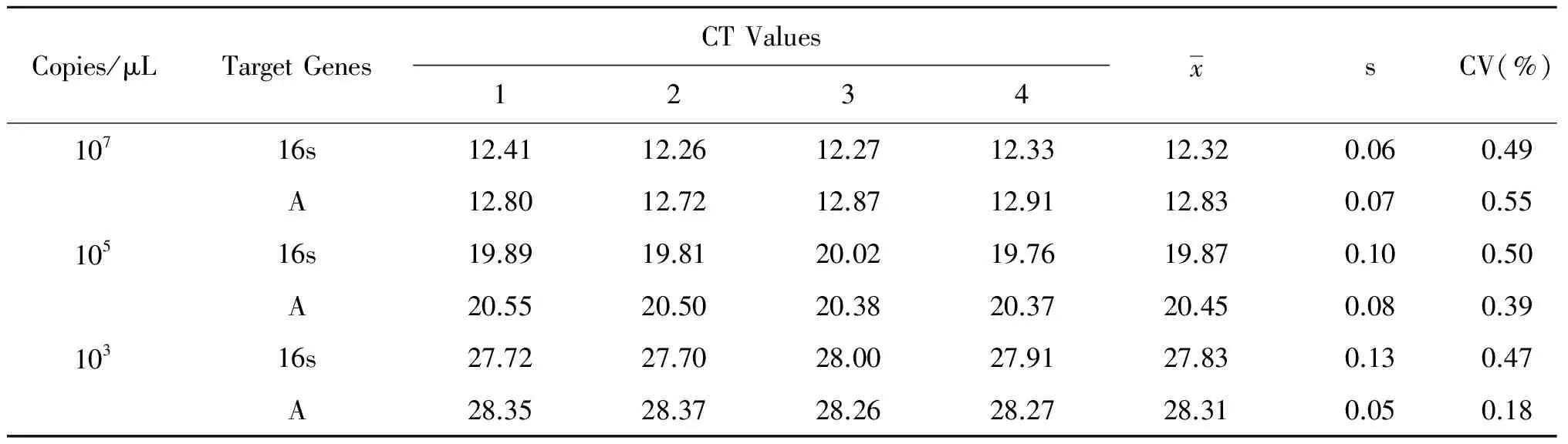
Copies/μLTargetGenesCTValues1234xsCV(%)10716s12.4112.2612.2712.3312.320.060.49A12.8012.7212.8712.9112.830.070.5510516s19.8919.8120.0219.7619.870.100.50A20.5520.5020.3820.3720.450.080.3910316s27.7227.7028.0027.9127.830.130.47A28.3528.3728.2628.2728.310.050.18
2.5 敏感性试验 结果表明双重荧光定量PCR对2种目的基因的最低检测限均为10拷贝(图2),而常规PCR的最低检测限为103拷贝(图3)。
2.6 实际样品检测结果 荧光定量PCR检测嗜水气单胞菌阳性率为97.26%(71/73),气溶素基因阳性率为79.45%(58/73);普通PCR检测嗜水气单胞菌阳性率为72.60%(53/73),气溶素基因阳性率为20.55%(15/73)。其中荧光定量PCR检测阴性样品普通PCR方法检测也为阴性,普通PCR检测阳性样品荧光定量PCR检测同样为阳性。以致病性嗜水气单胞菌选择性培养基进行分离培养并进行生化鉴定,73份样品有15份分离到致病性嗜水气单胞菌,均为荧光定量PCR检测阳性样品,阴性样品未分离到致病性嗜水气单胞菌。

1: 109copies;2:108copies;3:107copies,以此类推1: 109copies;2: 108copies;3: 107copies, and so on.图2 双重荧光定量PCR的敏感性检测Fig.2 Sensitivity analysis of fluorescence quantitative PCR
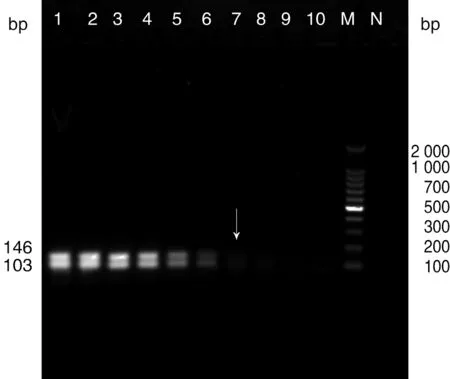
1~10孔的模板浓度依次为109~100 copies;M:100bp Marker;N:阴性对照1-10: 109-100 copies; M: 100bp Marker; N: Negative control.图3 双重常规PCR的敏感性检测Fig.3 Sensitivity analysis of ordinary PCR
3 讨 论
水产品的安全问题越来越受到全社会的关注,嗜水气单胞菌作为水产品中的常见菌,在水生环境中广泛分布,根据其毒力差异,可分为致病性菌株和非致病性菌株。致病性菌株可感染鱼类、两栖类、爬行类、鸟类和哺乳类等动物,轻可引起皮肤感染及腹泻,重者引起败血症,是一种典型的人兽共患病病原菌。目前,由于致病性嗜水气单胞菌引起水产养殖疾病的频发及人感染病例日渐增多,该菌的检测及防治变得愈加重要。
荧光定量PCR技术兼备核酸高效扩增和精确定量等优点,且假阳性率低、重复性好,与普通PCR相比具有明显的优势。本研究使用Premix Ex TaqTM预混酶替代了前期实验中的Ex Taq Hot Star、10×buffer和dNTP等试剂,使繁琐的加样过程变得简单、快速,并且降低了操作过程中污染的机率。建立的的荧光定量PCR方法对沙门氏菌、肠球菌、大肠杆菌等12种其他属的菌株进行检测,结果均为阴性,证明该方法对致病性嗜水气单胞菌具有很好的特异性,且敏感性高,最低检测限达到普通PCR方法的100倍。
该方法能够对实际样品的核酸提取物进行直接检测,使得检测结果更加快速、准确,同时能判定样品中目的菌的数量。在样品中目的菌较少的情况下,常规的分离培养难以获得阳性结果。实际样品的检测及分离鉴定结果表明,所有分离株均来源于荧光定量PCR阳性样品,且aerA基因拷贝数高的样品目的菌的分离率较高,进一步验证了本方法的实用性。本研究建立的双重荧光定量PCR检测方法可用于致病性嗜水气单胞菌感染的诊断、疾病防控及流行病学研究。
[1] Hawke JP, Khoo LH. Infectious diseases[M].Biology and culture of channel catfish,2004,34(1):387-443.DOI: 10.1016/S0167-9309(04)80016-4
[2] Janda JM, Abbott SL. The genusAeromonas: taxonomy, pathogenicity, and infection[J]. Clin Microbiol Rev, 2010, 23(1): 35-73. DOI: 10.1128/CMR.00039-09
[3] Robertson BK,Harden C,Selvaraju SB, et al. Molecular detection, quantification, and toxigenicity profiling ofAeromonasspp. in source-and drinking-water[J]. Open Microbiol J, 2014, 8: 32-39. DOI: 10.2174/1874285801408010032
[4] Hernandez M, Rodriguez LD, Esteve ST, et al. Development of melting temperature based SYBR Green I polymerase chain reaction methods for multiplex genetically modified or organism detection[J]. Anal Biochem, 2003, 323(2): 164-170. DOI: 10.21016/j.ab.2003.07.015
[5] Pan J, Xiang Q, Ball S. Use of a novel real-time quantitative reverse transcription polymerase chain reaction method to study the effects of cytokines on cytochrome P450 mRNA expression in mouse liver[J]. Drug Metab Dispos, 2000, 28(6): 709-713.
[6] Feng YM, Yan SM. Relative expression of CaBP-mRNA in tissues of broiler chickens by real time RT-PCR[J]. Heilongjiang Anim Sci Vet Med, 2007,(8): 27-30. DOI: 10.13881/j.cnki.hljxmsy.2007.08.009 (in Chinese)
冯永淼, 闫素梅. 利用实时定量RT-PCR测定肉鸡组织中CaBP基因的相对表达[J]. 黑龙江畜牧兽医, 2007,(8): 27-30.
[7] Liu K, Dong JC, Wu Q, et al. Establishment and application of multiple RT-PCR assay for detection of TGEV and PEDV[J]. Heilongjiang Anim Sci Vet Med, 2008,(11): 57-58. DOI: 10.13881/j .cnki .hljxmsy.2008.11.015 (in Chinese)
刘矿, 董加才, 吴青, 等. 多重RT-PCR检测猪传染性胃肠炎病毒和流行性腹泻病毒方法的建立及应用[J], 黑龙江畜牧兽医, 2008,(11): 57-58.
[8] Griffin MJ, Goodwin AE, Merry GE, et al. Rapid quantitative detection ofAeromonashydrophilastrains associated with disease outbreaks in catfish aquaculture[J]. J Vet Diagn Invest, 2013, 25(4): 473-481. DOI: 10.1177/1040638713494210
[9] Trakhna F,Harf-Monteil C,Abdelnour A, et al. RapidAeromonashydrophilaidentification by TaqMan PCR assay: comparison with a phenotypic method[J]. Lett Appl Microbiol, 2009, 49(2): 186-190. DOI: 10.1111/j.1472-765X.2009.02635.x
[10] Gao ZL, Ji X, Chen P, et al. Identification and antimicrobial resistance of pathogenicAeromonashydrophila[J]. Chin J Zoonoses, 2016, 32(4): 98-104. DOI: 10.3969/j.issn.1002-2694.2016.04.016 (in Chinese)
高智玲, 纪雪, 陈萍, 等. 致病性嗜水气单胞菌的分离鉴定及耐药性分析[J].中国人兽共患病学报, 2016, 32(4): 98-104.
Establishment and application of a duplex real-time fluorescence quantitative PCR assay for detection ofAeromonashydrophila
GAO Zhi-ling1,2, JI Xue1, GUO Xue-jun1, CHEN Ping2, LIU Yan-jing3, LIU Jun1,ZHU Ling-wei1, ZHOU Wei1, FENG Shu-zhang1, SUN Yang1
(1.InstituteofMilitaryVeterinary,AMMS,theKeyLaboratoryofJilinProvinceforZoonosisPreventionandControl,Changchun130122,China;2.CollegeofFoodScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China;3.TheAffiliatedHospital,ChangchunUniversityofChineseMedicine,Changchun130021,China)
To establish a method of duplex real-time fluorescence quantitative PCR assay for detectingAeromonashydrophilaand pathogenicA.hydrophilasimultaneously, two sets of primers and TaqMan probes were designed based on the sequences of the 16S rDNA and aerolysin (aerA) gene. Then the method was constructed and optimized. The specificity, sensitivity and reproducibility of the method were tested, and the clinic samples were detected. Results showed the sensitivity of the duplex real-time TaqMan PCR assay for testing of recombinant plasmids was 10 copies per reaction, which was 100 times higher than ordinary PCR method. No specific amplification was presented when twelve species of other bacteria genera were tested. The detection results of clinic samples showed that the sensitivity was also higher than that of ordinary PCR. And the gene copy numbers of quantitative detection were proportional to the rate separation. The method was highly sensitive, specific and practical, and could be used for the diagnosis, disease prevention and control and epidemiologic study of pathogenicA.hydrophila.
Aeromonashydrophila; fluorescent quantitative PCR; detection; application
10.3969/j.issn.1002-2694.2016.012.016
国家科技部传染病重大专项(No.2013ZX10004-217-002)和吉林省科技计划项目(No.20140101032JC,20150101110JC)联合资助
孙 洋,Email: sunyang10@hotmail.com
1. 军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,长春 130122; 2. 吉林农业大学,食品科学与工程学院,长春 130118; 3. 长春中医药大学附属医院,长春 130021
S852.61;R378
B
1002-2694(2016)12-1126-05
2016-05-01;
2016-07-22

