涂阳肺结核患者抗结核药物不良反应发生影响因素分析
马 艳,谢忠尧,张丽娜, 杜 建,刘宇红,李 亮
涂阳肺结核患者抗结核药物不良反应发生影响因素分析
马 艳1,谢忠尧1,张丽娜2, 杜 建1,刘宇红1,李 亮1
目的 探讨涂阳肺结核患者接受抗结核药物治疗的不良反应发生情况及其影响因素,为制定结核病防治策略提供参考。方法选择2008—2010年我国8个省(市、自治区)结核病定点医疗机构治疗诊治的涂阳肺结核患者共2 142例,根据是否发生不良反应将其分为两组,运用卡方检验单因素及logistic多因素回归对不良反应发生的危险因素进行分析。结果2 142例涂阳肺结核患者中536例患者出现不良反应,不良反应发生率为25.0%。经单因素分析结果表明年龄(χ2=23.815,P<0.001)、吸烟情况(χ2=12.040,P=0.024)及结果差异均有统计学意义。多因素非条件logistic回归结果显示, 45~64岁和≥65岁年龄组及吸烟是不良反应发生的独立危险因素,OR(95%CI)值分别为1.524(1.159~2.422)和1.756(1.200~2.570)及1.620(1.194~2.198)。结论涂阳肺结核患者中吸烟及中老年人是发生不良反应的危险因素,在患者诊治过程中,应及时对这类高危人群进行监测和主动干预,对发现和降低不良反应的发生率有着重要意义。
涂阳肺结核;抗结核药物;治疗;不良反应;影响因素
1 资料与方法
1.1 研究现场及对象
1.1.1 研究现场 根据我国结核病病情特点及东、中、西地域分布,选择上海市、广东省、天津市、河北省、河南省、重庆市、云南省、广西壮族自治区等8个省/直辖市/自治区的49个单位作为研究现场。
1.1.2 研究对象 2008年10月-2010年12月期间,现场实施单位确诊的痰涂片阳性肺结核患者。
1.2 调查方法 本研究应用前瞻性研究的方法,通过咨询相关专家、查阅相关文件及文献等制定调查问卷,根据设计好的调查问卷,由调查人员对患者一般情况、不良反应情况等内容进行面对面的调查,同时并记录患者吸烟饮酒等生活行为及不良反应发生情况等内容。
1.3 治疗方案 本研究中的涂阳肺结核患者(包括初治肺结核患者和复治肺结核患者)的治疗方案均按照《中国结核病防治规划实施工作指南(2008年版)》[3]方案执行。
1.3.1 初治肺结核患者 2H3-R3-E3-Z3/ 6H3-R3(强化期:异烟肼(isoniazid, H)、利福平(rifampin, R)、吡嗪酰胺(pyrazinamide, P)及乙胺丁醇(ethambutol, E))隔日1次,共2个月。继续期:异烟肼、利福平隔日1次,共4个月。全疗程6个月90次。
1.3.2 复治肺结核患者 2S3-H3-R3-E3-Z3/ 6H3-R3 -E3(强化期:异烟肼、利福平、吡嗪酰胺、链霉素(streptomycin,S)和乙胺丁醇隔日1次,共2个月。继续期:异烟肼、利福平和乙胺丁醇隔日1次,共6个月。全疗程共计8个月120次。
1.4 指标定义
在道路施工开始前,前期准备工作非常重要。首先要尽可能减少施工现场的杂物对施工的影响,将路面的杂物和清水清理干净,从而减少路面翻浆。在施工设计中合理规划市政道路边缘高度,并做好材料质量检查,为市政道路的稳定性和质量打下基础。在施工开始前要对施工材料、施工设备和施工现场进行严格的检查,确保满足水泥稳定碎石施工技术的施工标准。对施工人员要做好安全教育培训工作,加强施工人员的安全意识,提高施工整体质量水平,确保施工活动顺利开展。
1.4.1 药品不良反应 定义参照《药品不良反应报告和监测管理办法》[1],是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。不良反应判断标准参照国家药品不良反应监测中心的相关要求[2],在现场调查机构确诊(实验室确诊及临床确诊)为某种不良反应后,进行因果关系分析评价,内容包括:①用药与异常表现发生的时间顺序,有无合理时间关系;②有无文献资料佐证;③停药或减量时,异常表现是否减轻或消失;④如果再次应用可疑药物是否出现同样异常;⑤这种异常表现是否能以合并用药、结核病进展及其他因素来解释。对以上进行关联性评价,关联性评价结果分为肯定、很可能、可能、可能无关等。将肯定和很可能关联者判定为抗结核药物不良反应。不良反应数据统计时以症状最严重的不良反应计1次。
1.4.2 治疗类型(初治及复治肺结核) 按照《中国结核病防治规划实施工作指南(2008版)》[3]。
1.5 伦理学批准 本研究获得了北京市结核病胸部肿瘤研究所/首都医科大学附属北京胸科医院及其各合作单位伦理审查委员会的审批。
1.6 质量控制
1.6.1 课题实施过程中对调查对象均遵循知情、自愿的原则,并填报知情同意书。
1.6.2 质量控制 课题组统一培训调查人员,培训内容包括调查问卷填写方法和相关定义,如不良反应类型、监测办法,初治肺结核、复治肺结核等指标定义,使调查人员对肺结核治疗情况、不良反应情况有较为熟悉的了解。另外对数据录入人员进行系统的培训,同时双盲录入调查问卷,录入完成后进行复核,以确保数据录入的准确性。
1.7 统计学分析 采用SAS9.1软件对数据进行整理分析,检验水准为0.05,对调查对象社会学特征(包括年龄、性别、职业及文化程度等内容)进行描述性分析,用卡方检验、Fisher 精确检验比较不良反应患者及无不良反应患者在年龄、性别、职业、文化程度及户籍、吸烟饮酒及治疗类型等内容等方面的差异,同时对所有的变量同时进行多因素分析,以是否发生不良反应为因变量(变量赋值:未发生不良反应赋值为0,发生不良反应赋值为1),将年龄、性别、职业、文化程度及户籍、吸烟、饮酒及治疗类型纳入logistic回归模型,进行多因素分析,筛选出有统计学意义、与不良反应相关的因素。
2 结 果
2.1 涂阳肺结核患者的社会学特征 本次研究在2008年10月-2010年12月期间,共纳入现场实施单位确诊的2 142例涂阳肺结核患者,男性占72.5%(1 552/2 142),女性27.5%(590/2 142),男女比例为2.63∶1。最小年龄为8岁,最大年龄90岁,平均年龄(41.2±14.5)岁,年龄25岁~44岁最多占36.8%(789/2 142);职业以农民比例最多,占53.5%(1 147/2 142);文化程度以中学比例最高,占54.9%(1 176/2 142);已婚比例最高占69.5%(1 489/2 142),本地户籍人口比例最高,占72.1%(1 545/2 142); 目前吸烟者占17.4%(372/2 142),目前饮酒者占8.5%(183/2 142),复治患者占15.1%(324/2 142)(表1)。
表1 研究对象的社会学特征
Tab.1 Demographic characteristics of 134 retreated pulmonary tuberculosis

社会学特征Demographiccharacteristics例数Number(n=2142)构成比(%)Constituentratio(%)性别Sex 男Male155272.5 女Female59027.5年龄(岁)Age(Years) 0~39318.3 25~78936.8 45~67131.3 ≥6528913.5职业Profession 农民及外来务工人员 Farmersandmigrantworkers114753.5 企事业单位职工Employees1306.1 学生Students1014.7 其他Others76435.7文化程度Educationalattainment 文盲Illiteracy2019.4 小学Primaryschool55425.9 中学Juniormiddleschoolandhighschool117654.9 大专、本科及以上Collegedegreeandabove2119.9户籍Censusregister 本地户籍人口Thelocalpopulationregistered154572.1 非本地户籍人口Notlocalpopulationregistered59727.9表1(续)社会学特征Demographiccharacteristics例数Number(n=2142)构成比(%)Constituentratio(%)婚姻 未婚Unmarried52624.6 已婚Married148969.5 其他Others1275.9吸烟情况Smoking 从来不Non⁃smoker100546.9 过去吸,现在不吸Ex⁃smoker76535.7 现在吸Currentsmoker37217.4饮酒情况Drinking
2.2 涂阳肺结核患者抗结核治疗不良反应发生的单因素分析 2 142例涂阳肺结核患者中,536例涂阳肺结核患者发生至少一种及以上的不良反应,不良反应发生率为25.0%(536/2 142),发生不良反应和没有发生不良反应的涂阳肺结核患者在年龄(χ2=23.815、P<0.001)及吸烟情况(χ2=12.040、P=0.024)等差异有统计学意义(见表2)。不良反应在~24岁、25~45岁、45~65岁、65岁~的年龄组中的发生率分别为19.3%(76/393)、21.8%(172/789)、30.0%(201/674)、30.1%(87/289),不良反应发生率随年龄的增加而升高(表2)。
2.3 涂阳肺结核患者抗结核发生不良反应的多因素分析 多因素非条件logistic回归结果显示,年龄组45~64岁和≥65岁、吸烟者是不良反应发生的危险因素,OR(95%CI)值分别为1.524(1.159~2.422)和1.756(1.200~2.570)、1.620(1.194~2.198)(表3)。
3 讨 论
肺结核患者的治疗要坚持早期、规律、全程、适量、联合的原则,在治疗过程中出现的不良反应会影响到患者治疗依从性,甚至引起治疗中断,影响到治疗效果,因此了解不良反应发生的相关危险因素,以利于早期准确判定不良反应,合理处理并积极防治,减少不良反应及避免严重不良反应的发生。
表2 2 142例发生不良反应及未发生不良反应的涂阳肺结核患者单因素分析
Tab.2 Factors associated with TB-treatment adverse effects of univariate analysis

变量Variables不良反应组ADRGroup无不良反应组Non⁃ADRgroup例数Number(n=536)构成比(%)Constituentratio(%)例数Number(n=536)构成比(%)Constituentratio(%)不良反应发生率IncidencerateofADRχ2P性别Sex 男Male39172.9116172.325.20.0870.768 女Female14527.144527.724.6年龄(岁)Age(Years) 0~7614.231719.719.323.815<0.001 25~17232.161738.421.8 45~20137.547029.330.0 ≥658716.220212.630.1职业Profession 农民及外来务工人员Farmersandmigrantworkers28753.586053.525.0Fisher精确检验0.168 企事业单位职工Em⁃ployees346.396626.2 学生Students163855.315.8 其他Others19937.156535.226.0文化程度Educationalattainment 文盲Illiteracy478.81549.623.46.6170.085 小学Primaryschool15528.939924.828.0 中学Juniormiddleschoolandhighschool27350.990356.223.2 大专、本科及以上Collegedegreeandabove6111.41509.328.9户籍 本地户籍人口Thelocalpopulationregistered39072.8115571.925.20.1420.706 非本地户籍人口Notlo⁃calpopulationregistered14627.245128.124.5婚姻 未婚Unmarried11120.741525.821.15.7200.057 已婚Married39273.1109768.326.3 其他Others336.2945.926.0吸烟情况Smoking 从来不Non⁃smoker22342.178247.622.212.0400.024 过去吸,现在不吸Ex⁃smoker19737.256836.125.8 现在吸Currentsmoker11620.825616.331.2表2(续)
表3 涂阳肺结核患者发生不良反应影响因素logistic多因素回归分析
Tab.3 Risk factors associated with TB-treatment adverse effects of multivariate analysis
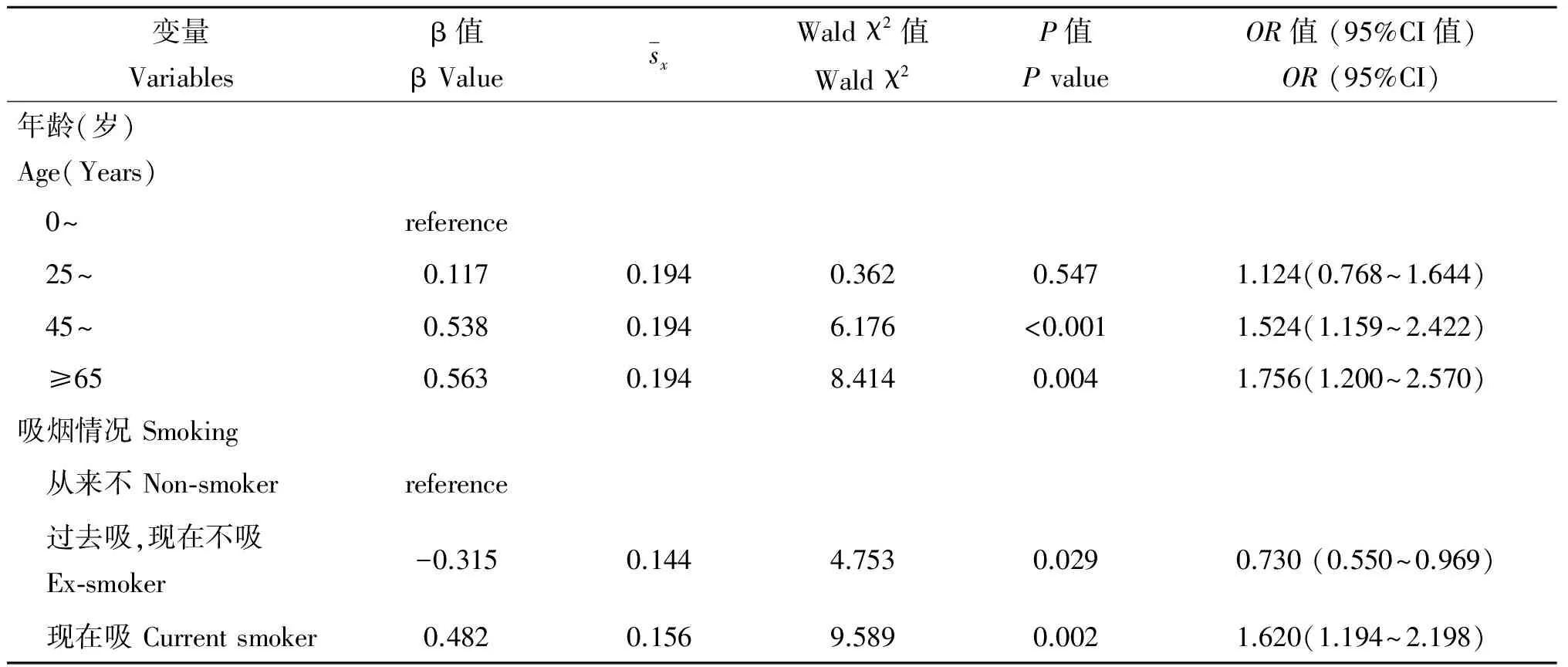
变量Variablesβ值βValuesxWaldχ2值Waldχ2P值PvalueOR值(95%CI值)OR(95%CI)年龄(岁)Age(Years) 0~reference 25~0.1170.1940.3620.5471.124(0.768~1.644) 45~0.5380.1946.176<0.0011.524(1.159~2.422) ≥650.5630.1948.4140.0041.756(1.200~2.570)吸烟情况Smoking 从来不Non⁃smokerreference 过去吸,现在不吸Ex⁃smoker-0.3150.1444.7530.0290.730(0.550~0.969) 现在吸Currentsmoker0.4820.1569.5890.0021.620(1.194~2.198)
国内外相关研究表明[4-24],抗结核治疗药物不良反应发生率在9.38%~83.54%之间,本研究结果表明涂阳肺结核患者不良反应发生率为25.0%(536/2 142),高于孙碧慧等(9.38%)[4]、夏愔愔等(12.62%)[5]、Xiaozhen Lv等(15.08%)[6]、梁莉等(16.3%)[7]、罗丹(17.2%)[9]等国内报道的不良反应发生率,也高于Carroll MW等[8]来自韩国的研究结果(17.1%)。低于来自国内相关专家的研究结果(25.72%~62.0%)[10-11,13-14,18,20,22-23]、哥伦比亚(29.97%)[12]、波兰(38.9%)[15]、巴西(41.5%~83.54%)[16,19,24]、伊朗(45.1%)[17]、尼泊尔(54.74%)[21]等研究结果,总体来说,不良反应发生率较高,同时不同研究结果之间发生不良反应率差异较大,可能与不同研究采用不良反应判定方法和标准、纳入病例的自身特征、应用的化疗方案、监测类型及患者管理等因素有关。面对这些不良反应的发生,只要及时监测,掌握好不良反应处理原则,不良反应处理均能达到较好的效果。加强对药物不良反应的监测,及早发现和合理有效的处理,可避免或减少不良反应的发生。
本研究结果发现中老年肺结核发生不良反应率较高,45~64岁及≥65岁~年龄组不良反应发生率分别为30.0%及30.1%,高于0~24岁(19.3%)及25~44岁(21.8%)年龄组,同时多因素分析结果表明45~64岁及≥65岁年龄组发生不良反应的风险分别是0~24岁年龄组的1.524倍及1.756倍,与相关研究结果[8-9,11-16,18,25]表明老年人是发生不良反应独立危险因素一致。可能是由于年龄较大患者机体自身的抵抗力下降、各器官组织功能减退,药物耐受性下降,加之基础疾病也相应增加,使药物的吸收、代谢等功能发生变化,如半衰期延长、清除率低,更易发生药物蓄积,使得老年人在抗结核治疗中更易发生不良反应。因此在治疗过程中,对中老年肺结核患者,要选择合理的治疗方案,必要时对抗结核药物的种类及剂量进行个体化调节,同时医务人员应就不良反应的相关知识例如可能出现的不良反应及服药的注意事项向患者做好细致的宣教,减少老年人的恐惧心理,增加治疗的信息,在治疗过程中密切监测不良反应,尽可能做到减少或降低不良反应的发生,提高患者治疗依从性,提高治愈率。
本研究结果表明吸烟患者发生不良反应的风险是不吸烟患者的1.620倍,是发生不良反应的危险因素,与来自秘鲁的研究结果吸烟的肺结核患者发生不良反应的风险是不吸烟的肺结核患者的2倍较为一致,同时Chang等[20]研究发现应用吡嗪酰胺的患者吸烟和肝毒性密切相关。可能是由于吸烟导致呼吸系统受损,免疫力下降,较易发生不良反应。故长期吸烟的肺结核患者服用抗结核药物(尤其是吡嗪酰胺)时可加重肝脏负担及呼吸系统负担,出现药物不良反应高。向其解释吸烟的危害,吸烟与结核病的关系,鼓励患者戒烟,以减少不良反应的发生,确保其完成全疗程。然而Przybylski等[15]在波兰的研究发现吸烟与不良反应无关。吸烟是否与不良反应的发生密切相关及发生关联的机理,尚需要进一步的研究。
相关研究结果表明饮酒[15,26]、女性[16-17]、文化程度[26]、有治疗史[17]及合并症[25,27]等因素与不良反应发生密切相关,是发生不良反应的危险因素,但在本研究中上述因素与不良反应的发生不相关,因此尚需要进一步的研究。
总之,早期、正确的处理不良反应是保证患者依从性取得治疗成功的关键。因此,医务人员重视药物不良反应,在抗结核治疗前,应向患者解释可能出现的不良反应及临床表现,以便患者自我监测早期发现,及时处理。同时加强对医务人员关于不良反应类型及发生不良反应的危险因素等知识进行培训,使其熟练掌握不良反应的处理原则和程序。尤其是对在抗结核治疗过程中,医务人员也应遵守不良反应的处理原则及程序,对容易发生不良反应的高危人群如年龄较大的吸烟的结核病患者,应密切监测,加强个体干预,一旦出现不良反应,应及时调整抗结核药物使用剂量或治疗方案。尽可能减少抗结核药物的不良反应预防严重不良反应的发生。
对广州市胸科医院(谭守勇),天津市结核病控制中心(傅衍勇),上海疾病预防控制中心(李向群),河南省疾病预防控制中心(马丽萍),河北省疾病预防控制中心(张联英),广西壮族自治区疾病预防控制中心(刘飞鹰),重庆市结核病防治所(胡代玉),云南省疾病预防控制中心(张艳玲)等相关人员在课题实施过程中给予的支持与协助,深表感谢。
[1] Ministry of Health of the People's Republic of China. Monitoring Regulations and Report on Drug Adverse Reaction (Order No 81of the Ministry of Health)[M]. 2011,5.04.(in Chinese)
中华人民共和国卫生部.药物不良反应报告与监测管理办法[M].2011, 5.04.
[2] Ministry of health of the People's Republic of China, China Food and Drug Administration. Monitoring Regulations and Report on Drug Adverse Reaction[M]. Beijing: Social Sciences Academic Press, 2004:3-16. (in Chinese)
中华人民共和国卫生部,国家食品药品监督管理局.药品不良反应报告和监测管理办法[M].北京:社会科学文献出版社,2004:3-16.
[3] Department of Disease Control, Ministry of Health, Department of Medical Administration, Ministry of Health, Chinese Center for Disease Control and Prevention. Guidline of implementing tuberculosis control programme China[G]. Beijing: Pecking Union Medical College Press, 2008: 89. (in Chinese)
卫生部疾病预防控制局,卫生部医政司,中国疾病与反控制中心.中国结核病防治规划实施工作指南[G].北京:中国协和医科大学出版社,2008.
[4] Sun BH, Zhao AG. Prospective study of adverse drug reactions monitoring in patients treated with anti-tuberculosis drugs[J]. China Med Herald, 2012, 9(19): 155-156. (in Chinese)
孙碧慧,赵安贵.常用抗结核药物不良反应监测前瞻性研究[J].中国医药导报,2012,9(19):155-156.
[5] Xia YY, Zhan SY. Systematic review of anti-tuberculosis drug induced adverse reactions in China[J]. Chin J Tuberc Respir Dis, 2007, 30(6): 419-423. (in Chinese)
夏愔愔,詹思延.国内抗结核药不良反应发生率的综合分析[J].中华结核和呼吸杂志,2007,30(6):419-423.
[6] Lyu X, Tang S, Xia Y, et al. Adverse reactions due to directly observed treatment strategy therapy in Chinese tuberculosis patients: a prospective study[J]. PLoS One, 2013, 8(6): e65037. (in Chinese)
[7] Liang L, Xu JL, Xiao HP, et al. Retrospective analysis on anti-TB Treatment adverse effects of tuberculosis pulmonary patients with first retreatment hospitalization[J]. Chin J Antituberculosis, 2008, 30(4): 379-380. (in Chinese)
梁莉,许家琏,肖和平,等.首次复治住院肺结核病人抗结核药物不良反应回顾分析[J]. 中国防痨杂志, 2008,30(4):379-380.
[8] Carroll MW, Lee M, Cai Y, et al. Frequency of adverse reactions to first-and second-line anti-tuberculosis chemotherapy in a Korean cohort[J]. Int J Tuberc Lung Dis, 2012, 16(7): 961-966.
[9] Luo D, Huang MY, Liu FY, et al. Research on characteristics and related factors of adverse reactions of anti—tuberculosis among Zhuang nationality patients with smear-positive pulmonary tuberculosis[J]. Chin J Infect Dis, 2012, 30(10): 613-617. (in Chinese)
罗丹,黄敏莹,刘飞鹰,等. 壮族人群痰涂片阳性肺结核患者抗结核药物治疗的不良反应及其影响因素[J]. 中华传染病杂志2012,30(10):613-617.
[10] Yang DQ. Analysis on adverse reactions of anti-tuberculosis with every other day treatment among 221 pulmonary tuberculosis patients[J]. Chin J Tuberc Respir Dis, 2008, 31(10): 773-774. (in Chinese)
杨德勤,肺结核病隔日化疗药物不良反应221例临床分析[J].中华结核和呼吸杂志,2008,31(10):773-774.
[11] Chen Y, Liu Y, Wang J, et al. Risk factors on adverse reactions of anti-tuberculosis among elder pulmonary tuberculosis patients[J]. Chin J Gerontol, 2015, 35(4): 2079-2081. (in Chinese)
陈羽,刘映,王静,等.抗结核病药物治疗老年肺结核的不良反应及影响因素[J].中国老年学杂志,2015,35(4):2079-2081.
[12] Marra F, Marra CA, Bruchet N, et al. Adverse drug reactions associated with first-line anti-tuberculosis drug regimens[J]. Int J Tuberc Lung Dis, 2007, 11(8): 868-875.
[13] Jin T. Investigation in adverse drug reactions of plate combination anti-tuberculosis drugs[J]. Clinical Focus, 2014, 29(6): 614-616. (in Chinese)
金韬.板式抗结核组合药物不良反应调查[J].临床荟萃,2014,29(6):614-616.
[14] Xie J, Ding SH, Liu LF, et al. Comparison study on adverse drug reactions of the plate combination anti-tuberculosis drugs in anti-tuberculosis chemotherapy[J]. Pract Prevent Med, 2013, 20(11): 1288-1291. (in Chinese)
谢靖,丁守华,刘林飞,等.抗结核板式药物治疗肺结核不良反应对照研究[J].实用预防医学,2013,20(11):1288-1291.
[15] Przybylski G, Dabrowska A, Trzcińska H. Alcoholism and other socio-demographic risk factors for adverse TB-drug reactions and unsuccessful tuberculosis treatment-data from ten years' observation at the Regional Centre of Pulmonology, Bydgoszcz, Poland[J]. Med Sci Monit, 2014, 20: 444-453. DOI: 10.12659/MSM.890012
[16] Damasceno GS, Guaraldo L, Engstrom EM, et al. Adverse reactions to antituberculosis drugs in Man-guinhos, RiodeJaneiro, Brazil[J]. Clinics(SaoPaulo), 2013, 68(3): 329-337.
[17] Javadi MR, Shalviri G, Gholami K, et al. Adverse reactions of anti- tuberculosis drugs in hospitalized patients: incidence, severity and risk factors[J]. Pharmacoepidemiol Drug Saf, 2007, 16(10): 1104-1110.
[18] Liao CD, Zhao XL, Zhang DK. Research on adverse drug reactions of the plate combination anti-tuberculosis drugs in anti-tuberculosis treatment[J]. Chin J Antituberculosis, 2008, 30(1): 67-68. (in Chinese)
缪昌东,赵小兰, 张德坤.板式抗结核组合药物不良反应调查[J].中国防痨杂志,2008,30(1):67-68.
[19] Vieira DE,Gomes M. Adverse effects of tuberculosis treatment: experience at an outpatient clinic of a teaching hospital in the city of Säo Paulo, Brazil[J]. J Bras Pneumol, 2008, 34(12): 1049-1055.
[20] Gholami K, Kamali E, Hajiabdolbagh M, et al. Evaluation of anti-tuberculosis induced adverse reactions in hospitalized patients[J]. Pharm Pract, 2006, 4(3): 134-138.
[21] Chhetri AK,Saha A,Verma SC, et al. A study of adverse drug reactions caused by first line anti-tubercular drugs used in Directly Observed Treatment, Short course (DOTS) therapy in western Nepal, Pokhara[J]. J Pak Med Assoc,2008, 58(10): 531-536.
[22] Xie L, Gao WW, Bu JL, et al. Analysis of the adverse drug reactions of anti-tuberculosis drugs in 702 cases[J]. Chin J Antituberculosis, 2008, 30(8): 275-276. (in Chinese)
谢莉,高微微,卜建玲,等. 702例抗结核药物所致不良反应分析[J].中国防痨杂志,2008,30(8):275-276.
[23] Wang XL, Zhang LP, Wang YH. Analysis and prevention of adverse reaction of anti-tuberculosis drugs in elderly patients[J].China Med, 2008, 5(3): 223-224. (in Chinese)
王秀丽,张乐平,汪远红. 抗结核药物治疗老年肺结核患者的不良反应及防治方法[J].中国医药, 2008,5(3):223-224.
[24] Maciel EL, Guidoni LM, Favero JL, et al. Adverse effects of the new tuberculosis treatment regimen recommended by the Brazilian National Ministry of Health[J]. J Bras Pneumol, 2010, 36(2): 232-238.
[25] Chung-Delgado K, Revilla-Montag A, Guillen-Bravo S, et al. Factors associated with anti-tuberculosis medication adverse effects: a case-control study in Lima, Peru[J]. PLoS One, 2011, 6(11): e27610. DOI: 10.1371/journal.pone.0027610
[26] Xiong Z, Bai LQ, Wang XJ, et al. Study on the incidence and risk factors of adverse reactions of anti-tuberculosis drugs in 115 new smear positive pulmonary tuberculosis patients[J]. Pract Prevent Med, 2015, 22(5): 537-540. (in Chinese)
雄姿,白丽琼,王孝君,等. 115例初治涂阳肺结核患者抗结核药物不良反应发生率和影响因素研究[J].实用预防医学, 2015,22(5):537-540.
[27] Tost JR, Vidal R, Cayla J, et a1. Severe hepatotoxicity due to anti-tuberculosis drugs in Spain[J]. Int J Tuberc Lung Dis, 2005, 9(5): 534-540.
Risk factors on adverse drug reactions of anti-tuberculosis treatment among smear-positive pulmonary tuberculosis patients
MA Yan1, XIE Zhong-yao1, ZHANG Li-na2, DU Jian1, LIU Yu-hong1,LI Liang1
(1.BeijingTuberculosis&ThoracicTumorResearchInstitute,BeijingChestHospital,CapitalMedicalUniversity,ClinicalCenteronTuberculosis,ChinaCDC,Beijing101149,China;2.NationalInstituteforVitalDiseaseControlandPrevention,Beijing102206)
To analyze the incidence and risk factors of adverse drug reactions (ADRs) among smear-positive pulmonary tuberculosis (PTB) patients and provide reference for tuberculosis prevention and control strategy, 2 142 smear-positive pulmonary tuberculosis patients who were diagnosed and treated which from 8 provinces during 2008-2010 were involved in the study. We divided smear-positive PTB patients into ADR group and non-ADR group according to the appearance of adverse reactions. Chi-square test and multivariate logistic regression analysis were used to analyze related risk factors of ADRs.Results showed that 536 cases occurred ADRs among 2 142 smear-positive PTB patients, incidence rate was 25.0%. Univariate analysis showed that there were significant statistical difference between ADRs group and non-ADRs group in age (χ2=23.815,P<0.001) and smoking (χ2=12.040,P=0.024). Multivariate logistic regression analysis revealed ADRs was significantly related to 45-64 age group, 65 and above age group, current smoker, the OR (95% CI) were 1.524 (1.159-2.422), 1.756 (1.200-2.570) and 1.620 (1.194-2.198). In conclusion, the middle-aged and elderly, smoking were independent risk factors associated with ADRs. To monitor and intervene above risk population in the process of patients' diagnosis and treatment, it is important significance to find and reduce the incidence of adverse reactions.

10.3969/j.issn.1002-2694.2016.012.006
“十一五”国家科技重大专项(No.2008ZX10003-008-02)资助
李 亮,Email:liliang69@hotmail.com; 刘宇红,Email:liuyuhong0516@126.com
1.北京结核病胸部肿瘤研究所 首都医科大学附属北京胸科医院 中国疾病预防控制中心结核病临床中心,北京 101149; 2.中国疾病预防控制中心病毒所,北京 102206
R378.91
A 文章标号:1002-2694(2016)12-1070-07
2016-08-27;
2016-11-09

