中药气阴双补对缓解期哮喘模型大鼠气道重塑及ERK信号分子表达的影响
周星星徐贤达阮晓琳宣桂琪陈 健
中药气阴双补对缓解期哮喘模型大鼠气道重塑及ERK信号分子表达的影响
周星星1徐贤达2阮晓琳1宣桂琪3陈 健3
目的研究中药气阴双补对缓解期哮喘模型大鼠气道重塑及细胞外信号调节蛋白激酶(ERK)信号分子表达的影响。方法6周龄健康雄性SD大鼠48只,随机分为正常组、模型组、中药低剂量组、中药中剂量组、中药高剂量组及地塞米松组,每组8只。用卵清蛋白(OVA)致敏和激发建立哮喘气道重塑大鼠模型,肺组织病理图像分析气道重塑,RT-PCR检测ERK、ERK2mRNA在肺组织表达,免疫印迹检测P-ERK蛋白在气道平滑肌表达。结果模型组肺组织切片平滑肌标化面积(WAm/Pbm)为(17.34±0.63)μm2/μm、内管壁标化面积(WAi/Pbm)为(42.35±3.31)μm2/μm,显著高于正常组的(7.63±0.32)μm2/μm和(26.73±1.50)μm2/μm(P<0.05);中药低剂量组WAm/Pbm为(13.68±0.52)μm2/μm,WAi/Pbm为(37.53±2.57)μm2/μm,中剂量组分别为(10.75±0.72)μm2/μm、(33.74±1.21)μm2/μm,高剂量组分别为(9.33±0.92)μm2/μm、(30.62±1.34)μm2/μm,均较模型组显著降低(P<0.05),但仍高于正常组(P<0.05);模型组ERK1mRNA(4.26±0.52)、ERK2mRNA(3.54± 0.37)、p-ERK(3.288±0.641)表达均显著高于正常组(1.02±0.11、0.96±0.13、0.703±0.338,P<0.05);中药低剂量组ERK1mRNA(3.23±0.45)、ERK2mRNA(2.72±0.21),中剂量组ERK1mRNA(1.65± 0.26)、ERK2mRNA(1.36±0.14)、p-ERK(2.172±0.221),中药高剂量组ERK1mRNA(2.37±0.23)、ERK2mRNA(2.03±0.12)、p-ERK(1.127±0.631)均明显低于模型组(P<0.05),但仍高于正常组(P<0.05)。结论中药气阴双补可改善缓解期哮喘大鼠气道重塑,抑制ERKl/2mRNA及P-ERKl/2蛋白在气道中的表达。
大鼠;哮喘;气道重塑;细胞外信号调节蛋白激酶(ERK);气阴双补
支气管哮喘(bronchial asthma)是一种以慢性气道炎症为特征的异质性疾病;具有喘息、气促、胸闷和咳嗽等呼吸道症状病史,呼吸道症状和强度可随时间变化,伴有可变的呼气气流受限[1]。气道重塑、慢性炎症、气道高反应性是哮喘的主要特征,而气道重塑主要表现为炎症细胞浸润和腺体增生肥大,细胞外基质沉积、基底膜增厚及气道平滑肌增厚,同时伴有非特异性的气道高反应性[2]。细胞外信号调节蛋白激酶(ERK)信号通路是多种细胞因子和炎症介质调控气道平滑肌增殖的关键途径[3],在平滑肌中主要有ERK1、ERK2两种亚型。前期临床实践证明中药气阴双补治疗缓解期哮喘有较好疗效,可显著减少小儿哮喘发作频率,对小儿哮喘的防治具有较好的临床意义,但具体作用机制尚不清楚。本实验通过观察气阴双补对缓解期哮喘模型大鼠气道重塑以及对ERK1、ERK2信号分子表达的影响,探讨其治疗缓解期哮喘,减少哮喘复发的作用机制。
1 实验材料
1.1 动 物 6周龄SPF级SD大鼠48只,雄性,体质量(150±20)g,中科院上海斯莱克实验动物有限公司,实验动物合格证号:SCXK(沪)2012-0002;实验动物饲养于浙江中医药大学动物实验研究中心屏障环境中,合格证号:SYXK(浙)2008-0116;饲喂普通饲料,自由饮食。
1.2 药 物 中药处方:南沙参、北沙参各6g,麦冬、地骨皮各9g,生白芍6g,生石决明10g,党参6g,白术9g,茯苓10g,陈皮5g,姜半夏6g(购自浙江中医药大学第一附属医院)。委托浙江中医药大学制剂室专业人员制剂,按低、中、高剂量分别浓缩至每毫升含生药0.4g、0.8g、1.6g药液,分装,置4℃冰箱备用。醋酸地塞米松片(批号1410202):仙琚制药股份有限公司。
1.3 试 剂 卵清蛋白(OVA)、氢氧化铝凝胶(AL (OH)3):美国Sigma;RNAiso Plus(总RNA提取试剂)、逆转录试剂盒、荧光定量试剂盒:大连Takara公司;BCA蛋白浓度测定试剂盒(增强型):碧云天生物技术研究所;10×组织裂解液(9803s-007)、兔抗PERK多克隆抗体(4370s-003)、二抗:美国 CST;ERK1、ERK2mRNA、β-actin引物由上海生工生物工程有限公司合成,见表1。

表1 大鼠相关基因引物序列
2 实验方法
2.1 分组、造模、给药及标本采集 48只SPF级SD大鼠,适应性饲养7天后随机分为正常组、模型组、中药低剂量组、中药中剂量组、中药高剂量组、地塞米松组6组,每组8只。造模方法[4-5]:致敏、激发处理:(1)致敏阶段:除正常组外,各组大鼠在实验的第1、8天腹腔注射1mL卵清蛋白(OVA)致敏液(含OVA 10mg和AL(OH)3200mg)致敏,每只大鼠前后腿内侧共4点,每点注射0.2mL,腹腔注射0.2mL。正常对照组于第1、8天注射等量0.9%生理盐水代替OVA。(2)激发阶段:第15天开始,用泵雾化器于自制简易的雾化箱中以一定浓度的OVA生理盐水溶液雾化激发大鼠,每次30min,隔天1次,持续8周。激发的浓度分别为第1、2周1%,第3、4周1.5%,第5、6周2%,第7、8周2.5%。正常组予以等量生理盐水雾化吸入。给药方法:第9周开始,模型组予以生理盐水代替药物灌胃,10mL/(kg·d),1天1次,连续2周;中药低、中、高剂量组予中药4g/kg、8g/kg、16g/ kg灌胃,1天1次,连续2周,地塞米松组以0.5mg/ kg地塞米松灌胃,1天1次,连续2周。治疗结束后麻醉开胸留取肺组织标本。
2.2 大鼠肺组织显微镜下观察 取大鼠肺组织用磷酸盐缓冲液(PBS)冲洗后用10%中性甲醛液固定,常规石蜡包埋、切片、HE染色后显微镜下观察[6]。将肺组织切片在显微镜下放大100倍,找到完整的细支气管横断面,采用图像采集软件采集图像,用医学图像分析软件测定支气管基底膜周径(Pbm)、气道平滑肌面积(WAm)、内管壁面积(WAi)的数值。将测得的WAm、WAi用Pbm进行标化,得出气道平滑肌标化面积(WAm/Pbm)、内管壁标化面积(WAi/Pbm)。
2.3 RT-PCR检测肺组织ERK mRNA表达 取部分大鼠肺组织提取总RNA,RNA逆转录为cDNA,进行PCR反应,具体操作步骤按TAKARA公司产品说明进行。
2.4 Western-blot检测p-ERK蛋白表达 取部分肺组织提取总蛋白,进行蛋白定量,电泳,转膜,封闭,进行免疫反应,扫膜。
3 实验结果
3.1 大鼠气道平滑肌标化面积(WAm/Pbm)和内管壁标化面积(WAi/Pbm)变化 与正常组比较,模型组肺组织切片平滑肌标化面积、内管壁标化面积明显增高(P<0.05);各治疗组与模型组比较,WAm/ Pbm、WAi/Pbm明显降低(P<0.05),但仍高于正常组(P<0.05);中药高剂量组WAm/Pbm、WAi/Pbm与地塞米松组比较,差异无统计学意义(P>0.05);中药低剂量、中剂量组明显高于地塞米松组,差异有统计学意义(P<0.05),见表2。
3.2 肺组织ERKmRNA表达 正常组、模型组和各治疗组肺组织ERK基因扩增良好,引物特异性好。以正常组表达量作为参照,其余各组ERK mRNA相对表达量都有所升高,与正常组比较差异有统计学意义(P<0.05);与模型组比较,各治疗组表达量均明显下降(P<0.05);中药中剂量组与地塞米松组比较,差异无统计学意义(P>0.05),见表3。
表2 各组大鼠气道平滑肌标化面积和内管壁标化面积比较(μm2/μm±s)

表2 各组大鼠气道平滑肌标化面积和内管壁标化面积比较(μm2/μm±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05
组别正常组模型组中药低剂量组中药中剂量组中药高剂量组地塞米松组只数8 8 8 8 8 8平滑肌标化面积(WAm/Pbm)7.63±0.32 17.34±0.63* 13.68±0.52*#△10.75±0.72*#△9.33±0.92*#9.62±0.87*#内管壁标化面积(WAi/Pbm)26.73±1.50 42.35±3.31* 37.53±2.57*#△33.74±1.21*#△30.62±1.34*#31.45±1.76*#
表3 各组大鼠肺组织ERK mRNA相对表达量比较(±s)

表3 各组大鼠肺组织ERK mRNA相对表达量比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05;ERK:细胞外信号调节蛋白激酶
组别正常组模型组中药低剂量组中药中剂量组中药高剂量组地塞米松组只数8 8 8 8 8 8 ERK1 mRNA (2-△△CT)1.02±0.11 4.26±0.52* 3.23±0.45*#△1.65±0.26*#2.37±0.23*#△1.46±0.14*#ERK2 mRNA (2-△△CT)0.96±0.13 3.54±0.37* 2.72±0.21*#△1.36±0.14*#2.03±0.12*#△1.16±0.96*#
3.3 大鼠肺组织p-ERK蛋白表达 与正常组比较,模型组p-ERK蛋白表达明显增加(P<0.05);与模型组比较,中药中剂量、高剂量组p-ERK蛋白表达明显降低(P<0.05),与地塞米松组比较,中药高剂量组p-ERK蛋白表达明显降低(P<0.05),而中药低剂量、中剂量组无明显差异(P>0.05),见表4、图1。
表4 各组大鼠肺组织p-ERK表达量比较(±s)
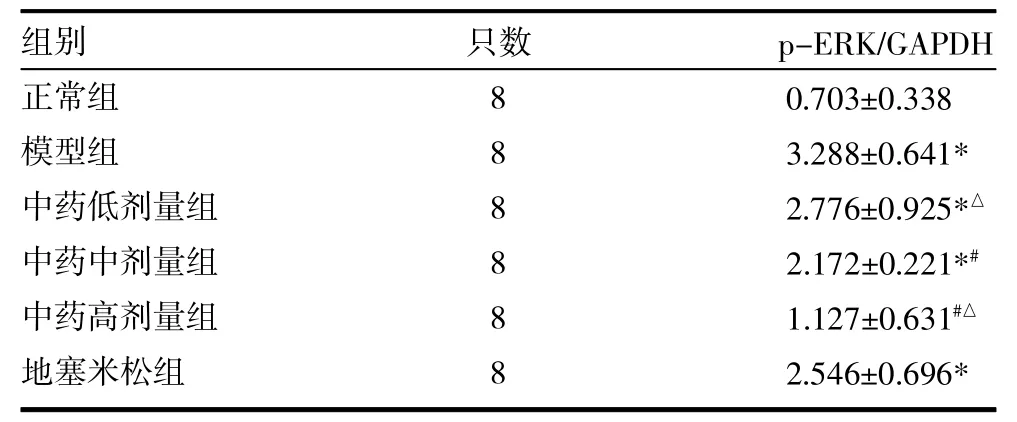
表4 各组大鼠肺组织p-ERK表达量比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05;ERK:细胞外信号调节蛋白激酶
4 讨 论
支气管哮喘属中医“哮病”、“喘证”范畴。近年来,运用中医药治疗哮喘气道重塑的研究逐渐增多。研究发现小青龙汤[7]、射干麻黄汤[8]、定喘汤[9]、丹龙定喘汤[10]、桑苏饮[11]、柴朴汤[12-13]等都能够抑制哮喘气道重塑。但现代医家也有伏痰论、痰瘀阻滞论[14]、体质因素论[15-16]、肝气上逆论[17]之别。全国名老中医专家宣桂琪教授在治疗缓解期哮喘时有独特的见解[18],他认为小儿“阳常有余、阴常不足”,小儿哮喘缓解期在临床上以阴虚为多,气虚也有,但阳虚较少。小儿肺脏娇嫩,具有“肝常有余,脾常不足,肾常虚”的生理特点,哮喘反复发作患儿,体虚肝旺的体质较多。哮喘日久不愈,耗伤肺阴,木旺侮金,使肺气上逆而喘鸣。阴虚生内热,感邪后易热化,邪热留恋,更伤阴血,虚火上灼致咽红日久不消,痰热不清,形成小儿哮喘愈后咳嗽难清的现象。所以宣教授常以肺阴虚及气阴两虚分型,在治疗中佐以平肝之品,目的是调整脏腑功能,祛除生痰之根本,减轻、控制发作,以图根治哮喘顽疾。方中南沙参清肺金止咳,润燥生津,北沙参、麦冬滋养胃阴为主以生肺阴,有培土生金之意;加以六君子汤益气健脾燥湿化痰,亦是培土生金之法;地骨皮滋阴清虚热,白芍配以石决明养肝阴平肝热,以防木火刑金而肺热难清。全方益气健脾燥湿,养阴润燥止咳,令气阴两复,肺润津生,则诸证可平,进而达到改善气道重塑的目的。
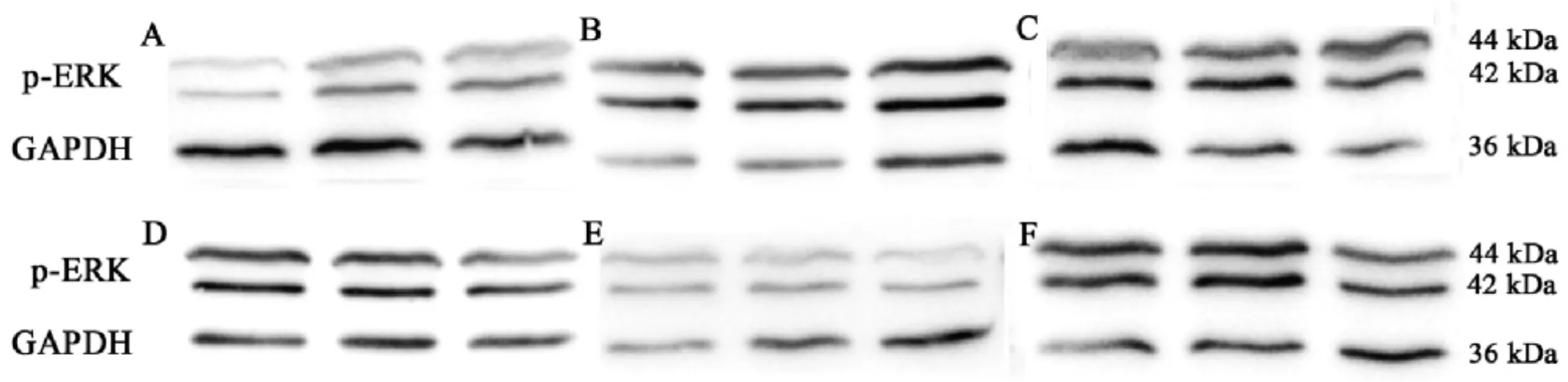
图1 Western blot检测各组大鼠肺组织磷酸化ERK蛋白表达
本研究通过气道形态学测量结果显示,哮喘模型组肺组织切片平滑肌标化面积、内管壁标化面积数值均明显增高,表示造模成功。中药各组WAm/ Pbm、WAi/Pbm与模型组比较均显著减轻,中药高剂量组与地塞米松组比较无显著差异,效果相仿。提示气阴双补中药能够改善气道重塑。
细胞外信号调节蛋白激酶(extracellular signalregulated kinase,ERK)通道是一种细胞内重要的信号转导通道,能够参与多种细胞异常增殖与分化的信号调控,联系着细胞外信号与细胞核反应间的信息转导。ERK信号通路是多种细胞因子和炎症介质调控气道平滑肌增殖的关键途径[19]。各种生长因子、炎症因子和神经递质都可以通过相应的受体途径激活胞浆内的ERK信号通路。实验研究[19]表明,ERK1、ERK2信号通道在慢性哮喘模型大鼠气道重塑的发生机制中发挥重要作用。本研究发现,模型组ERK1、ERK2在肺组织中的表达水平与正常组相比明显升高(P<0.05),说明哮喘气道重塑大鼠肺组织中ERK信号通路处于激活状态,从而使气道平滑肌增殖肥厚。与模型组比较,各治疗组ERKmRNA的表达水平明显减少(P<0.05),而且中药中剂量组与地塞米松组相比无显著差异(P>0.05)。本研究发现,与正常组比较,模型组p-ERK蛋白表达明显升高(P<0.05),说明ERK信号通路在哮喘气道重塑中具有重要的地位。与模型组比较,中药高剂量组p-ERK蛋白的表达明显降低(P<0.05)。RT-PCR与Westernblot检测结果提示,气阴双补能够改善气道重塑,可能是通过抑制ERKmRNA及磷酸化ERK蛋白的表达,抑制ERK信号通路的激活实现的。
综上所述,气道重塑可导致不可逆或可逆性的气流阻塞和气道高反应性,是目前哮喘慢性化和难治化的重要原因之一。本研究结果表明,气阴双补能够抑制气道平滑肌的增殖,抑制ERK信号通路的激活,从而有效的控制气道炎症,改善气道重塑,为临床实践提供依据。
[1]2014版全球哮喘防治创议(GINA)解读——与儿童哮喘相关内容[J].中国实用儿科杂志,2014,09(9):669-670.
[2]何安南.支气管哮喘气道重塑的研究进展[J].中国医药导报,2008,5(18):26-27.
[3]Lee JH,Joluson PR,Roth R,et al.ERK activation and mitogenesis in human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2001,280(5):L1019-L1029.
[4]王丽新,吴银根.实验性哮喘大鼠气道重塑的形态学变化[J].中西医结合学报,2003,1(1):62-65.
[5]钱振福,崔芳囡.国内支气管哮喘气道重塑动物模型的研究进展[J].医学综述,2009,15(1):14-18.
[6]Bai A,Eidelman DH,Hogg JC,et al.Proposed nomenclature for quantifying subdivisions of the bronchial wall[J].J Appl Physiol,1994,77(2):1011-1014.
[7]薛汉荣,余建玮,付向春,等.小青龙汤干预哮喘大鼠气道平滑肌细胞增殖作用的研究[C].中华中医药学会肺系病分会成立大会暨第十五次全国中医肺系病学术交流大会论文集,2011:238-241.
[8]张丽,刘建秋.射干麻黄汤对慢性哮喘小鼠气道重塑和TGF-β1的影响[J].吉林中医药,2010,30(6):533-534.
[9]于鸿,计忠宇,赵辉,等.定喘汤对支气管哮喘大鼠气道重塑及嗜酸粒细胞的影响[J].中国中医急症,2011,20(9):1437-1438.
[10]田金娜,李建保,刘小凡,等.丹龙定喘汤对哮喘小鼠气道重塑及MMP-9,TIMP-1的影响[J].中国实验方剂学杂志,2012,18(5):164-166.
[11]苏奎国,姜良铎,郭勇英,等.桑苏饮对哮喘模型大鼠气道重塑及肺组织上皮细胞ICAM-1表达的影响[J].山东中医药大学学报,2010,34(4):354-356.
[12]刘鑫,戴爱国,樊天会,等.柴朴汤对哮喘豚鼠肺内嗜酸粒细胞凋亡及气道重塑的影响[J].四川中医,2005,23 (6):15-16.
[13]刘鑫,张恒平,彭光耀,等.柴朴汤对支气管哮喘大鼠气道重塑及肺组织中α-平滑肌肌动蛋白表达的影响[J].中国实验方剂学杂志,2012,18(7):220-224.
[14]洪广祥.痰瘀伏肺是哮喘发作的夙根[J].江苏中医药,2007,39(6):1-2.
[15]康立媛.小儿哮喘从体质辨治体会[J].广西中医学院学报,2010,13(2):19-20.
[16]巴迎莹.哮病的“夙根”及过敏体质论治[J].光明中医,2011,26(4):630-632.
[17]于文娟,许海生,陈利国.从哮有“夙根”谈哮病从肝论治的机理[J].时珍国医国药,2006,3(3):445-446.
[18]王晓鸣,罗荣泉.儿科心悟[M].杭州:浙江科学技术出版社,2011:16-18.
[19]管小俊,张维溪,苏苗赏,等.ERK信号转导途径在哮喘大鼠气道重塑中作用的初步探讨[J].中国免疫学杂志,2007,23(11):1026-1030.
(收稿:2015-11-02 修回:2015-12-17)
Effects of Chinese Medical Qi and Yin Method on Airway Remodeling and ERK Signal Molecule Expres- sion in Asthmatic Rats
ZHOU Xingxing1,XU Xianda2,RUAN Xiaolin1,XUAN Guiqi3,CHEN Jian3.1 The FirstClinical College of Zhejiang Chinese Medical University,Hangzhou(310053),China;2 Department of Pediatrics, Xuzhou Chinese Medical Hospital,Xuzhou(221000),China;3 Department of Pediatrics,the First Hospital Affiliated to Zhejiang Chinese Medical University,Hangzhou(310006),China
ObjectiveTo investigate the influence of traditional Chinese medicine Qi-Yin method on trachea remodeling and the expression of extracellular signal adjust the protein kinase(ERK)signal molecules in stable asthmatic rats.MethodsForty-eight weight 180-200g healthy male Wistar rats were randomly divided into blank control group,asthma model group,traditional Chinese medicine low-dose group,traditional Chinese medicine middle-dose group,traditional Chinese medicine high-dose groupand dexamethasone group,with 8 rats in each group. The asthma trachea remodeling rat model was set up with ovalbumin(OVA)sensitization and activation.Lung tissue pathology image analysis was used to analyze trachea remodeling,RT-PCR to detect ERK1/2mRNA expression in trachea,western blot to determine p-ERK protein expression in trachea smooth muscle.ResultsCompared with normal group,asthma model group had higher lung tissue section smooth muscle standardized area(WAm/Pbm)and inside tube wall standardized area(WAi/Pbm)(17.34±0.63μm2/μm vs 7.63±0.32μm2/μm;42.35±3.31μm2/μm vs26.73±1.50μm2/μm;all P<0.05).The WAm/Pbm and WAi/Pbm were 13.68±0.52μm2/μm and 37.53±2.57μm2/μm in traditional Chinese medicine low-dose group,10.57±0.72μm2/μm and 33.74±1.21μm2/μm in traditional Chinese medicine middle-dose group,9.33±0.92μm2/μm and 30.62±1.34μm2/μm in traditional Chinese medicine high-dose group,which were significantly reduced compared to asthma model group,but still higher than those in blank control group(all P<0.05).ERK1mRNA,ERK2mRNA,and p-ERK protein expression were significantly higher in asthma model group than those in blank control group(4.26±0.52,3.54±0.37,3.288±0.641 vs 1.02±0.11,0.96±0.13, 0.703±0.338;all P<0.05).The ERK1/2mRNA in traditional Chinese medicine low-dose group were 3.23±0.45 and 2.72±0.21,in traditional Chinese medicine middle-dose group were 1.65±0.26 and 1.36±0.14,in traditional Chinese medicine high-dose group were 2.37±0.23 and 2.03±0.12;p-ERK in traditional Chinese medicine middle-and high-dose groups were 2.172±0.221 and 1.127±0.631,which were lower than those in asthma model group but still higher than those in blank control group(all P<0.05).ConclusionThe traditional Chinese medicine of Qi&Yin double repair method is good for trachea remodeling in stable asthmatic rat,by inhibiting expression of ERKl/2mRNA and p-ERKl/2 protein in trachea.
rats;asthma;trachea remodeling;ERK;Qi&Yin double repair method
浙江省自然科学基金资助项目(No.LY15H270004)
1浙江中医药大学第一临床医学院(杭州 310053);2江苏省徐州市中医院儿科(徐州 221000);3浙江中医药大学附属第一医院儿科(杭州 310006)
陈健,Tel:13634199868;E-mail:chenj670@163.com

