乙氧氟草醚对大鳞副泥鳅的毒性研究
夏晓华,卢辰华,李墨溢,王 坡,董 慧,高亚丹,常重杰*
(1.河南师范大学 生命科学学院,河南 新乡 453007; 2.河南师范大学附属中学 高三五班,河南 新乡 453007)
乙氧氟草醚对大鳞副泥鳅的毒性研究
夏晓华1,卢辰华1,李墨溢2,王 坡1,董 慧1,高亚丹1,常重杰1*
(1.河南师范大学 生命科学学院,河南 新乡 453007; 2.河南师范大学附属中学 高三五班,河南 新乡 453007)
为了检测除草剂乙氧氟草醚对水生生物的毒性,以大鳞副泥鳅(Paramisgurnusdabryanus)为受试对象,研究乙氧氟草醚对大鳞副泥鳅的急性毒性、生理毒性和DNA损伤程度。结果显示,随着染毒剂量的增加和染毒时间的延长,大鳞副泥鳅的死亡率升高。乙氧氟草醚对大鳞副泥鳅24 h、48 h、72 h、96 h的半数致死质量浓度(LC50)分别为41.87 mg/L、36.62 mg/L、29.96 mg/L、25.62 mg/L,安全质量浓度为8.40 mg/L。生理毒性试验结果显示,15.5 mg/L乙氧氟草醚染毒6 d,大鳞副泥鳅血液中谷丙转氨酶(GPT)、谷草转氨酶(GOT)活力值最大,与对照(0 mg/L)相比差异极显著。整体上,GPT和GOT活力随着染毒时间的延长和染毒剂量的升高呈上升趋势。通过单细胞凝胶电泳研究乙氧氟草醚对大鳞副泥鳅的DNA损伤,试验结果显示,6 d时试验处理组彗尾DNA百分含量、彗星尾长和Olive尾矩与对照相比均具有极显著差异(P<0.01)。表明,乙氧氟草醚对大鳞副泥鳅具有一定的毒性和DNA损伤效应,应适量施用。
乙氧氟草醚; 大鳞副泥鳅; 毒性; 谷丙转氨酶; 谷草转氨酶; 单细胞凝胶电泳技术
乙氧氟草醚(oxyfluorfen)是一种触杀型除草剂,在有光的情况下发挥除草作用[1]。长期大量应用化学除草剂带来的残毒和环境污染,直接危害到人畜健康,影响农业的可持续发展[2]。农业生产中的不合理使用、雨水冲刷、地表径流及农药厂污水的肆意排放等,使乙氧氟草醚进入河流、湖泊、海洋等水生生态系统,从而对水生生物的生存以及水生生态系统的稳定与平衡造成威胁。近年来,许多专家学者着重就乙氧氟草醚的分析方法、药效、残留动态等开展了较为系统的研究[3-5],关于乙氧氟草醚对水生生物的遗传毒性研究较少。
稻田养鱼,也被称作嵌套养殖,是人工稻鱼共生的生态结构,属淡水养鱼的组成部分,将种植业与养殖业结合起来,稻鱼互利互惠,从而实现稻鱼双丰收。该组合与中国南方农业中的“桑基鱼塘”模式一样,构成了生物多样性保护和农业资源利用的良性循环[6]。而泥鳅(广义)又属稻田生态渔业的优良养殖品种,其产量和效益均高于稻田养鱼、养蟹,精养泥鳅的稻田效益显著。大鳞副泥鳅(Paramisgurnusdabryanus)属鱼纲、鲤形目、鳅科、花鳅亚科、副泥鳅属。大鳞副泥鳅因其营养价值高而被称为“水中人参”,在国内外市场深受欢迎。
从环境毒理学的观点出发,无论污染物对生态系统的影响多复杂或最终的影响如何严重,必然是从对生物个体的作用开始。邹积鑫等[7]研究了乙氧氟草醚的同类药剂乙羧氟草醚对斑马鱼的急性毒性和生物富集性,发现其对鱼类的急性毒性较高,因此在施用时应合理控制剂量,尽量减少对水生生物的影响。
新乡市地处河南省北部,是黄河流域盛产大鳞副泥鳅的三大地区之一。目前,关于乙氧氟草醚对大鳞副泥鳅的毒性研究尚未见报道。为此,以当地大鳞副泥鳅为材料,探究了乙氧氟草醚对大鳞副泥鳅的急性毒性、生理毒性和遗传毒性,旨在为安全使用乙氧氟草醚、保护渔业资源、维护生态平衡奠定基础。
1 材料和方法
1.1 供试材料及试剂
350尾大鳞副泥鳅,购自河南新乡市海鸿农贸市场,发育状况良好,体质量13~16 g,体长9~12 cm。试验前用曝气3 d的自来水驯养1周,驯养期间死亡率小于2 %;挑选健康、体表无损的个体作为试验材料。试验前1 d停止喂食,进行饥饿处理,试验期间不投喂。
乙氧氟草醚制剂购自上海惠光化学有限公司;谷丙转氨酶(GPT)、谷草转氨酶(GOT)活力测定试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 乙氧氟草醚对大鳞副泥鳅的急性毒性试验 通过预试验,找出乙氧氟草醚使大鳞副泥鳅在96 h内全部存活的最高染毒剂量和全部死亡的最低染毒剂量,确定试验剂量区间。正式试验分6组,乙氧氟草醚质量浓度分别为0 mg/L、18.75 mg/L、23.44 mg/L、29.30 mg/L、36.62 mg/L、45.78 mg/L,每组均投放10尾健康大鳞副泥鳅,每24 h更换1次等体积等质量浓度的乙氧氟草醚,注意观察并及时清除死亡个体,以免影响其他个体的生存。然后观察记录大鳞副泥鳅24 h、48 h、72 h及96 h的死亡数量,并记录其中毒的症状。试验重复3次。
采用改进的寇氏法(Karber)[8-9]计算乙氧氟草醚对大鳞副泥鳅的半数致死质量浓度(LC50)和安全质量浓度。LC50的计算公式:lgLC50=Xm-i(∑p-0.5),式中Xm为死亡组最大剂量的对数;i为相邻组质量浓度对数之差;p为各组的死亡率,∑p为各组死亡率的总和。安全质量浓度(SC)的计算公式:SC=LC50(24 h)×0.3/[LC50(24 h)/LC50(48 h)]3。
1.2.2 乙氧氟草醚对大鳞副泥鳅的生理毒性试验 在急性毒性试验的基础上,在安全质量浓度和最大零致死质量浓度之间,设置乙氧氟草醚质量浓度分别为0 mg/L(CK)、8.0 mg/L、10.5 mg/L、13.0 mg/L、15.5 mg/L 5个试验组,每组均随机投放20尾健康大鳞副泥鳅,每隔1 d更换1次等体积等质量浓度的乙氧氟草醚。分别于2 d、4 d、6 d从每组随机取3尾大鳞副泥鳅,剪尾取血,按试剂盒说明书测定GPT、GOT活力。试验重复3次。
1.2.3 乙氧氟草醚对大鳞副泥鳅血细胞的DNA损伤试验 参照文献[10-11]的方法将1.2.2步骤取的血样制备血细胞悬液,制备玻片、裂解、解旋、电泳、中和,然后进行染色和观察。试验重复3次。
大鳞副泥鳅的单细胞凝胶电泳试验结果运用CASP软件进行分析,得出彗尾DNA (Tail DNA)百分含量、彗尾长度(TL)、Olive尾矩(OTM)3项指标的数据。
1.3 数据处理
试验数据采用Excel和SPSS 16.0软件进行单因素方差分析,用平均数±标准差表示。
2 结果与分析
2.1 乙氧氟草醚对大鳞副泥鳅的急性毒性
大鳞副泥鳅刚染毒时,表现为急剧游动、四处乱窜,尤其在高剂量组中表现更为明显,上窜下跳、打团、翻白,片刻后稍趋于平静,伏于水底,胸鳍张开。随着乙氧氟草醚剂量的增加,死亡率不断升高,大鳞副泥鳅表现为反应迟钝、身体弯曲、游动缓慢,逐渐丧失平衡能力,翻白肚等现象,死亡时身体僵直,脊椎略弯曲成弓形。
由表1可知,乙氧氟草醚对大鳞副泥鳅24 h、48 h、72 h、96 h的半数致死质量浓度分别为41.87 mg/L、36.62 mg/L、29.96 mg/L、25.62 mg/L,安全质量浓度为8.40 mg/L。由试验结果可以看出,同一时间段内,大鳞副泥鳅死亡率随乙氧氟草醚质量浓度的升高而增加;同一剂量组,其死亡率随时间的延长而增加。说明大鳞副泥鳅的死亡率与乙氧氟草醚呈时间剂量效应关系。
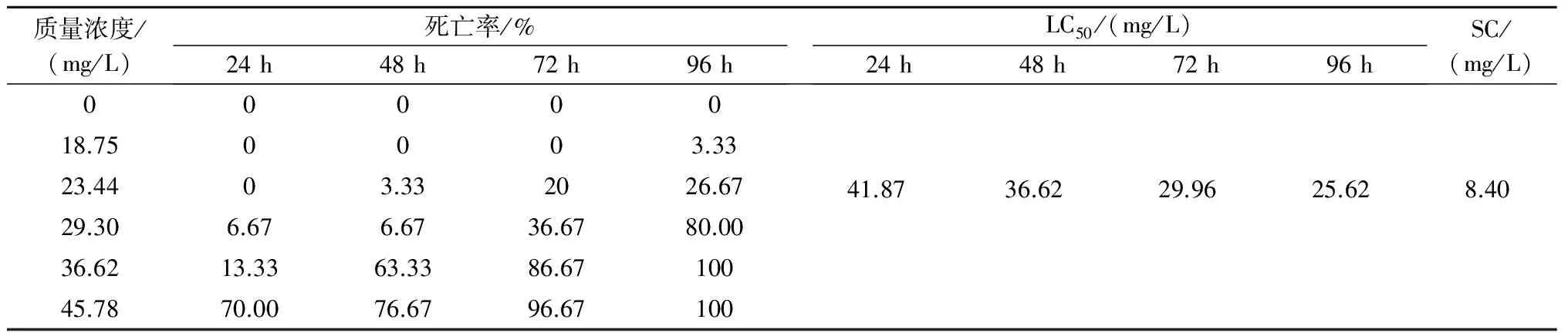
表1 乙氧氟草醚各浓度组大鳞副泥鳅的死亡率、半数致死质量浓度和安全浓度
2.2 乙氧氟草醚对大鳞副泥鳅血清GPT和GOT活性的影响
由表2可知,15.5 mg/L乙氧氟草醚处理6 d后,大鳞副泥鳅GPT、GOT活力最大,与对照组相比有极显著差异,分别增高172.88%、174.66%。从相同时间不同质量浓度来看,大鳞副泥鳅的GPT、GOT活力均随乙氧氟草醚染毒剂量的上升而呈升高的趋势;从相同质量浓度不同时间来看,随着时间的延长,血清里的GPT、GOT活力也都呈升高趋势。可见,大鳞副泥鳅血清GPT及GOT活力与乙氧氟草醚呈时间剂量效应关系。通过生理毒性试验结果可以看出,血清中GPT和GOT活力均升高,这是由于肝脏因毒物影响而受损,使肝脏中的这2种酶大量释放到血清中,从而导致血清中这2种酶活力增强。
注:*表示与对照组比较差异显著(P<0.05),**表示与对照组比较差异极显著(P<0.01),下同。
2.3 乙氧氟草醚对大鳞副泥鳅血细胞DNA损伤结果
细胞经过裂解、解旋、电泳后,断裂的DNA会在电场力的作用下从核内移出,荧光染料染色后,在荧光显微镜下,可观察到受损细胞核的彗星状图像。由图1可以看出,处理6 d时对照组细胞核呈圆球形,彗星头部DNA致密且集中,细胞核未受损;随着乙氧氟草醚剂量的增加,各处理组细胞核均有拖尾呈现如彗星样,细胞核头部逐渐缩小,拖尾逐渐变长,尾部DNA变得发散,细胞核受损程度也越来越严重。
由表3可以看出,乙氧氟草醚染毒2 d时,不同剂量组大鳞副泥鳅血细胞的慧尾DNA百分含量、尾长和Olive尾距与对照组相比均升高,差异均不显著(除15.5 mg/L组的慧尾DNA百分含量);染毒4 d时,乙氧氟草醚低质量浓度(8.0 mg/L、10.5 mg/L)处理组,大鳞副泥鳅血细胞的慧尾DNA百分含量、尾长和Olive尾距与对照组相比均无显著差异,15.5 mg/L处理组细胞慧尾DNA百分含量、尾长和Olive尾距显著或极显著升高;染毒6 d时,不同剂量组大鳞副泥鳅血细胞的慧尾DNA百分含量、尾长和Olive尾距均极显著高于对照组。较高剂量的乙氧氟草醚对大鳞副泥鳅血细胞DNA造成了损伤。在同一质量浓度不同处理时间条件下,随着处理时间的延长,慧尾DNA百分含量和Olive尾距呈升高趋势;在相同处理时间不同质量浓度条件下,随着质量浓度的升高,尾长逐渐增加,但在第6天高质量浓度组(13.0 mg/L、15.5 mg/L)尾长变短。由此可见,乙氧氟草醚诱发的细胞DNA损伤率在各浓度之间均呈明显的剂量效应关系。
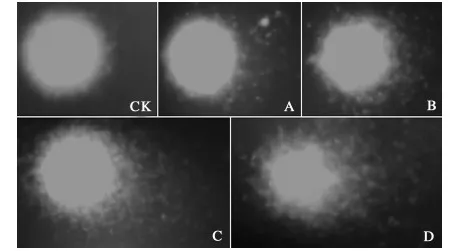
CK:对照组; A:8.0 mg/L; B:10.5 mg/L; C:13.0 mg/L; D:15.5 mg/L
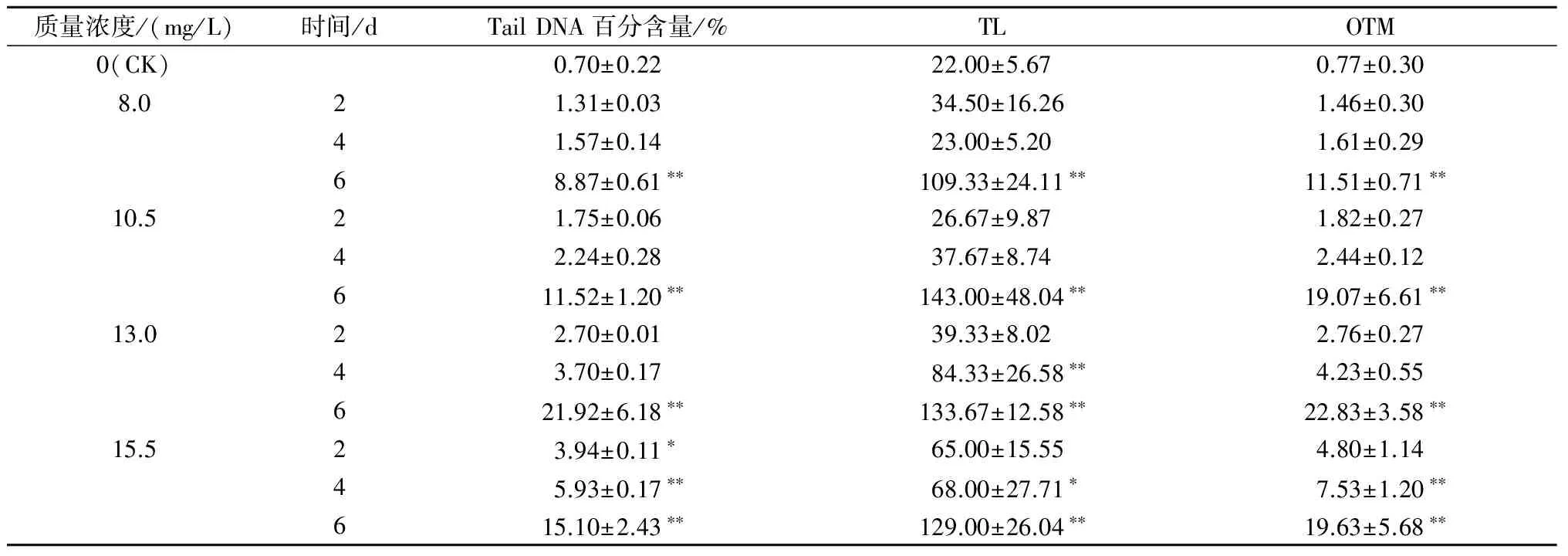
质量浓度/(mg/L)时间/dTailDNA百分含量/%TLOTM0(CK)0.70±0.2222.00±5.670.77±0.308.021.31±0.0334.50±16.261.46±0.3041.57±0.1423.00±5.201.61±0.2968.87±0.61∗∗109.33±24.11∗∗11.51±0.71∗∗10.521.75±0.0626.67±9.871.82±0.2742.24±0.2837.67±8.742.44±0.12611.52±1.20∗∗143.00±48.04∗∗19.07±6.61∗∗13.022.70±0.0139.33±8.022.76±0.2743.70±0.1784.33±26.58∗∗4.23±0.55621.92±6.18∗∗133.67±12.58∗∗22.83±3.58∗∗15.523.94±0.11∗65.00±15.554.80±1.1445.93±0.17∗∗68.00±27.71∗7.53±1.20∗∗615.10±2.43∗∗129.00±26.04∗∗19.63±5.68∗∗
3 结论与讨论
应用生物检测水环境污染,有多种检测方法。对水生生物常见的检测方法有生理生化指标和遗传物质损伤的检测,而将泥鳅作为水污染的模式生物进行研究已越来越受人们重视。本试验以大鳞副泥鳅为材料,探究乙氧氟草醚对大鳞副泥鳅的毒性作用。根据中国《化学农药环境安全评价试验准则》[12],当农药对鱼类的96 h LC50>10 mg/L时,说明该农药对鱼类属于低毒。由本试验结果可知,乙氧氟草醚对大鳞副泥鳅的96 h LC50为25.62 mg/L,说明乙氧氟草醚对大鳞副泥鳅为低毒。急性毒性试验结果表明,随着染毒时间的延长,大鳞副泥鳅死亡率升高。由此可见,乙氧氟草醚对水生生物有一定的毒害作用。所以,在使用这类农药时一定要注意安全,使用后一定要合理处理废液,避免污染水源、破坏环境、对水生生物造成危害。
GPT和GOT是广泛存在于动物细胞线粒体中的重要氨基酸转移酶,在机体蛋白质代谢中起着重要作用。当生物的生理机能处于正常情况下,GPT和GOT主要存在于细胞内,而血清中的转氨酶活性很低,当肝脏受到毒性物质影响而发生损伤时,肝脏中的这2种酶会大量释放到血清中,致使血清中这2种酶活性增强,而肝组织中的酶活性降低。因此可根据血清中这2种酶的活性来判断肝脏的损伤情况[13-15]。冯健等[16]研究了镉对草鱼的肝胰脏、肾脏功能的影响,结果表明镉中毒可使血清中的GOT活性升高。在本试验中,乙氧氟草醚对大鳞副泥鳅处理后GPT和GOT活力均呈升高的趋势。表明,乙氧氟草醚对大鳞副泥鳅的肝细胞造成了损伤,导致肝细胞中这2种酶发生大量外泄。
在单细胞水平上检测DNA链损伤的方法,最常见的是单细胞凝胶电泳技术。彗尾DNA百分含量、尾长和Olive尾距是彗星试验中反映细胞DNA所受损伤的重要指标。彗尾DNA百分含量和Olive尾距越大,尾长越长,说明细胞DNA受到的损伤越严重。鱼类吸收了水环境中的毒物,可导致造血干细胞染色体断裂,从而影响其外周血环境[17],故本研究用彗星电泳检测了大鳞副泥鳅血细胞的DNA损伤程度。在6 d时,15.5 mg/L处理组的彗尾DNA百分含量、尾长和Olive尾距均较13.0 mg/L处理组有所下降,可能是由于DNA的损伤过于严重,以致于电泳时造成了DNA片段的丢失,因此导致了测量值的下降[18-19]。
综上,乙氧氟草醚对大鳞副泥鳅具有一定的急性毒性、生理毒性和DNA损伤效应,因此在使用除草剂时一定要适量施用,合理处理废液,避免污染水源,以减少对生态环境和水生生物造成的威胁。同时,合理使用农药是嵌套养殖技术发展的关键,对农业生产和环境保护及其他相关领域具有重要意义。
[1] 范莲生.二苯醚类除草剂乙氧氟草醚[J].农药,2000,39(2):35-37.
[2] 强胜,陈世国.环保与生物除草技术[J].国际学术动态,2009(5):26-28.
[3] 王峰恩,李瑞菊,方丽萍,等.乙氧氟草醚在大蒜和土壤中的残留动态[J].山东农业科学,2014,46(2):119-124.
[4] 方平,龚道新,赵亮,等.乙氧氟草醚在稻田中的残留消解及其在土壤中的吸附[J].湖南农业科学,2012,(21):69-72.
[5] 宋超,贾旭淑,陈家长.单细胞凝胶电泳检测镉对中华倒刺鲃肝细胞DNA的损伤[J].江苏农业科学,2013,41(1):275-277.
[6] 黄太寿,宗民庆.稻田养鱼的发展历程及展望[J].中国渔业经济,2007(3):27-29.
[7] 邹积鑫,何雄奎,陶传江,等.乙羧氟草醚对斑马鱼的急性毒性和生物富集性研究[J].农药学学报,2006,8(4):375-378.
[8] 张毓琪,陈叙龙.环境生物毒理学[M].天津:天津大学出版社,1993:257-258.
[9] 惠秀娟.环境毒理学[M].北京:化学工业出版社,2003:270-271.
[10] 陈忻,西田浩志,小西徹也.单细胞凝胶电泳技术检测小鼠成纤维细胞DNA的氧化损伤及修复[J].西安交通大学学报,2007,28(1):25-26.
[11] 曹毅,陈瑞,王仲文,等.彗星分析技术检测辐射和化学物质诱导的DNA损伤[J].癌变·畸变·突变,2003,15(3):144-146.
[12] 国家环保局.化学农药环境安全评价试验准则[J].农药科学与管理,1990(2):1-5.
[13] 刘存歧,刘丽静,王军霞,等.盐碱地渗水钙镁离子对凡纳滨对虾酶活力的影响[J].动物学杂志,2007,42(2):129-133.
[14] 王虹扬,黄沈发,徐镜波,等.热污染对金鲫鱼组织内四种酶活性的影响[J].中国环境科学,2006,26(3):372-375.
[15] 陈晨,黄峰,舒秋艳,等.共轭亚油酸对草鱼生长、肌肉成分、谷草转氨酶及谷丙转氨酶活性的影响[J].水生生物学报,2010,34(3):647-651.
[16] 冯健,刘永坚,田丽霞,等.草鱼实验性镉中毒的肝、肾病理学研究[J].中山大学学报(自然科学版),2003,42(2):226-230.
[17] Jiang G C.Study on the acute toxicity and genetics toxicity of bensulfuronk methyl onDaniorerio[J].Agricultural Science & Technology,2009,10(4):128-131.
[18] Rissode Favemey C,Devaux A,Iafaurie M,etal.Cadmium induces apoptosis and genotoxicity in rainbow trout hepatocytes through generation of reactive oxygene species [J].Aquatic Toxicology,2001,53(1):65-76.
[19] Vanzella T P,Martinez C B,C′olus I M.Genotoxic and mutagenic effects of diesel oil water soluble fraction on a neotropical fish species[J].Mutation Research,2007,631(1):36-43.
Toxic Effects of Oxyfluorfen on Paramisgurnus dabryanus
XIA Xiaohua1,LU Chenhua1,LI Moyi2,WANG Po1,DONG Hui1,GAO Yadan1,CHANG Zhongjie1*
(1.College of Life Sciences,Henan Normal University,Xinxiang 453007,China; 2.The Affiliated High School of Henan Normal University,Grade Three Class Five,Xinxiang 453007,China)
In order to assess the toxicity of herbicide oxyfluorfen to aquatic organisms,withParamisgurnusdabryanusas the experimental object,toxic effects of oxyfluorfen onParamisgurnusdabryanusincluding acute toxicity,physicological toxicity and DNA damage were studied.Results showed that theParamisgurnusdabryanus’ mortality increased with the concentration increasing and the extension of time.The LC50of oxyfluorfen toParamisgurnusdabryanusin different periods(24 h,48 h,72 h,96 h) were 41.87 mg/L,36.62 mg/L,29.96 mg/L,25.62 mg/L,respectively.The safety concentration was 8.40 mg/L.Through physicological experiments,the activities of GPT and GOT inParamisgurnusdabryanus’ blood cells increased obviously, the maximum value appeared in the high treatment group(15.5 mg/L) on the sixth day and had significant differences compared with the control(0 mg/L).Overall,the activities of GPT and GOT inParamisgurnusdabryanus’ blood cells increased obviously with the extension of time and the concentration increasing.With single cell gel electrophoresis technique (SCGE),we studied the DNA ofParamisgurnusdabryanusblood cells damaged by oxyfluorfen.The results showed that all the treatment groups’ tail DNA content,tail length,olive tail moment showed obvious differences compared with the control group on the sixth day in a whole (P<0.01).The experiment results showed that the oxyfluorfen had certain toxicity and DNA damage effect onParamisgurnusdabryanus,and it should be used reasonably.
oxyfluorfen;Paramisgurnusdabryanus; toxicity; GPT; GOT; single cell gel electrophoresis(SCGE)
2015-12-28
国家自然科学基金项目(31200923);河南师范大学青年骨干教师科研项目(5101049470610);河南师范大学引进人才科研项目(01046500109)
夏晓华(1982-),女,河南漯河人,副教授,博士,主要从事分子细胞遗传学研究。E-mail:xxhlpf@163.com
*通讯作者:常重杰(1965-),男,河南禹州人,教授,博士,主要从事分子细胞遗传学研究。E-mail:changzhongjie@tom.com
S948
A
1004-3268(2016)07-0122-05

