慢羽系麒麟公鸡纯合个体分子检测方法的建立
李珊珊,李东华,吕福琨,董 晶,李艳青,杜炳旺
(广东海洋大学 动物科学系,广东 湛江524088)
慢羽系麒麟公鸡纯合个体分子检测方法的建立
李珊珊,李东华,吕福琨,董 晶,李艳青,杜炳旺*
(广东海洋大学 动物科学系,广东 湛江524088)
为建立一种快速准确鉴定麒麟公鸡慢羽纯合子的分子检测方法,以加快纯合慢羽系及其配套系的育种速度,利用鸡性连锁羽速基因K/k中慢羽基因K与禽白血病内源性病毒基因ev21的紧密连锁关系,选择241只(直观鉴定171只为表型慢羽,70只为表型快羽)140日龄麒麟公鸡,应用PCR扩增URa和URb基因以鉴定其快、慢羽型,再扩增ev21基因,并采用限制性内切酶HaeⅢ对慢羽鸡扩增产物进行消化,检测基因型为纯合子的慢羽公鸡。麒麟鸡羽速类型检测结果显示,慢羽公鸡(170只)2条带,快羽麒麟公鸡(71只)1条带。慢羽公鸡酶切基因分型结果显示,酶切后有2条带的为ev21缺失个体(72只),有3条带的是杂合个体(94只),有1条带的为纯合个体(5只)。综上,可以利用ev21插入位点鉴定麒麟鸡基因型是否为纯合的慢羽个体。
麒麟鸡; 羽速基因;ev21基因; 纯合子; 配套系
麒麟鸡又称卷毛鸡或卷羽鸡,是广东省茂名市信宜、高州一带的特色优质土鸡[1]。由于该鸡携带不完全显性遗传的卷羽基因F,使其羽钩不能与相邻的羽小枝的背缘相勾连,导致该鸡羽毛向外弯曲形成卷羽。该鸡全身羽毛翻卷使得部分皮肤裸露而散热性能良好,适宜在南方热带地区饲养。为了更好地利用该品种鸡耐高温的特性,育种工作者拟培育出可自别雌雄的快慢羽配套系。常规的传统育种技术,需要培育纯合慢羽系种鸡,对表型慢羽的公鸡通过测交试验确定基因型为纯合的慢羽公鸡,费力耗时,影响育种速度。为此,急需建立一种快速准确鉴别纯合慢羽麒麟鸡的分子检测方法,以鉴定表型慢羽公鸡是否纯合,进而尽快建立基因型为纯合的慢羽系,加快麒麟鸡快慢羽自别雌雄配套系的育种速度。
前人研究发现,影响鸡羽毛生长快慢的基因是性别基因[2],野生型快羽基因k为隐性基因,而显性基因K则延缓雏鸡主翼羽的生长造成慢羽表型。Warren[3]研究发现,鸡的尾羽生长也受到性别基因控制;Bacon等[4]发现,位于慢羽鸡Z染色体的显性基因K与ev21插入片段性连锁遗传,且认为鉴定公鸡慢羽表型的主要依据是慢羽基因K与ev21紧密的连锁关系;Siegel等[5]进一步对慢羽表型的显性基因K与ev21的性连锁关系进行探索发现,慢羽基因K同时可以造成纯合子和杂合子的表型差异,由此可以利用性连锁遗传基因ev21对慢羽鸡进行纯合子和杂合子的鉴别。Smith 等[6]根据慢羽鸡性染色体Z上的ev21和显性基因K的紧密关系,又划分了3个区域,ev21整合部位OR、通过复制产生同源DNA区域的ev21未占据重复片段URa、相对应存在于快羽鸡中非整合DNA区域的未占据重复片段URb,因URb含有酶切位点能被限制性内切酶HaeⅢ切开,但URa没有酶切位点而不能被酶切,因此,可以通过PCR扩增ev21基因、酶切区分URa和URb。由于杂合的慢羽公鸡同时拥有等位基因URa和URb,且Z染色体上(URa)还含有插入片段ev21,因此,也可以通过酶切区别杂合子、纯合子。鉴于此,以表型慢羽麒麟公鸡为研究对象,对位于Z染色体上性连锁遗传基因ev21进行分子检测,鉴定出慢羽公鸡个体,利用酶切位点对慢羽公鸡进行基因分型,挑出纯合个体,剔除杂合子和ev21缺失个体,从而加快慢羽纯系的建立,为今后的选优提纯、配套杂交及开发利用提供理论依据。
1 材料和方法
1.1 供试动物
试验麒麟公鸡表型快、慢羽基础群种鸡由广东海洋大学家禽育种中心提供。
1.2 麒麟鸡羽速类型检测
对1日龄雏鸡进行表型快羽和表型慢羽观察和分群,凡主翼羽长于覆主翼羽的,判定其为快羽鸡,凡主翼羽短于或等于覆主翼羽,判定为慢羽鸡。当该批供试鸡长至140日龄时正式进入试验阶段。
140日龄时,对直观鉴定表型为慢羽的171只公鸡和表型为快羽的70只公鸡进行翅静脉采血。参考文献[7-8]的引物序列, PCR扩增URa(396 bp)和URb(341 bp)的片段,检测出羽速类型。
1.3ev21基因插入位点检测
用DNA试剂盒(成都福际生物技术有限公司)提取基因组DNA。参考韩瑾润[7]的研究,扩增体系:水16.8 μL,10× PCR Buffer 2.5 μL,dNTP Mix 2 μL,TaqDNA polymerase 1 μL,引物up、in、down分别为0.3 μL、0.3 μL、0.6 μL,模板1.5 μL,共25 μL的体系。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min。用1.5%琼脂糖凝胶电泳检测扩增产物。引物信息见表1。

表1 麒麟鸡快慢羽和纯合个体检测引物信息
1.4 慢羽麒麟公鸡基因型检测
参考Iraqi等[8]设计的引物和反应程序进行PCR扩增。20 μL反应体系:引物F和R(表1)分别为0.2 μL,双蒸水8.1 μL,模板1 μL,2×TaqPCR Mix 10.5 μL。取10 μL PCR产物,加入0.8 μL限制性内切酶HaeⅢ、1.2 μL 10×Buffer、8 μL双蒸水,酶切体系过夜消化(7~12 h)。用1.5%的琼脂糖凝胶电泳检测PCR产物和酶切产物。
1.5 酶切产物测序验证
为了更进一步证明使用酶切手段分型的慢羽系纯合麒麟公鸡个体是否正确,又分别将慢羽麒麟公鸡纯合子、杂合子、ev21缺失个体的酶切产物送生工生物工程(上海)股份有限公司进行测序,从而根据酶切位点验证基因型为纯合子的慢羽鸡个体。
2 结果与分析
2.1 麒麟鸡羽速类型的分子鉴定结果
对直观鉴定的241份麒麟鸡进行分子鉴定,表型鉴定171只慢羽公鸡,分子检测结果为170只慢羽公鸡,1.5%琼脂糖电泳检测到2条带型,片段大小分别为396 bp和341 bp;表型鉴定70只快羽公鸡,分子检测结果为71只快羽型麒麟鸡,1.5%琼脂糖凝胶电泳检测结果显示,只有1条带型且片段大小为396 bp(图1)。
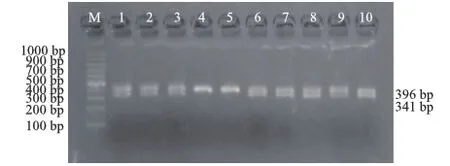
M.DL1000 Marker; 1、2、3、6、7、8、9、10.慢羽型; 4、5.快羽型
2.2 慢羽公鸡分型检测结果
对171只慢羽公鸡进行酶切分型,结果显示,5个纯合个体,94个杂合个体,72个ev21缺失个体。酶切结果出现3条带为杂合子(分别为1 450 bp、1 068 bp和382 bp),只有1条带(1 450 bp)为纯合子,有2条带为ev21缺失个体(1 068 bp和382 bp)(图2)。
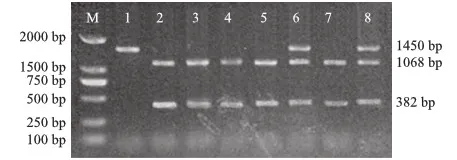
M.DL2000 Marker; 1.纯合个体; 2、3、4、5、7.ev21缺失个体; 6、8.杂合个体
2.3 慢羽公鸡分型测序结果
将部分酶切基因分型为纯合个体、ev21缺失个体、杂合个体的PCR产物进行测序(图3),可以清楚地看到ks1(ev21缺失个体)和ks2(杂合个体)的350—355 bp存在GTGGCC片段,其中GGCC为酶切位点, ks3(纯合个体)在该酶切位点由于突变成GGCT而不能被酶切,并且在中间还插入了8个碱基TAACTAAG的片段,所以纯合个体突变成GGCTAACTAACTAAG。杂合个体的测序峰图从酶切位点以后出现叠加现象,而纯合个体和ev21缺失的峰图单一,证明测序结果与酶切结果相符(图4)。

深色表示序列相同; 浅色代表两者相同序列;…代表ks1(ev21缺失个体)和ks2(杂合个体)缺失序列

图4 麒麟鸡慢羽公鸡酶切测序分析
3 结论与讨论
本试验通过对241只麒麟公鸡进行快慢羽分子检测发现,表型鉴定的171只慢羽公鸡和70只快羽公鸡,分子检测属慢羽公鸡个体有170只,快羽公鸡个体71只,仅有1只表型鉴定为慢羽,而分子鉴定结果为快羽。说明本研究中的分子检测方法可用于麒麟公鸡的选育,且有很高的准确性。
在家禽育种公司建立快慢羽自别雌雄配套系仅仅通过选择慢羽的表型性状是远远不够的,往往不能完全排除慢羽系公鸡中的杂合个体。因此,急需寻找一种鉴定纯合子的分子手段。由于快羽公鸡的性染色体基因型是ZkZk,因而快羽公鸡的表型能直观反映基因型,这也就表明快羽公鸡是纯合个体。但是,慢羽公鸡的性染色体基因型有ZKZK和ZKZk,因而从表型并不能看出其为纯合个体或杂合个体。因此,要想获得纯合的慢羽系公鸡,研究慢羽形成的分子生物学机制极其重要。影响慢羽形成机制的因素较多,有学者研究表明,鸡Z染色体上慢羽基因位点大致在9 607 480—10 607 757 bp处,且9 966 364—10 142 688 bp基因组的复制导致了慢羽表型[9]。可推断快慢羽表型的形成是由于羽速基因型之间的差异表达引起的。Luo等[10]研究结果显示,影响羽毛生长的毛囊角蛋白对慢羽的形成起着关键性的作用,发现慢羽雏鸡的翼羽皮肤细胞中有许多特殊羽毛角蛋白过表达,这可能是造成慢羽表型的又一重要原因。但Kansaku等[11]根据系谱测验估计显性基因K与ev21的连锁距离不超过0.3 cM,并且还推断显性基因K与ev21紧密的连锁距离可能是鉴定慢羽基因K的主要依据。此外,Siegel等[5]发现,通过与慢羽显性基因K性连锁遗传的ev21基因可以分型出慢羽系公鸡纯合和杂合子;李竞一等[12]利用性连锁遗传基因ev21对商品代慢羽公鸡进行检测,剔除ev21缺失个体;李培周等[13]利用与伴性基因性连锁遗传的ev21片段结构对清远麻鸡、贵妃鸡进行基因分型,剔除ev21缺失个体;Elferink等[9]通过实时荧光定量PCR技术也检测出了慢羽公鸡的纯合个体。
本试验通过对部分慢羽麒麟公鸡纯合子和杂合子进行多序列比对分析,可以很明显地看到URa和URb在序列上的差异性,并且找到限制性内切酶的酶切位点。171只慢羽麒麟公鸡中,PCR扩增后酶切结果为1条带的有5个个体,即为纯合子,基因型为ZKZK,测序峰图没有GGCC酶切位点,说明只扩增出URa;72个个体酶切结果有2条带,在理论的酶切位点处有GGCC酶切位点,说明扩增产物只扩增出URb,并未扩增出URa,位于URa内部的ev21结合位点不存在于这些个体基因组中,即为ev21缺失个体;94个个体酶切结果为3条带,说明扩增产物中,URa和URb均被扩增出,URb被内切酶HaeⅢ切为2条带,即为杂合子,这与测序峰图出现叠加相符。
本试验通过位于Z染色体上慢羽显性基因K与性连锁遗传基因ev21的紧密关系,剔除慢羽系麒麟公鸡中杂合子和ev21缺失个体,分型出纯合个体,为建立一种快速且准确鉴别麒麟公鸡慢羽系纯合子的分子检测方法提供了理论依据。
[1] 杜炳旺,陶林,汪忠艳,等.麒麟鸡(卷羽鸡)种质特性研究初报[C]//中国畜牧兽医学会家禽学分会第九次代表会议暨第十六次全国家禽学术讨论会论文集.扬州:[出版者不详],2013:44-47.
[2] Serebrovsky A S.Crossing-over involving three sex-linked genes in chickens[J].The American Naturalist,1922,56(647):571-572.
[3] Warren D C.Inheritance of rate of feathering in poultry[J].Journal of Heredity,1925,16(1):13-18.
[4] Bacon L D,Smith E,Crittenden L B,etal.Association of the slow feathering (K) and an endogenous viral (ev21) gene on the Z chromosome of chickens[J].Poultry Science,1988,67(2):191-197.
[5] Siegel P B,Mueller C D,Craig J V.Some phenotypic differences among homozygous,heterozygous, and hemizygous late feathering chicks[J].Poultry Science,1957,36(2):232-239.
[6] Smith E J,Levin I.Application of a locus-specific DNA hybridization probe in the analysis of the slow-feathering endogenous virus complex of chickens[J].Poultry Science,1991,70(9):1957-1964.
[7] 韩瑾润.影响羽毛发育的生长因子及相关ev21调控的研究[D].北京:中国农业大学,2007.
[8] Iraqi F,Smith E J.Determination of the zygosity ofev21-Kin late-feathering male White Leghorns using the polymerase chain reaction[J].Poultry Science,1994,73(7):939-946.
[9] Elferink M G,Vallée A A,Jungerius A P,etal.Partial duplication of thePRLRandSPEF2 genes at the late feathering locus in chicken[J].BMC Genomics,2008,9(1):391.
[10] Luo C,Shen X,Rao Y,etal.Differences of Z chromosome and genomic expression between early- and late-feathering chickens[J].Molecular Biology Reports,2012,39(5):6283-6288.
[11] Kansaku N,Guemene D,Nakamura A,etal.Sequence characterization ofK-gene linked region in various chicken breeds[J].The Journal of Poultry Science,2011,48(3):181-186.
[12] 李竞一,李荣妮,王晓亮,等.慢羽鸡ev21结合位点缺失个体的检测[J].中国畜牧杂志,2011,47(11):6-8.[13] 李培周,李华,杜炳旺,等.贵妃鸡羽速基因分子检测及相关早熟性状分析[J].中国家禽,2013,35(21):5-8.
Establishment of Molecular Identification Techniques for Frizzle Chicken Early Feathering and Late Feathering
LI Shanshan,LI Donghua,LÜ Fukun,DONG Jing,LI Yanqing,DU Bingwang*
(Department of Animal Science,Guangdong Ocean Univerisity,Zhanjiang 524088,China)
In order to establish a rapid and accurate molecular identification techniques for the frizzle chicken early feathering and late feathering to speed up the formation of complete set line,male Kirin chickens of 241 at 140 days were selected(171 late-feathering phenotypic,70 eaily-feathering phenotypic).The slight distance relation of late-feathering geneKin linkage with feathering geneK/kof chicken and endogenousev21 was used, to discriminate the eaily-feathering and late-feathering cock using PCR amplification ofev21 gene and to detect homozygote of genotype late-feathering cock through the amplified products digestion using the restriction enzyme(HaeⅢ).The results showed that eaily-feathering frizzles had a band(71),late-feathering had two bands(170).Compared with eye identification, the agreement rate was 99.41%.TheHaeⅢ cleaved genotyping results of late-feathering cock showed that the chicken missingev21 had two bands(72),the individuals with three bands were heterozygous(94),and homozygous individuals had a band(5).Therefore,ev21 insertion site could be used for identifying genotype homozygous Kirin male chicken.
Kirin chicken; feathering gene;ev21 gene; homozygote; complete set line
2016-01-16
广东省创新强校重大项目(GDOU2013050222)
李珊珊(1990-),女,河南郑州人,在读硕士研究生,研究方向:优质鸡育种。E-mail:1207033094@qq.com
*通讯作者:杜炳旺(1954-),男,山西运城人,教授,主要从事优质鸡遗传育种工作。E-mail:dudu903@163.com
S831
A
1004-3268(2016)07-0118-04

