c-Met激酶抑制剂LY28对PC-3、NCI-H441、MDA-MB-231细胞和PC-3移植瘤的抑制作用
王莹,井维娜,程捷,任刚,王敬章,刘玉刚
(1河北工程大学医学院,河北邯郸056002;2河北工程大学附属医院)
c-Met激酶抑制剂LY28对PC-3、NCI-H441、MDA-MB-231细胞和PC-3移植瘤的抑制作用
王莹1,井维娜2,程捷2,任刚2,王敬章1,刘玉刚2
(1河北工程大学医学院,河北邯郸056002;2河北工程大学附属医院)
目的 观察肝细胞生长因子受体(c-Met)酪氨酸激酶抑制剂LY28的抗肿瘤作用,并探讨其机制。方法 ①取对数生长期人前列腺癌PC-3细胞、人肺癌NCI-H441细胞及人乳腺癌MDA-MB-231细胞接种于96孔板,培养24 h后分为1个对照组和14个实验组。对照组用0.04% DMSO的培养基培养,实验组分别用0.1、1、10、20、40、80、100 μmol/L的LY28、克唑替尼培养,每组3个复孔。各组细胞置于培养箱中孵育72 h后弃培养基,每孔加入0.5 mg/mL的MTT溶液100 μL。培养箱中孵育4 h,在酶标仪570 nm波长处检测各孔光密度(OD)值。计算细胞增殖抑制率,采用Graphpad Prism5软件计算LY28、克唑替尼抑制肿瘤细胞增殖的IC50值。② 制作PC-3细胞移植瘤裸鼠模型。挑选模型裸鼠40只,随机分为模型组和给药组(包括LY28 10 mg/kg组、LY28 20 mg/kg组、LY28 40 mg/kg组及克唑替尼组),每组8只。给药组分组当天即开始每天单次灌胃给予10 mg/kg的LY28、20 mg/kg的LY28、40 mg/kg的LY28、40 mg/kg的克唑替尼,周期21 d。模型组给予等量生理盐水。末次给药结束后处死裸鼠,剥离肿瘤组织。称瘤重并计算抑瘤率。采用Western blotting法检测肿瘤组织中的Met、p-Met、Akt、p-Akt、ERK1/2及p- ERK1/2。结果 LY28对PC-3、MDA-MB-231、NCI-H441细胞的IC50分别为(10.154±1.209)、(18.946±2.457)、(29.868±3.493)μmol/L,克唑替尼对PC-3、MDA-MB-231、NCI-H441细胞的IC50分别为(19.105±2.970)、(39.818±5.694)、(34.982±4.977)μmol/L。LY28对PC-3、MDA-MB-231、NCI-H441细胞的IC50均低于克唑替尼(P均<0.05)。LY28 10 mg/kg组、LY28 20 mg/kg组、LY28 40 mg/kg组、克唑替尼组抑瘤率分别为38.38%、67.17%、80.30%、77.27%。与模型组比较,LY28 10 mg/kg组、LY28 20 mg/kg组、LY28 40 mg/kg组及克唑替尼组p-MET及其下游信号p-Akt、p-ERK1/2水平降低(P均<0.05),且LY28 40 mg/kg组 肝细胞生长因子受体酪氨酸激酶抑制剂;克唑替尼;前列腺癌;肺癌;乳腺癌;半数抑制浓度;肝细胞生长因子受体;蛋白激酶B;细胞外调节蛋白激酶 肝细胞生长因子受体(c-Met)是原癌基因c-Met编码的蛋白,属于肝细胞生长因子(HGF)特异性细胞膜受体[1]。生理情况下,HGF/c-Met信号通路在胚胎器官发育形成及肝脏等器官的再生和损伤修复中发挥重要作用[2,3]。当HGF/c-Met信号通路异常激活时,可导致c-Met的持续激活与磷酸化,从而持续激活下游信号通路,导致细胞异常增殖,诱导正常细胞发生癌变[4~6]。针对c-Met信号通路的药物主要包括单克隆抗体和小分子激酶抑制剂。目前已有2个以c-Met为靶点的小分子靶向药物克唑替尼和卡博替尼上市。克唑替尼是一种ATP竞争性c-Met及间变性淋巴瘤激酶(ALK)双重抑制剂,用于治疗ALK阳性的局部晚期或转移的非小细胞肺癌[7,8]。邯郸市隆仁堂医药研究院以克唑替尼为母核进行结构改造,设计合成出c-Met酪氨酸激酶抑制剂LY28。前期研究[5]发现,LY28在体外对c-Met激酶的IC50值为7 nmol/L,对人胃癌MKN-45、人神经胶质瘤U87MG、人肾癌Caki-1、人前列腺癌PC-3细胞株的增殖及人恶性胶质母细胞瘤U87MG裸鼠移植瘤均具有显著抑制作用。本研究比较了LY28、克唑替尼对体外培养的人前列腺癌细胞株PC-3、人乳腺癌细胞株MDA-MB-231、人肺癌细胞株NCI-H441增殖的影响,比较了不同浓度LY28灌胃的荷前列腺癌PC-3细胞移植瘤裸鼠的抑瘤率及肿瘤组织Met、磷酸化Met(p-Met)、蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、细胞外调节蛋白激酶(ERK1/2)、磷酸化ERK1/2(p-ERK1/2)蛋白表达,旨在观察LY28的体内外抗肿瘤作用并探讨其机制。现报告如下。 1.1 实验动物、细胞及主要材料 BALB/c裸鼠(SPF级)购于北京维通利华实验动物技术有限公司。人前列腺癌细胞株PC-3、人乳腺癌细胞株MDA-MB-231购自中科院细胞库;人肺癌细胞株NCI-H441购自ATCC细胞库。LY28和阳性对照药克唑替尼均由邯郸市隆仁堂医药有限公司提供。F12K培养基、L15培养基、RPMI1640培养基、胎牛血清及胰蛋白酶均为Gibco公司产品。Met、p-Met、Akt、p-Akt、ERK1/2、p-ERK1/2、β-actin抗体购自Cell Signaling Technology公司,辣根过氧化物酶标记的山羊抗小鼠IgG抗体购自碧云天公司。 1.2 不同浓度LY28、克唑替尼对PC-3、MDA-MB-231、NCI-H441细胞的增殖抑制率测算 PC-3细胞培养于含10%胎牛血清的F12K培养基中,MDA-MB-231细胞培养于含10%胎牛血清的L15培养基中,NCI-H441细胞培养于含10%胎牛血清的RPMI1640培养基中。各细胞株均置于37 ℃、5% CO2培养箱中培养。细胞每3~4 d以1∶4传代。取对数生长期细胞,用0.25%胰蛋白酶消化后配成单细胞悬液,调整细胞密度至3×104/mL接种于96孔板,每孔100 μL,培养24 h后分为1个对照组和14个实验组。对照组用0.04% DMSO的培养基培养,实验组分别用0.1、1、10、20、40、80、100 μmol/L的LY28、克唑替尼培养,每组3个复孔。各组细胞置于培养箱中孵育72 h后弃培养基,每孔加入0.5 mg/mL的MTT溶液100 μL。培养箱中孵育4 h,弃去溶液,每孔加入200 μL的DMSO溶解甲臜,微量振荡器振荡使结晶完全溶解,在酶标仪570 nm波长处检测各孔光密度(OD)值。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。采用Graphpad Prism5软件计算LY28抑制肿瘤细胞增殖的IC50值。 1.3 不同浓度LY28灌胃的荷前列腺癌PC-3细胞移植瘤裸鼠抑瘤率测算及肿瘤组织Met、p-Met、Akt、p-Akt、ERK1/2、p-ERK1/2蛋白表达检测 在50只6周龄裸鼠于皮下接种PC-3细胞,每只接种5×106个细胞。接种后10 d左右采用数显游标卡尺测量肿瘤体积。肿瘤体积(V)=1/2×长×宽2。挑选肿瘤体积在100~200 mm3的裸鼠40只,随机分为模型组和给药组(包括LY28 10 mg/kg组、LY28 20 mg/kg组、LY28 40 mg/kg组及克唑替尼组),每组8只。给药组分组当天即开始每天单次灌胃给予10 mg/kg的LY28、20 mg/kg的LY28、40 mg/kg的LY28、40 mg/kg的克唑替尼,给药体积为0.1 mL/10 g,周期21 d。模型组给予等量生理盐水。每3 d称体重并测算肿瘤体积,绘制肿瘤生长曲线。末次给药结束后处死裸鼠,剥离肿瘤组织。①称瘤重并计算抑瘤率。抑瘤率(%)=(1-给药组平均瘤重/模型组平均瘤重)×100%。②采用Western blotting法检测肿瘤组织中的Met、p-Met、Akt、p-Akt、ERK1/2及p- ERK1/2。肿瘤组织剪碎置于液氮中研磨,研磨后的粉末加入蛋白裂解液提取总蛋白,蛋白定量,沸水变性后分装,-80 ℃保存。10%SDS-PAGE胶电泳,电泳结束后进行转膜,时间60 min。用含5%脱脂奶粉的TBST在室温下封闭1 h。一抗4 ℃孵育过夜(稀释比例为1∶1 000)。TBST漂洗3次,10 min /次。二抗室温孵育1 h(稀释比例均为1∶10 000)。TBST漂洗3次,10 min /次。加入超敏发光液,反应1~2 min,置于Bio-Rad凝胶成像系统中成像。采用Quantity One软件进行灰密度扫描,以目的蛋白条带灰密度值与内参照β-actin条带灰度值的比值表示目的蛋白相对表达量。 2 结果 2.1 不同浓度LY28、克唑替尼对PC-3、MDA-MB-231、NCI-H441细胞的增殖抑制率比较 不同浓度LY28、克唑替尼对PC-3、MDA-MB-231、NCI-H441细胞的增殖抑制率见表1。LY28对PC-3、MDA-MB-231、NCI-H441细胞的IC50分别为(10.154±1.209)、(18.946±2.457)、(29.868±3.493)μmol/L,克唑替尼对PC-3、MDA-MB-231、NCI-H441细胞的IC50分别为(19.105±2.970)、(39.818±5.694)、(34.982±4.977)μmol/L。LY28对PC-3、MDA-MB-231、NCI-H441细胞的IC50均低于克唑替尼(P均<0.05)。 2.2 各组裸鼠抑瘤率及肿瘤组织Met、p-Met、Akt、p-Akt、ERK1/2、p-ERK1/2蛋白表达比较 实验过程中无裸鼠死亡,无体质量明显减轻。LY2 810 mg/kg组、LY2 820 mg/kg组、LY2 840 mg/kg组、克唑替尼组抑瘤率分别为38.38%、67.17%、80.30%、77.27%,提示LY28的抑瘤作用具有明显的剂量依赖性。各组裸鼠肿瘤组织Met、p-Met、Akt、p-Akt、ERK1/2、p-ERK1/2蛋白表达见表2。由表2可见,与模型组比较,LY2 810 mg/kg组、LY2 820 mg/kg组、LY28 40 mg/kg组及克唑替尼组p-MET及其下游信号p-Akt、p-ERK1/2水平降低(P<0.05),且LY28 40 mg/kg组 表1 不同浓度LY28、克唑替尼对PC-3、MDA-MB-231、NCI-H441细胞的增殖抑制率 表2 各组裸鼠肿瘤组织Met、p-Met、Akt、p-Akt、ERK1/2、p-ERK1/2蛋白表达比较 注:与模型组比较,*P<0.05。 我们自主研发的LY28即为ATP竞争性的小分子c-Met抑制剂。前期研究表明,LY28对c-Met激酶的IC50值为7 nmol/L。人前列腺癌PC-3细胞、人肺癌NCI-H441细胞及人乳腺癌MDA-MB-231细胞均为c-Met高表达细胞株。本研究结果显示,LY28能显著抑制PC-3、MDA-MB-231、NCI-H441的生长,IC50值分别为(10.154±1.209)μmol/L、(18.946±2.457)μmol/L和(29.868±3.493)μmol/L。LY28对上述三种细胞的IC50均低于克唑替尼(P均<0.05),显示出强大的抑制细胞增殖作用。 本研究结果显示,LY28 10 mg/kg组、LY28 20 mg/kg组、LY28 40 mg/kg组、克唑替尼组抑瘤率分别为38.38%、67.17%、80.30%、77.27%,提示LY28的抑瘤作用具有明显的剂量依赖性。40 mg/kg LY28 的抑瘤率达到了80.30%,高于等剂量的克唑替尼。实验中荷瘤鼠对LY28能够较好的耐受,没有体质量减轻等症状发生。本研究结果中克唑替尼的的体内外抗肿瘤作用实验数据与文献报道相近[15],证实了实验方法合理、结果可信。c-Met激活后的信号可通过Ras-Raf-Mek-ERK/MAPK通路介导细胞的增殖,同时也可通过PDK-Akt-mTOR通路介导细胞的存活[16, 17]。本研究结果显示,与模型组比较,LY28 10 mg/kg组、LY28 20 mg/kg组、LY28 40 mg/kg组及克唑替尼组p-Met及其下游信号p-Akt、p-ERK1/2水平降低,提示LY28和克唑替尼可以抑制Met及其下游信号Akt、ERK1/2的磷酸化;p-MET及其下游信号p-Akt、p-ERK1/2水平LY28 40 mg/kg组 活化的c-Met通路可以通过多种机制引起肿瘤的增殖和转移:诱导诱导多种底物蛋白的磷酸化[9];影响肿瘤细胞间的黏附,破坏细胞骨架的连接,造成肿瘤细胞侵袭转移[10];刺激内皮细胞增殖、迁移、形成血管样结构,诱导肿瘤血管生成[11]。在c-Met通路激活并诱导肿瘤发生发展的过程中,ATP介导的 c-Met磷酸化是重要的一个环节[12~14]。当HGF与c-Met结合后,由于ATP的存在, c-Met靠近胞内区的酪氨酸残基Y1234, Y1235发生自身磷酸化,同时c末端的位点Y1349、Y1356发生磷酸化,为信号分子提供结合位点。募集下游的接头蛋白1、接头蛋白2、SH2包含蛋白等衔接蛋白,接着通过一系列的磷酸化反应活化Akt、ERK1/2及磷脂酰肌醇-3激酶、磷酸脂酶C-γ、蛋白酪氨酸磷酸酶、信号传导与转录激活因子等重要的信号分子及相应的信号通路,调节肿瘤细胞的增殖、迁移和侵袭。因此,我们推测LY28可能通过阻断ATP介导的 c-Met磷酸化,可以有效抑制c-Met通路的激活,从而发挥其抗肿瘤作用。 [1] Naldini L, Vigna E, Narsimhan RP, et al. Hepatocyte growth factor (HGF) stimulates the tyrosine kinase activity of the receptor encoded by the proto-oncogene c-MET [J]. Oncogene, 1991,6(4): 501-504. [2] Liu X, Newton RC, Scherle PA. Developing c-MET pathway inhibitors for cancer therapy: progress and challenges [J]. Trends Mol Med, 2010,16(1):37-45. [3] Lu Y, Yao HP, Wang MH. Multiple variants of the RON receptor tyrosine kinase: biochemical properties, tumorigenic activities, and potential drug targets [J]. Cancer Lett, 2007,257(2):157-164. [4] Goyal L, Muzumdar MD, Zhu AX. Targeting the HGF/c-MET pathway in hepatocellular carcinoma [J]. Clin Cancer Res, 2013,19(9): 2310-2318. [5] Trovato M, Torre ML, Ragonese M, et al. HGF/c-met system targeting PI3K/AKT and STAT3/phosphorylated-STAT3 pathways in pituitary adenomas: an immunohistochemical characterization in view of targeted therapies [J]. Endocrine, 2013,44(3):735-743. [6] Engelman JA, Zejnullahu K, Mitsudomi T, et al. MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling [J]. Science, 2007,316(5827):1039-1043. [7] Cui JJ, Tran-Dube M, Shen H, et al. Structure Based drug design of crizotinib (PF-02341066), a potent and selective dual inhibitor of mesenchymal-epithelial transition factor (c-MET) kinase and anaplastic lymphoma kinase (ALK) [J]. J Med Chem, 2011,54(18):6342-6363. [8] Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer [J]. N Engl J Med, 2014, 371(23):2167-2177. [9] Mizuno S, Nakamura T. HGF-MET cascade, a key target for inhibiting cancer metastasis: the impact of NK4 discovery on cancer biology and therapeutics [J]. Int J Mol Sci, 2013,14(1):888-919. [10] Murai M, Shen X, Huang L, et al. Overexpression of c-met in oral SCC promotes hepatocyte growth factor-induced disruption of cadherin junctions and invasion [J]. Int J Oncol, 2004,25(4):831-840. [11] Zhang YW, Su Y, Volpert OV, et al. Hepatocyte growth factor/scatter factor mediates angiogenesis through positive VEGF and negative thrombospondin 1 regulation[J]. Proc Natl Acad Sci USA, 2003,100(22):12718-12723. [12] Hanna JA, Bordeaux J, Rimm DL, et al. The function, proteolytic processing, and histopathology of Met in cancer [J]. Adv Cancer Res, 2009,10(3):1-23. [13] Trusolino L, Bertotti A, Comoglio PM. MET signalling: principles and functions in development, organ regeneration and cancer [J]. Nat Rev Mol Cell Biol, 2010,11(12):834-848. [14] Gherardi E, Birchmeier W, Birchmeier C, et al. Targeting MET in cancer: rationale and progress [J]. Nat Rev Cancer, 2012,12(2):89-103. [15] Zou HY, Li Q, Lee JH, et al. An Orally Available Small-Molecule Inhibitor of c-Met, PF-2341066, Exhibits Cytoreductive Antitumor Efficacy through Antiproliferative and Antiangiogenic Mechanisms [J]. Cancer Res, 2007,67(9):4408-4417. [16] Furge KA, Zhang YW, Vande Woude GF. Met receptor tyrosine kinase: enhanced signaling through adapter proteins [J]. Oncogene, 2000,19(49):5582-5589. [17] Johnson GL, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases [J]. Science, 2002,298(5600):1911-1912. [18] Nijman SM, Friend SH. Cancer. Potential of the synthetic lethality principle [J]. Science, 2013,342(6160):809-811. [19] Robinson KW, Sandler AB. The role of MET receptor tyrosine kinase in non-small cell lung cancer and clinical development of targeted anti-MET agents [J]. Oncologist, 2013,18(2):115-122. [20] Lee JC, Jang SH, Lee KY, et al. Treatment of Non-small Cell Lung Carcinoma after Failure of Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitor [J]. Cancer Res Treat, 2013,45(2):79-85. 邯郸市科学技术研究与发展计划项目(1423108064-7)。 刘玉刚(E-mail: liuyugang1983@yeah.net) 10.3969/j.issn.1002-266X.2016.47.013 R965.1 B 1002-266X(2016)47-0044-04 2016-08-12)1 材料与方法
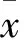


3 讨论

