精氨酸双糖苷对脂多糖诱导的巨噬细胞分泌炎症因子的影响
高铭彤,王佳奇,陈凯,李莹,李婧毓,刘一桐,丁传波,刘文丛,郑毅男
(1. 吉林农业大学 中药材学院,长春 130118)
精氨酸双糖苷对脂多糖诱导的巨噬细胞分泌炎症因子的影响
高铭彤,王佳奇,陈凯,李莹,李婧毓,刘一桐,丁传波,刘文丛*,郑毅男*
(1. 吉林农业大学 中药材学院,长春 130118)
为研究精氨酸双糖苷(AFG)体外的抗炎机制,以脂多糖(LPS)刺激小鼠单核巨噬细胞(RAW264.7)作为炎症模型,用精氨酸双糖苷(AFG)的低、中、高(5、10、20 mg/L)三个剂量进行干预后,MTT法测定细胞毒性作用,Griess法测定一氧化氮(NO)生成量,ELISA法检测细胞上清液中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及前列腺素E2(PGE2)的分泌量。结果表明:AFG的三个不同剂量对RAW264.7细胞无抑制作用(P>0.05),各浓度给药组的NO、IL-1β、IL-6、TNF-α和PGE2含量与LPS刺激模型组相比较都显著降低(P<0.01),推想AFG的抗炎活性可能是通过抑制NO和PGE2等炎症介质释放,降低IL-1β、IL-6和TNF-α等炎症因子的含量而发挥了作用。
精氨酸双糖苷;小鼠RAW264.7细胞;抗炎活性;炎症因子
精氨酸双糖苷(Arginyl-Fructosyl-Glucose,AFG)是鲜人参在加工成红参时,麦芽糖和精氨酸在加热的过程中,发生梅拉德反应形成的一种葡糖胺重排的中间产物[1]。郑毅男等[2-3]首次发现并鉴定了其结构为1′-(精氨酸-N2基)-1′-去氧-4′-O(α-D-吡喃葡萄糖基)-D-果糖[4]。现代药理研究表明,AFG的药理活性强,具有抗肿瘤[5]、抗氧化[6]、对微循环[7]、免疫调节[8]等作用,但对抗菌抗炎的作用少有研究。NO、IL-1β、IL-6、TNF-α和PGE2等[9-10],都是巨噬细胞经过刺激后产生的炎症因子,而这些炎症因子的抑制作用通常作为衡量药物抗炎活性的重要指标[11]。因此,本实验拟通过脂多糖(LPS)刺激小鼠RAW264.7单核巨噬细胞作为模型,观察不同浓度的AFG在体外对炎性细胞因子NO,IL-1β,IL-6,TNF-α和PGE2合成和分泌的影响,从而研究精氨酸双糖苷在体外的抗炎作用。
1 材料
1.1 细胞株来源 小鼠的RAW264.7单核巨噬细胞,购于中国科学院上海生命科学研究院细胞库
1.2 药品及试剂 精氨酸双糖苷AFG,实验室自制,纯度大于90%,临用时用纯净水配置成高、中、低剂量所需浓度;一氧化氮(NO)测定试剂盒,购于南京建成生物工程研究所;白细胞介素-1β(IL-1β)酶联免疫分析试剂盒、白细胞介素-6(IL-6)酶联免疫分析试剂盒、肿瘤坏死因子-α(TNF-α)酶联免疫分析试剂盒和前列腺E2(PGE2)酶联免疫分析试剂盒,批号:201511,均购于美国R&D公司;小牛血清(FBS),购于Hyclone公司;脂多糖(LPS),购于Sigma公司;二甲基噻唑(MTT),购于Amresco公司;二甲基亚砜(DMSO),购于Sigma公司;地塞米松(DMX),购于Sigma公司;青链双抗,购于Gibco公司;蒸馏水,实验室自制。
1.3 主要仪器 TGL-20B高速台式离心机,上海安亭科学仪器厂;微量振荡器,江苏省金坛市宏华仪器厂;-70℃温冰箱,Haier;CO2培养箱,Forma Scientific公司,美国;倒置显微镜,Olympus公司,日本;电子天平,梅特勒-托利多仪器有限公司,上海;SW-CJ-1F超净工作台,苏州净化设备厂;MK3酶标仪,Thermo Electron公司,美国;电热恒温水浴锅,金坛市医疗仪器厂;移液枪,Thermo;48孔细胞板,COSTER;LC-20AT Shimadzus HPLC,检测器SPD-20A,日本岛津公司;FD-1D-50型真空冷冻干燥机,北京博医康实验仪器有限公司。
2 方法
2.1 AFG制备 取L-精氨酸1 g,麦芽糖2 g,柠檬酸0.75 g,溶于10 mL丙三醇中,摇匀,于80 ℃水浴条件下反应120 min,得AFG总合成物,上样于高效阳离子柱,1.5%氨水洗脱,部分接收器接样,分批处理后,样品通过HPLC测得纯度,真空冷冻干燥机冻干为白色粉末。将粉末分别配置成5、10和20 mg/L三个浓度,备用。
2.2 细胞培养 使用RPMI1640培养液50 mL培养小鼠巨噬细胞系RAW264.7,在5% CO2培养箱中37 ℃恒温培养。2.3 给药分组 空白对照组:不加药物干预也不加脂多糖刺激;LPS模型组:不加药物干预只加10 μg/L的LPS处理,建立炎症模型;阳性对照组:加地塞米松DMX0.5 μg/L干预后2 h加10 μg/L的LPS刺激;给药组:加入不同浓度(5、10、20 mg/L)的AFG进行干预后2 h加10 μg/L的LPS刺激。
2.4 检测方法
2.4.1 对RAW264.7细胞存活率影响 取对数生长期的细胞,用0.25%胰蛋白酶消化,制成1×105/mL单细胞悬液,以每孔100 μL点在48孔板内,置于37 ℃,5% CO2培养箱中培养24 h后加入不同浓度(5、10、20 mg/L)的AFG预处理2 h后,加入10 μg/L的LPS刺激细胞继续培养24 h,在终止细胞培养前4 h,将上述各处理组的各孔细胞中加入20 μL,5 mg/L的MTT,37 ℃继续孵育。终止细胞培养后,每孔加入150 μL的DMSO,振荡,直至细胞内结晶完全溶解,530 nm波长下用酶标仪测定各孔吸光度值(OD值)。
2.4.2 对LPS诱导的RAW264.7细胞NO的检测将调整好的1×105/mL单细胞悬液,在48孔板中每孔均匀点100 μL,根据2.3所述的过程进行分组处理后,37 ℃,5% CO2培养箱中继续培养24 h,吸取上清液,按照NO测定试剂盒(Griess法)说明书测定细胞培养液中NO含量。
2.4.3 对LPS诱导的RAW264.7细胞IL-1β、IL-6、TNF-α及PGE2的检测 取对数生长期细胞,使细胞悬液浓度为1×105/mL每孔100 μL均匀点于48孔板内,与2.4.2操作相同,根据2.3所述的过程进行分组处理后,37 ℃,5% CO2继续细胞培养24 h后取上清液,按照ELISA试剂盒说明书上的方法分别检测IL-1β、IL-6、TNF-α及PGE2的分泌量。

3 结果
3.1 对RAW264.7细胞存活率影响 MTT结果(图1)显示,AFG的三个浓度干预细胞24 h后,AFG的三个剂量均与空白对照组相比差异均无统计学意义(P>0.05),说明AFG对细胞的活性没有显著影响。

图1 AFG三个浓度对RAW264.7细胞活性的影响

与空白组相比##P<0.01;与模型组相比**P<0.01图2 AFG三个剂量对LPS诱导小鼠细胞NO的生成情况
3.2 NO检测 NO生成的影响结果见图2,模型组与空白对照组相比NO的生成量显著增加,差异
具有统计学意义(P<0.01)。不同剂量的AFG处理组与模型组比较,NO的生成量显著减少,差异均具有统计学意义(P<0.01),AFG低、中、高三个剂量与模型组相比,NO含量逐渐降低,其低、中、高三个剂量的抑制率分别为22.2%、30.3%和50.6%。3.3 IL-1β、IL-6的检测 结果见表1。
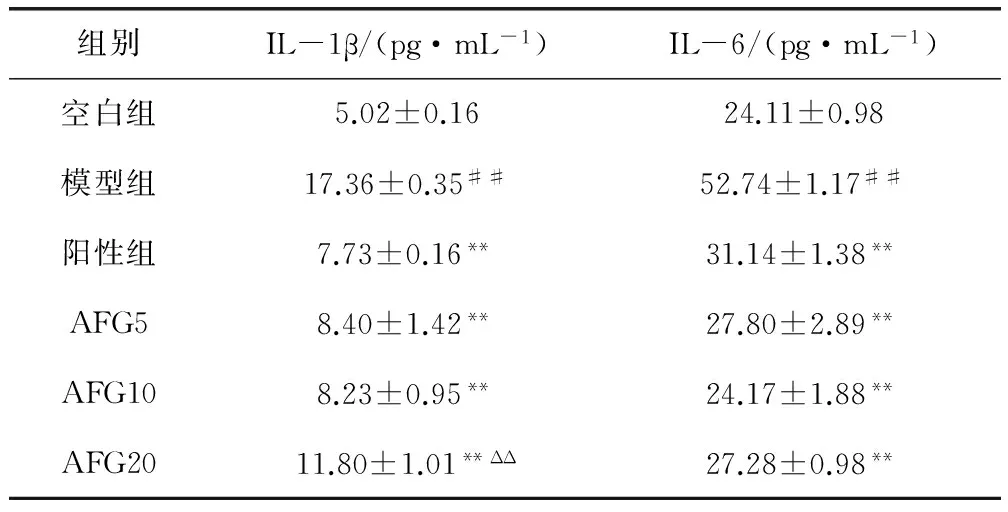
表1 AFG三个剂量对LPS诱导小鼠细胞IL-1β、IL-6的生成情况
与空白组相比##P<0.01;与模型组相比**P<0.01;与阳性组相比ΔP<0.05,ΔΔP<0.01
结果显示,模型组与空白对照组相比,IL-1β和IL-6都有显著增加(P<0.01),而经AFG处理后的IL-1β和IL-6的分泌量与模型组相比都显著降低(P<0.01),其中,经AFG的低剂量和中剂量处理后的IL-1β分泌量与阳性对照组相比差异无统计学意义(P>0.05);AFG的高剂量处理后的IL-1β分泌量与阳性对照组相比差异具有统计学意义(P<0.01)。3.4 TNF-α、PGE2的检测 TNF-α和PGE2的生成情况见表2。模型对照组与空白组比较,TNF-α和PGE2的生成均显著增加(P<0.01),AFG给药组三个剂量与模型组比较,TNF-α和PGE2的生成均显著性降低(P<0.01)。其中,在TNF-α的生成量中,AFG的低、中、高三个剂量成逐渐降低趋势,AFG的20 mg/L剂量最有效。经AFG的中剂量和高剂量处理后的PGE2分泌量比AFG低剂量组分泌量低,与阳性对照组无明显差异(P>0.05)。

表2 AFG三个剂量对LPS诱导小鼠细胞NF-α、PGE2的生成情况
与空白组相比##P<0.01;与模型组相比**P<0.01;与阳性组相比ΔΔP<0.01
4 讨论
NO具有促进炎症形成和抗炎的双重特性,既抑制淋巴细胞增殖,又促发包括类风湿关节炎在内的许多免疫反应及免疫病理过程[12]。有研究表明,过多的产生NO是有害的,会导致各种炎症和自发免疫性疾病[13]。本研究通过细胞培养液中NO的含量检测发现,LPS模型组的NO分泌量比空白组明显升高,而AFG的三个剂量组的NO分泌量与LPS模型组比较均显著降低,并且随着药物浓度的升高,分泌量水平呈逐步降低趋势,呈剂量依赖性关系,因此我们可推想AFG 的抗炎作用应该与其抑制NO的合成有关系。
IL-1β和IL-6都是由活化的单核-巨噬细胞产生,是一种具有调节作用的促炎症因子,可因TNF-α诱导后产生,也可由LPS刺激直接产生,是LPS诱导发热的主要内在介质,是炎症反应的主要诱导者[14]。IL-6可通过自身分泌的形式作用在软骨细胞,用来促进软骨细胞的增殖[15]。通过LPS诱导小鼠RAW264.7细胞分泌出大量炎症因子,与空白对照组有明显差异,则代表建造炎症模型成功,对试验中细胞上清液的IL-1β和IL-6含量检测发现,AFG三个剂量组的分泌量与LPS模型组比较均有显著降低,由此得出抑制IL-1β和IL-6的释放水平,对于缓解炎症效果、控制炎症进程具有重要意义。
TNF-α主要由巨噬细胞产生,也可由LPS是诱导后,T细胞和NK细胞在某些刺激因子作用下分泌产生,是炎症反应进程中起到最为关键的作用,是介导炎症反应、细胞和肿瘤免疫等病理和生理过程中一种重要的细胞因子,生物学活性广泛[16]。本研究中给药组干预后的炎症因子分泌量与模型组比较均有显著降低,且分泌量随给药浓度逐渐变大而成递减趋势,呈剂量依赖性关系。结果表明AFG可以通过对抑制炎症细胞因子的释放起到抗炎的作用。
PGE2是一种重要的细胞生长和调节因子,是花生四烯酸环氧合酶代谢产物,是前列腺素(PG)的一种,具有免疫抑制和抗炎作用[17]。本研究显示:AFG三个剂量均明显抑制了通过用LPS诱导的小鼠RAW264.7单核巨噬细胞后分泌的PGE2,且AFG10 mg/L处理组抑制最明显。因此可推想AFG的抗炎作用大概与其抑制PGE2的合成相关。
人参是滋补身体的要药,在医疗保健上常被人们称为“长生不老药”[18-19]。AFG属于氨基酸衍生物一种,是人参中一种主要成分,人参中还包括人参皂苷、人参多糖、多肽和多糖等其他成分,近几年人们对AFG 的研究逐渐增加,发现AFG有很强的药理活性,既往研究发现:AFG有抗氧化、抗肿瘤和促进微循环等药理活性;本研究结果表明:AFG还有抗炎症因子的生物活性。
本研究通过LPS刺激小鼠RAW264.7单核巨噬细胞作为模型,体外检测通过药物AFG进行干预后的细胞毒性和炎症因子的分泌情况,结果显示,经过AFG干预后的炎症因子(NO、IL-1β、IL-6、TNF-α和PGE2)分泌量与模型组相比较有显著降低(P<0.01),且AFG的低、中、高三个剂量对细胞均无毒副作用,但AFG的体外抗炎机制还有待进一步研究。
[1] Teng R, Ang C, McManus D,etal. Regiose lective acylation of ginsenosides by Novozyme 435[J]. Tetrahedron Lett, 2003, 44: 5661-5664.
[2] Zheng Y N. Studies on bioactive substances in Panax ginseng[J]. Ehime Medicine, 1994, 13(2):1-7.
[3] Mutsuura Y, Zheng Y N, Okud H,etal. Isolation physiological activities of a new amino acid derivative from Korean Red Ginseng[J].Korean J Ginseng Sciences,1994,18(3):204-211.
[4] 曹国军, 许传莲, 郑毅男. 红参加工与精氨酸双糖苷的形成[J]. 中药材, 2003, 26(2): 97-98.
[5] Iwasaki Hirotake, Zhou Yanyang, Iwahashi Hiroyasu,etal. Maltulosyl arginine and fructosyl arginine as anti-inflammatory drugs, anti-aging agents, nitrogen monoxide production stimulators, and skin cosmetics[P]. Iwasaki, JP 2008-263461.
[6] Jung-Sook Lee, Gyo-nam Kim, Sang-Hyun Lee,etal.Invitroand cellular antioxidant activity of arginyl-fructose and arginyl-fructosyl-glucose[J]. Food Sci Biotechnol, 2009, 18(6): 1505-1510.
[7] 郑毅男, 张晶, 奥田拓道, 等. 精氨酸衍生物对微循环的作用[J]. 吉林农业大学学报, 1998, 20(4): 45-47.
[8] 邵莹, 孙荣花, 王迪, 等. 精氨酸双糖苷对环磷酰胺致免疫抑制小鼠免疫功能的影响[J]. 营养学报, 2015, 37(3): 265-269.
[9] Kim M M and Kim S K. Effect of phloroglucinol on oxidative stress and inflammation[J]. Food Chem Toxicology, 2010, 48(10): 2925-2933.
[10]Kim S, Jung E, Kim J H,etal. Inhibitory effects of (-)-alpha-bisabolol on LPS-induced inflammatory response in RAW264.7 macrophages[J]. Food Chem Toxical, 2011, 49(10): 2580-2585.
[11]Zhao L, Zhang S L, Tao J Y,etal. Preliminary exploration on anti-inflammatory mechanism of Corilagin (beta-1-O-galloyl-3,6-(R)-hexahydroxydiphenoyl-D-glucose)invitro[J]. Int Immunopharmacol, 2008, 8(7): 1059.
[12]任杰, 杨泽华, 郑圣顕, 等. α-亚麻酸的体外抗炎作用机制研究[J]. 云南大学学报, 2009, 31(S1): 419-426.
[13]Southan G J, Szabo C. Selective pharmacological inhibition of distinct nitric oxide synthase isoforms[J]. Biochem Pharmacol, 1996, 51(4): 383-394.
[14]王福生, 吴祖泽. 白细胞介素-6(IL-6)研究进展[J]. 国外医学(免疫学分册),1990,4: 169-173.
[15]李忆农. 细胞因子与关节炎[J].中华风湿病杂志, 2000, 4(1): 56-58.
[16]丘创华, 侯敢, 黄迪南. TNF-α信号传导通路的分子机理[J]. 中国生物化学与分子生物学报, 2007, 23(6): 430-435.
[17]毕文岩. 人参皂苷Rh2衍生物的体外抗炎作用及分子机制研究[D]. 吉林大学硕士学位论文,2012.
[18]窦德强, 任杰, 陈颖, 等. 商品人参根的化学成分研究[J]. 中国中药杂志, 2003, 28(6): 522-524.
[19]张萍, 张南平, 肖新月, 等. 人参皂苷类成分的化学分析[J]. 药物分析杂志, 2004, 24(3): 229-237.
(编辑:李文平)
Effects of Arginyl-Fructosyl-Glucose on the Secretion of Inflammatory Cytokines in Macrophages Induced by Lipopolysaccharide
GAO Ming-tong, WANG Jia-qi, CHEN Kai, LI Ying, LI Jing-yu, LIU Yi-tong,DING Chuan-bo, LIU Wen-cong*, ZHENG Yi-nan*
(1.CollegeofChineseMedicinalMaterials,JilinAgriculturalUniversity,Changchun130118,China)
In this paper, we studied the anti-inflammatory mechanism of arginyl-fructosyl-glucose (AFG)invitro. The inflammation model, which was established based on the mouse monocyte-macrophage cells (RAW264.7) stimulated by lipopolysaccharide (LPS), is intervened by three doses of AFG, low, medium and high (5, 10, 20 mg/L). After intervention, MTT approach was used to access cytotoxicity; Griess approach is used to determine the amount of nitric oxide(NO); and ELISA was used to evaluate the secretion of interleukin-1β (IL-1β), interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α) and prostaglandin E2(PGE2) in cell supernatants. The results that: The three doses of AFG have no inhibition effect on RAW264.7 cells (P>0.05). In the control group, all contents of NO, IL-1β, IL-6, TNF-α and PGE2are significant less than placebo group (LPS model) (P<0.01). The mechanism of AFG in anti-inflammatory activity may be contributed by inhibiting the release of inflammatory mediators of NO and PGE2, reducing the amount of IL-1β, IL-6, TNF-α and other inflammatory factors.
arginyl-fructosyl-glucose(AFG); mouse RAW264.7 cells; anti-inflam- matory activity; inflammatory factors.
科技型中小企业创新创业基金项目(20160308002YY)
2016-08-31
A
1002-1280 (2016) 11-0065-05
Q53

