赛庚啶ELISA检测试剂盒的研制及其性能评价
黄士新,李丹妮,顾欣,黄华, 陈亮,王学生
(1.上海市动物疫病预防控制中心,上海 201103;2.上海容晖生物科技有限公司,上海 200231)
赛庚啶ELISA检测试剂盒的研制及其性能评价
黄士新1,李丹妮1,顾欣1,黄华2, 陈亮2,王学生2
(1.上海市动物疫病预防控制中心,上海 201103;2.上海容晖生物科技有限公司,上海 200231)
基于直接竞争法原理酶联免疫技术研制了一种测定动物尿液中赛庚啶(CHP)残留量的检测试剂盒,并对试剂盒的检测限、特异性和稳定性等参数进行确定。通过在CHP分子上引入活性羧基,在EDC作用下分别偶联到KLH、BSA上形成CHP-KLH和CHP-BSA抗原,CHP-KLH抗原免疫BALB/C小鼠制得抗CHP单克隆抗体,经辣根过氧化物酶HRP标记抗CHP抗体,采用CHP-BSA抗原包被酶标板,最终成功构建动物尿样中CHP残留量的竞争酶联免疫法检测体系,并进行性能测试评价。结果表明,吸光度百分比值与CHP质量浓度的对数在0.1~1.6 μg/L呈线性关系,相关系数R2为0.986,半数抑制浓度(IC50)为0.316 μg/L,检测限为0.158 μg/L,回收率在80%~110%,变异系数为2.0%~10.0%。方法具备良好的特异性,可用于动物尿样、血清及组织中CHP残留的快速检测。
动物尿样;赛庚啶;竞争酶联免疫;单克隆抗体;试剂盒
赛庚啶(Cyproheptadine,CHP)是一种抗组胺药物,也是一种H1受体拮抗药,同时具有抗5-羟色胺的作用,可抑制下丘脑的饱觉中枢而刺激食欲增加体重促进生长。在动物饲料和动物饮水中非法添加这种药物,会造成动物体内药物残留,严重危害人体的健康[1-3]。农业部于2010年12月27日发布1519号公告,禁止在饲料和动物饮水中使用盐酸CHP[4]。
目前动物尿液中CHP检测方法主要为液相色谱-串联质谱色法(LC/MS/MS)和高效液相色谱法(HPLC),但均存在检测时间长和检测成本高等缺点,不适用于快速筛查。本研究通过化学偶联的方法将CHP连接到载体蛋白上,成功制备了特异性识别CHP的单克隆抗体,并根据免疫竞争的原理,建立了一种适用于动物尿样、血样中CHP残留检测的酶联免疫检测体系,还成功研制出商品化快速检测试剂盒,以期为现场筛查提供具有操作简单、灵敏高、特异性好、检测时间短等优势的检测方法。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 CHP标准品(纯度≥99%)、碳化二亚胺盐酸盐(EDC.HCl)(纯度≥99%、牛血清白蛋白(BSA)、血蓝蛋白(KLH)、弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇(PEG,Mw4000)、HAT及HT选择性培养基、8-氮杂鸟嘌呤(8-AG)、二甲亚砜(DMSO)、3,3',5,5'-四甲基联苯胺(TMB)等均购自美国Sigma公司;DMEM基础培养基、胎牛血清(FBS)购自Hyclone公司;辣根过氧化物酶(HRP)购自上海雪满生物公司;N,N-二甲基甲酰胺(GR)等其他化学试剂购自国药集团,BABL/C小鼠来自上海交大医学院。
1.1.2 仪器与设备 酶标仪360T,上海科华公司;旋转蒸发仪R-215,Buchi Labortechnik AC;高速冷冻离心机CT14RDII,上海天美;紫外分光光度仪UV-7502PC,上海欣茂仪器有限公司。
1.2 方法
1.2.1 CHP抗原的制备[5-7]通过对CHP硝化还原在CHP侧苯环引入氨基得CHP-NH2,CHP-NH2再和溴丁酸合成半抗原CHP-COOH,其合成路线见图1。

图1 半抗原CHP接臂合成路线
反应瓶中加入原料盐酸CHP 0.5 g和5 mL浓硫酸,搅拌溶解,分次加入浓硝酸和浓硫酸混合物,反应得硝基化合物。将硝基化合物0.5 g溶于水中,搅拌下依次加入浓盐酸0.55 mL、锌粉0.62 g,反应2 h,抽滤得得半固体状黄色物质,层析后得CHP氨基化合物CHP-NH2。加乙酸乙酯和吡啶反应处理后得半抗原CHP-COOH。将2 mg半抗原溶于pH 为6.0的2-吗啉乙酸(MES)水溶液中,4 ℃搅拌过夜。对0.01 mol/L pH7.2 PBS透析48 h可收集赛庚啶的完全抗原CHP-KLH。抗原CHP-BSA或CHP-OVA制备方法相同。
1.2.2 CHP抗体制备[8-9]将CHP-KLH的免疫抗原按50 μg/mL只的剂量与等体积弗氏佐剂充分乳化后,腹部皮下多点注射免疫4只6~8周龄雄性BALB/C小鼠,免疫7~10 d,尾静脉采血,间接ELISA检测血清效价。将免疫效果较好的小鼠脾脏与骨髓瘤细胞SP2/0通过PEG介导融合,间接ELISA筛选阳性克隆;阳性克隆经有限稀释亚克隆后获得遗传稳定的单克隆细胞株,细胞株扩大培养后,接种经降植烷致敏BALB/C小鼠腹腔诱导生产单克隆抗体的腹水[8]。腹水经硫胺粗纯化,再辛酸硫胺法纯化得相应单抗[8]。
用辣根过氧化物酶(HRP)标记CHP单克隆抗体,采用过碘酸钠法(改良法)标记。取1 mg CHP单克隆抗体在50 mM pH9.6碳缓冲液CBS中透析过夜,加入0.5 mg经过碘酸钠醛化的HRP溶液,4℃反应2 h;加入硼氢化钠溶液终止反应,将溶液装入透析袋中,在PBS中透析过夜;透析完毕后取出,加入等体积甘油,-20℃避光保存[9]。
1.2.3 CHP完全抗原的包被 用50 mmol/L pH9.6碳酸盐缓冲液将CHP抗原(CHP-BSA)稀释成系列浓度,依次包被到96孔酶标板,每孔包被量100 μL,浓度从0.5~8 μg/μL。4 ℃孵育过夜,将孔中液体倾去,每孔加入250 μL 0.5% BSA 10 mmol/L PBS pH 7.4封闭,于37 ℃恒温箱中孵育2 h,将孔中封闭液倾去,放入温度37 ℃、相对湿度20%的烘房烘干,铝箔包装放存4℃待用[8]。
1.2.4 样品检测 在每孔中加入50 μL系列浓度的CHP标准品溶液(或样品溶液)和100 μL稀释后的酶标CHP抗体,25 ℃反应30 min;洗涤4~5次后加入100 μL底物显色液,25 ℃显色反应20 min;最后加入50 μL终止液终止反应,设定酶标仪于波长450 nm处测定吸光度值[7]。
1.2.5 线性范围 用阴性猪尿配制不同浓度CHP系列标准溶液,按要求对样品处理后,在最优抗原-酶标抗体工作浓度下,测定OD450值。

1.2.7 抗体的特异性 CHP和类似药性的特非那定、盐酸苯氧丙酚胺、芬司匹利和克伦特罗等4种药物配成相应的浓度进行交叉反应,得出各种药物的半数抑制浓度(IC50),然后计算交叉率,交叉率=IC50(CHP)/IC50(其他药物)×100。
1.2.8 试剂盒的准确度和精密度 在空白猪尿样中分别添加不同浓度的CHP标准品,添加浓度为0.15、0.2、0.5 ng/mL,每个浓度重复3次,对3批试剂盒进行测定。
1.2.9 试剂盒稳定性试验 将试剂盒在37 ℃环境中存放7 d,取出后按照试剂盒操作程序测定其标准曲线的OD450值,并与4 ℃存放条件下的同批次试剂盒标准曲线OD450测定值进行比较。
2 结果
2.1 线性范围 表1的实验结果表明,在0.1~1.6 ng/mL浓度范围内,CHP抗原、抗体的抑制反应最佳,如图2所示吸光值在浓度0.1~1.6 ng/mL之间曲线形状呈指数形。B/B0的百分比值与CHP质量浓度的对数呈现良好的线性关系(图3),线性回归方程为Y=-52.26X+23.80,相关系数R2为0.986,半数抑制浓度IC50为0.316 ng/mL。

表1 不同CHP浓度时OD450值

2.3 抗体的特异性 CHP试剂盒与相似药物的交叉反应率实验结果见表2,表明CHP试剂盒与类似

图2 在450nm下不同赛庚啶浓度吸光值

图3 CHP浓度取半对数的回归曲线
药性的特非那定、盐酸苯氧丙酚胺、芬司匹利和克伦特罗等4种药物无交叉反应,特异性较高。
2.4 试剂盒的准确度和精密度 平均添加回收率及变异系数计算结果如表3所示,猪尿中CHP药物的添加回收率在80%~110%之间;在批内、批间的变异系数1.8%~9.4%之间,表明该ELISA试剂盒具有良好的准确性和精密性,可以满足动物尿液中CHP药物残留测定要求。

表2 CHP抗体对其他药物的交叉反应率

表3 准确度和精密度测定结果
2.5 试剂盒的符合性 从试剂盒的假阴性、假阳性测定以及仪器检测样品比对情况评估其符合性。2.5.1 假阴性率 在已确认的阴性样品中添加不同浓度的赛庚啶标准品,评价试剂盒的假阴性。阳性添加样本的测定结果均为阳性,未发现假阴性(表4)。

表4 CHP的试剂盒假阴性评价结果 μg/L
2.5.2 假阳性率 取40份经仪器确认的阴性尿样,试剂盒测定结果浓度低于0.1 ng/mL的有32份,浓度低于0.2 ng/mL的有8份,结果判定均为阴性,未出现假阳性。
2.5.3 与仪器测定进行比对 取50份空白猪尿样品,随机添加CHP标品,制得50份盲样,分别采用ELISA试剂盒盒液相色谱-串联质谱进行测定,仪器方法参照DB31/T 《猪尿中赛庚啶残留量的测定 酶联免疫吸附法与液相色谱-串联质谱法》所述进行操作。经检测40份样品确认为阴性,10份检测结果大于0.2 ng/mL,判定为阳性,ELISA检测结果与液相色谱-串联质谱检测结果相符,表明此试剂盒的符合性高。
2.6 试剂盒的稳定性 根据生化试剂在37 ℃稳定7 d相当于4~10 ℃稳一年左右的原则,在37 ℃条件下进行加速稳定性试验。试剂盒在37 ℃ 7 d中阴性值吸光值仅降了5%左右。试剂盒在37 ℃ 7 d标准曲线和存放4 ℃时曲线变化较小(图4), IC50值分别0.330和0.331,说明试剂盒在规定条件存放有效期一年左右。
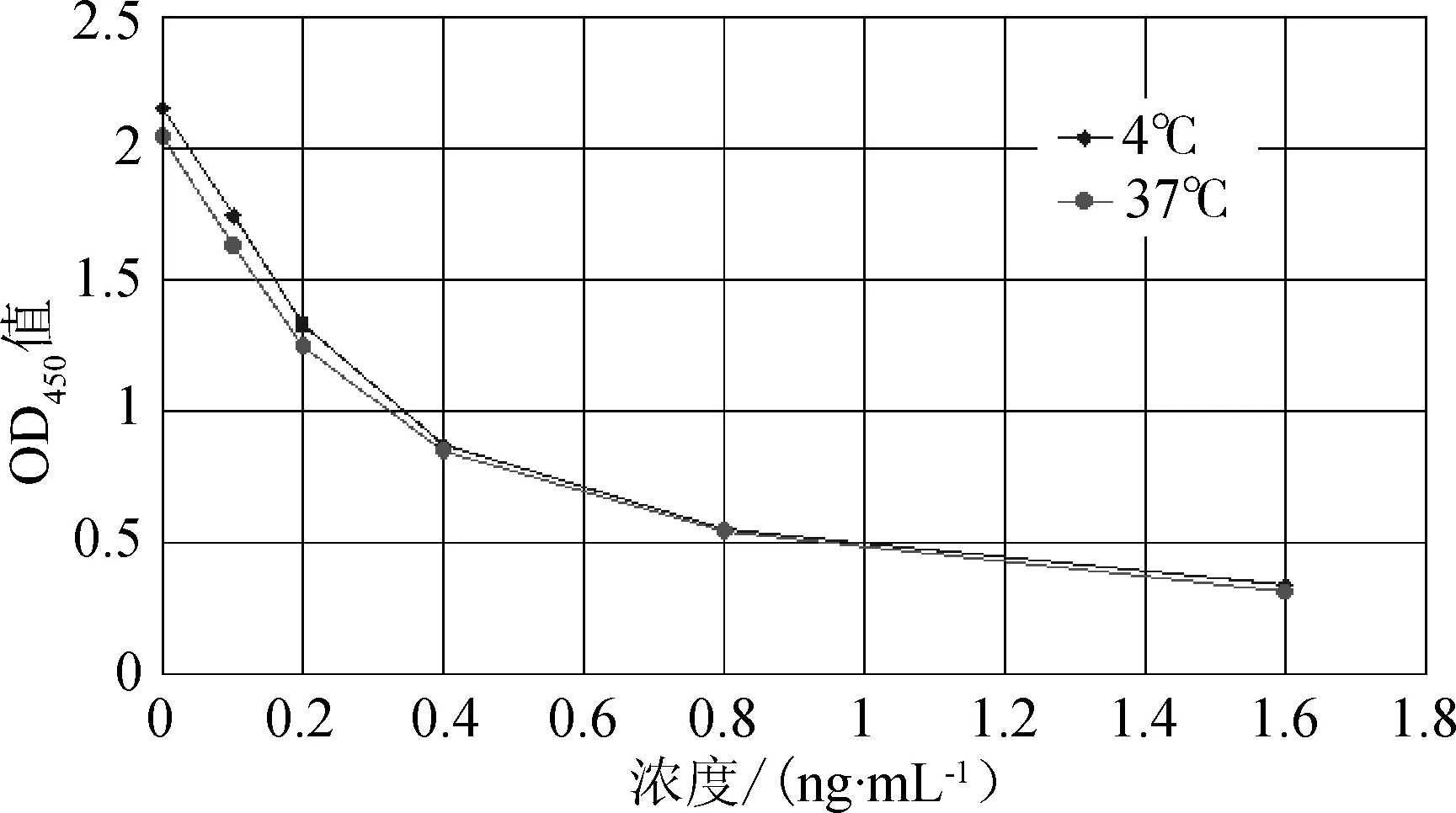
图4 赛庚啶试剂盒在37℃和4℃时吸光值和浓度变化
3 讨论
3.1 CHP特异性抗体的制备 CHP是小分子物质,本身不具备免疫原性,要制备CHP的抗体必须现将CHP小分子连接到一个大分子载体蛋白上,通过免疫动物来获得抗体。通过化学偶联的方法将CHP连接到载体蛋白上,首次成功制备了特异性识别CHP的单克隆抗体。
3.2 包被抗原-酶标抗体工作浓度选择 采用方阵试验法对直接竞争ELISA法中包被抗原和酶标抗体的稀释度进行筛选并确定工作浓度,一般原则选择OD450值2.0左右时的浓度组合作为最适工作浓度。试验分别比较了不同的酶标抗体稀释浓度1∶1000、1∶5000、1∶10000、1∶20000,与不同包被抗原浓度0.5~8.0 μg/mL的浓度情况下的OD450,得到最优浓度组合为:抗原包被浓度为1~2 μg/mL,酶标抗体稀释比1∶10000,此时的OD450值为2.135~2.201。
本研究通过合成CHP完全抗原和免疫其动物制备相应的特异性单克隆抗体,建立了竞争ELISA试剂盒,经性能分析测试,说明此试剂盒特异性好、准确性和重复性高等特点,完全适用于检测部门、中小企业以及生畜养殖业对动物尿样、血清和组织中的赛庚啶残留检测,同时也为食品和饲料中赛庚啶残留的监控提高了便捷、灵敏、快速的检测方法。
[1] 陈其煌. 高效液相色谱-串联质谱法测定猪尿液中盐酸可乐定和盐酸赛庚啶[J]. 福建农业学报, 2012,(6):596-600.
[2] 黄炎坤,韩占兵,王娟娟, 等. 氯丙嗪和赛庚啶对黄羽肉种鸡产蛋性能的影响[J]. 黑龙江畜牧兽医, 2008, (1):35-36.
[3] 万宇平,罗晓琴,郝小妹, 等. 动物组织中赛庚啶竞争酶联免疫法的建立[J]. 中国酿造, 2014, 10:130-132.
[4] 中华人民共和国农业部第1519号公告 [S].
[5] Kuhn W E. Organic Syntheses Coll[M]. New York Organic Syntheses, Inc. Vol. 2, 1943: 447.
[6] Kuhn W E. Organic Syntheses Coll[M]. New York Organic Syntheses, Inc. Vol 13, 1933:74.
[7] Prugh John D. Piperidylidene derivatives of cyano-5H-dibenzo[a,d]cycloheptene[P]: United States, US 3988342,1976-10-26.
[8] 朱立平,陈学清. 免疫学常用实验方法[M]. 北京:人民军医出版社,2000.
[9] 巴德年.当代免学技术与应用[M]. 北京:北京医科大学、中国协和医科大学联合出版社,1998.
(编辑:李文平)
Development and Performance Measurement of Cyproheptadine ELISA Test Kit
HUANG Shi-xin1, LI Dan-ni1, GU Xin1, HUANG Hua2,CHEN Liang2, WANG Xue-sheng2
(1.ShanghaiAnimalDiseaseControlCenter,Shanghai201103,China;2.RohiBiotechnologyCo.Ltd,Shanghai200231,China)
A direct competitive ELISA assay was developed in order to detect cyproheptadine in the samples of animal urine, and its technical parameters, such as sensitivity, specificity and stability were tested respectively. By introducing an active carboxyl group to cyproheptadine molecules, the hapten cyproheptadine was conjugated to keyhole limpet hemocyanin(KLH) and bovine serum albumin(BSA) by EDC method. Immnunized the Balb/c mice with CHP-KLH antigen,the monoclonal antibodies against cyproheptadine were acquired. The monoclonal antibodies were labeled with horseradish peroxidase. Coated CHP-BSA antigen on the plate wells, the direct competitive ELISA assay was developed for detecting cyproheptadine in the samples. The results showed that the logarithm of cyproheptadine concentration with the absorbance percentage shows a linear relationship between 0.1~1.6 μg/L, the correlation coefficientR2is 0.986, the half inhibitory concentration (IC50) is 0.316 μg/L, the detection limit for cyproheptadine the assay is 0.158 μg/L, the recovery is 80%~110%, the coefficient of variation is 2.0%~10.0%. This assay exhibits good specificity with no any cross reactions to terfenadine and clenbuterol. It could be used as rapid detection for the residual cyproheptadine in the samples such as animal urine, serum and tissues.
animal urine; cyproheptadine; competitive ELISA; monoclonal antibody; test kit
国家公益性行业(农业)科研专项(201203023);上海市科技兴农重点攻关项目 [沪农科攻字(2014)第3-3号]
2016-08-24
A
1002-1280 (2016) 11-0044-05
S859.8

