氟苯尼考在红笛鲷体内的药代动力学研究
黄郁葱,汤菊芬,秦青英,简纪常 *,黄月雄,廖建萌
(1. 广东海洋大学水产学院,广东湛江524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江524088;3. 广东省湛江市食品药品监督管理局,广东湛江524022)
氟苯尼考在红笛鲷体内的药代动力学研究
黄郁葱1,2,汤菊芬1,2,秦青英1,2,简纪常1,2 *,黄月雄1,2,廖建萌3
(1. 广东海洋大学水产学院,广东湛江524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江524088;3. 广东省湛江市食品药品监督管理局,广东湛江524022)
为研究氟苯尼考在红笛鲷体内的药代动力学特征,在水温(20±2)℃条件下,氟苯尼考以10 mg/kg单剂量腹注和口灌健康红笛鲷(Lutjanussanguineus),采用HPLC-MS/MS测定组织中的药物浓度,数据用DAS3.0 软件分析。结果显示,两种给药方式下红笛鲷血浆药时数据均符合一级吸收二室模型;腹注给药后血浆、肝脏、肾脏和肌肉的峰浓度(Cmax)分别为10.62 μg/mL、8.36、22.57和4.76 μg/g,达峰时间(Tmax)分别为1.2、1.0、1.0和6.0 h,消除半衰期(t1/2β)分别为29.76、17.84、17.23和19.48 h;口灌给药后血浆、肝脏、肾脏和肌肉的Cmax分别为2.35 μg/mL、1.45 μg/g、4.06 μg/g和1.73 μg/g,Tmax分别为2.69、1.5、1.5和4.0 h,t1/2β分别为40.59、12.29、37.78和47.34 h。结果表明,腹注给药方式下氟苯尼考在红笛鲷体内的吸收快于口灌给药,在血浆和肝脏中的消除快于口灌给药,在肌肉和肾脏中的消除则慢于口灌给药。研究结果为氟苯尼考在临床上的合理应用提供了科学依据。
氟苯尼考;红笛鲷;药代动力学
氟苯尼考(Florfenicol,FF)又名氟甲砜霉素,由一种新型动物专用的氯霉素类抗生素。氟苯尼考具有极广的抗菌谱,对大多数革兰氏阳性菌、阴性菌、螺旋体、衣原体、立克次氏体、原虫等均有较强的抑杀作用,尤其对鳗弧菌(Vibrioanguillarum)[1]、迟缓爱德华氏菌(Edwardsiellatarda)[1]、美人鱼发光杆菌杀鱼亚种(Photobacteriumdamselaesubsp.Piscicida)[1-2]、杀鲑气单胞菌(Aeromonassalmonicida)[3]和嗜水气单胞菌(Aeromonashydrophilia)[4]等病原菌均具有高效的抗菌活性,在动物医学临床上发挥着重要作用。由于其具有高效、安全、广谱、吸收好和组织分布广泛等优点,已成为氯霉素禁用后的主要替代药物,广泛应用于假结核病、爱德华氏菌病、弧菌病、疥疮病等水生动物细菌病的防治[5]。目前国内外开展氟苯尼考药代动力学研究的水生动物有凡纳滨对虾(Litopenaeusvanname)[6]、九孔鲍(Haliotisdiversicolorsupertexta)[7]、大西洋鲑(Salmosalar)[8]、大西洋鳕(Gadusmorhua)[9]、大黄鱼(Pseudosciaenacrocea)[10]、鲫(Carassiusauratus)[11]、吉富罗非鱼(Oreochromisniloticus)[12]和眼斑拟石首鱼(Sciaenopsocellatus)[13]等,而其在南方地区的重要经济鱼类红笛鲷体内药代动力学研究尚未见相关报道。因此,通过腹腔注射和口灌两种给药方式研究氟苯尼考在红笛鲷体内的药代动力学规律,为氟苯尼考在红笛鲷健康养殖中科学合理用药提供理论依据。
1 材料与方法
1.1 材料
1.1.1 药品和试剂 氟苯尼考标准品(纯度99%),德国DR.Ehrenstorfer GmbH公司;氟苯尼考原药(纯度98%),批号20120612,购自湖北兴银河化工有限公司;乙腈、甲醇为HPLC级,购自德国Merck公司;乙酸乙酯、正己烷等均为分析纯,购自广州化学试剂厂;肝素钠注射液,购自江苏万邦生化医药股份有限公司。
1.1.2 试验仪器 液质联用仪TSQ Quantum Access,美国Thermo Fisher公司;Supelclean LC-Almmina-N中性氧化铝固相萃取小柱,1 g/3mL,美国Supelco公司; Sigma 3-18K高速冷冻离心机,德国Sigma公司;Sartoriusarium-611VF超纯水仪,德国Sartorius公司;YGC-24 氮吹仪,成都雅源科技有限公司。
1.1.3 试验动物 试验用红笛鲷购自湛江市某海水养殖场,平均体质量为100±18 g,健康活力好,无病虫害,试验前暂养7 d,经抽样检测鱼体内无氟苯尼考及氯霉素、氟苯尼考等同类药物残留。试验在1 m3玻璃钢桶中进行,试验期间海水盐度28,水温20±2 ℃,连续充气,每天早上换水1/2,投喂不含任何药物的全价配合饲料。
1.2 方法
1.2.1 给药及样品采集 试验前1 d停止投饲,将试验鱼随机分成两组,每组100尾,另选数尾没给药的鱼作空白对照。试验组I单剂量腹腔注射给药,剂量10 mg/kg;试验组II单剂量口灌给药,剂量10 mg/kg,无回吐者保留用以试验。分别于给药后的第9、15、30 min及1、1.5、2、4、6、8、12、24、48、72、96、120 h用含肝素钠的注射器尾静脉采集血样,每个时间点采集5尾鱼,4000 r/min离心10 min,取上层血浆于-80 ℃保存。同时取肝脏、肾脏及肌肉样品,置-80 ℃保存至药物浓度分析。另取空白血液和组织样品作为对照。
1.2.2 样品前处理 血液样品的前处理血浆置于室温自然解冻后,取1 mL血浆,加入15 mL氨化乙酸乙酯(乙酸乙酯/氨水,98∶2,V/V)和5 g无水硫酸钠,漩涡振荡15 min,超声提取15 min,4000 r/min转速离心10 min,将上层清转移至另一干净的离心管中,重复提取两次,合并上清液,氮气吹干,加入25 mL(甲醇∶水=3∶7)溶液,经0.22 μm微孔滤膜过滤,吸取适量上机检测。
组织样品前处理样品室温下自然解冻,准确称取组织样品2.00 g,加入15 mL氨化乙酸乙酯、无水硫酸钠3 g溶液,均质30 s,再加入5 mL碱性乙酸乙酯清洗刀头合并提取液,旋涡混合10 min,超声提取15 min,涡旋振荡10 min,10000 r/min离心5 min。取上层清液,氮气吹干,加入25 mL(甲醇∶水=3∶7)溶液,经0.22 μm 微孔滤膜过滤后,取适量上机检测。
1.2.3 色谱和质谱条件 检测的色谱和质谱条件参陶昕晨[14]等的方法。
1.2.4 标准曲线制备及线性范围的测定 标准曲线与最低检测限准确称取氟苯尼考0.0100 g,用少量甲醇助溶后定容至100 mL,配制成100 μg/mL的母液,再依次用甲醇溶液稀释成浓度为0.005、0.010、0.020、0.050、0.100 μg/mL的标准液,采用上述液相色谱和质谱条件进行检测,以峰面积为纵坐标,药浓度为横坐标绘制标准曲线,分别求出回归方程和相关系数。最低检测限(LOD)和最低定量限(LOQ)参照梁俊平[15]等的方法确定。
回收率和精密度的测定 取2.00 g空白肌肉样品,分别加入不同浓度的氟苯尼考标准液,使样品加标浓度分别为1.0、5.0和25.0 μg/kg,然后按样品前处理方法处理后测定,每个浓度设5个重复,同时连续测定3 d,按黄月雄等[13]计算回收率和精密度。
1.2.5 数据分析与休药期计算 数据处理应用Microsoft Excel2007绘制标准曲线和药时数曲线图,应用DAS3.0进行模型拟合和相关药动学参数的推算。
休药期计算氯霉素类药物在水产动物体内按一级动力学模型消除,即在消除相服从指数消除规律:Ct=C0e-kt。根据以下公式计算理论休药期:WTD=Ln(C0/MRL)/K。其中WTD为理论休药期(d),C0为残留消除对数曲线的截距(μg/kg),MRL为最高残留限量(μg/kg)),K为残留消除速率常数。
2 结果
2.1 线性范围与检出限 氟苯尼考标准液在0.005~0.100 μg/mL浓度范围内具有良好的线性相关性,标准曲线为Y=407.47+2695.52×X,R2=0.9999。氟苯尼考在组织中的中的最低检出限(LOD)为0.2 μg/kg,定量限(LOQ)为0.5 μg/kg。
2.2 回收率和精密度 药物在肌肉组织中的回收率和精密度见表1。氟苯尼考的回收率在89.6%~101.0%,日间精密度为4.6%~6.2%,日内精密度为2.6%~4.1%,满足本试验的要求。
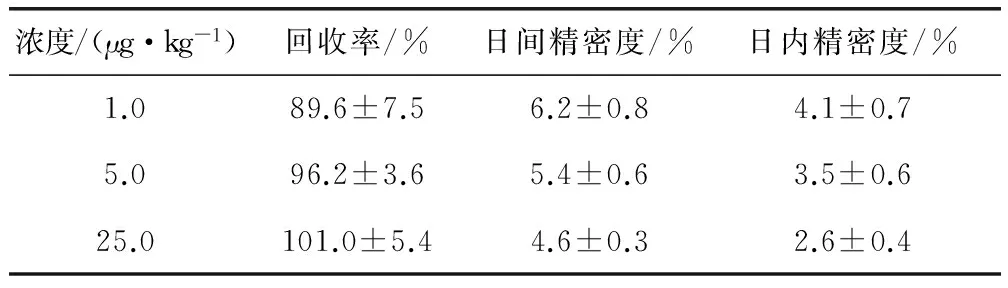
表1 氟苯尼考的加标回收率
2.3 氟苯尼考在红笛鲷各组织中的药时浓度特征 红笛鲷经腹注和口灌给药后,各组织样品药时曲线分别见图1和图2。由图1和图2可见,氟苯尼考在血浆和3种组织中的药物浓度均呈先升高后降低的趋势,其中血浆、肾脏和肝脏的药时曲线均呈现双峰现象。腹注给药后血浆、肝脏、肾脏和肌肉的Cmax分别为10.62 μg/mL、8.36、22.57和4.76 μg/g,Tmax分别为1.2、1、1和6 h。口服给药后血浆、肝脏、肾脏和肌肉的Cmax分别2.35 μg/mL、1.45、4.06和1.73 μg/g,Tmax分别为2.69、1.5、1.5和4 h,表明红笛鲷腹注氟苯尼考不仅吸收速率快于口服给药,而且吸收度也大于口服给药。
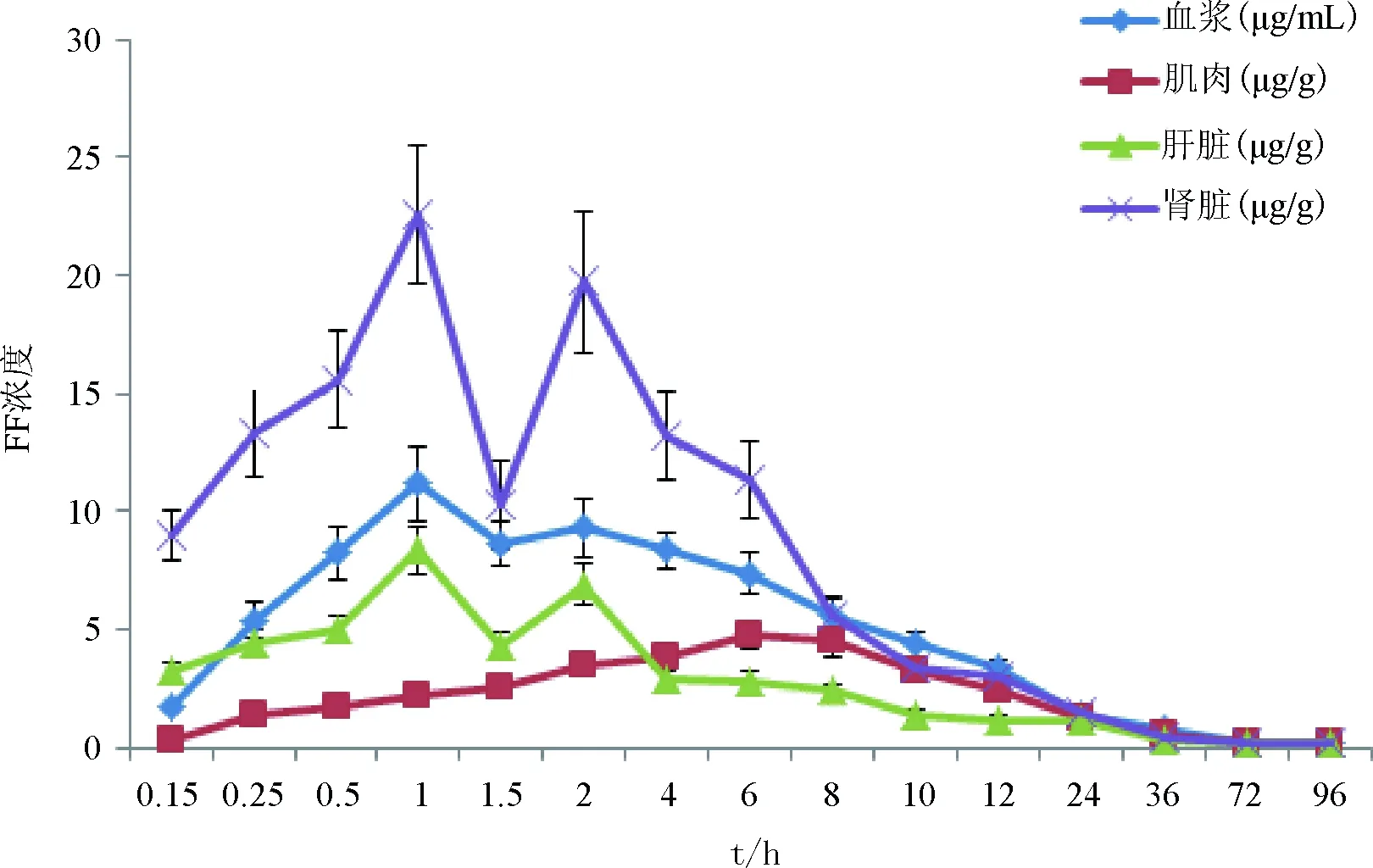
图1 红笛鲷腹注氟苯尼考后各组织中的药-时曲线
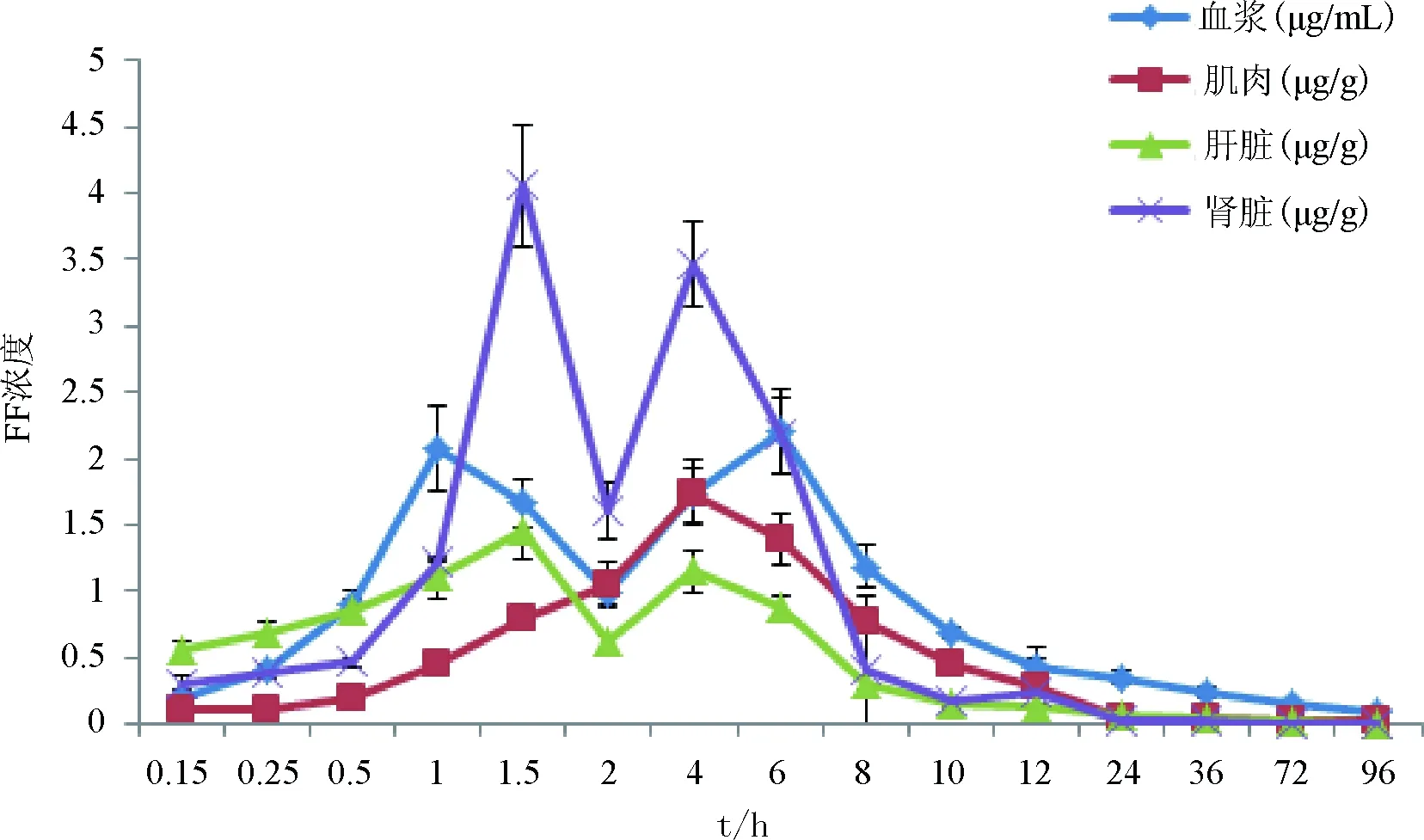
图2 红笛鲷口灌氟苯尼考后各组织中的药-时曲线
2.4 氟苯尼考在红笛鲷血浆的药代动力学参数 应用DAS3.0软件对两种给药方式下的药时数据进行分析处理和房室模型拟合,结果表明腹注和口灌两种给药方式下氟苯尼考在血浆的代谢过程均符合一级吸收二室模型,其动力学理论方程分别为:C腹注=11.344e-0.141t+ 1.97e-0.023t-13.314e-2.268t;
C口灌=14.415e-0.326t+ 0.454e-0.017t-14.869e-0.481t,其主要药动学参数见表2。
2.5 氟苯尼考在红笛鲷组织中的药代动力学参数 根据统计矩原理推算氟苯尼考在红笛鲷体内各组织的药代动力学参数,结果见表3。同一给药途径下氟苯尼考在肾脏的AUC和Cmax高于肝脏和肌肉,但其在肾脏的t1/2β和MRT短于肌肉。在不同给药途径下腹注给药各组织AUC均高于口灌给药,但药物在各组织中t1/2β和MRT均长于腹注给药。表明腹注给药较口灌给药吸收量大,但消除较快,而且氟苯尼考在肾脏组织的吸收度最高,在肌肉组织消除最慢。
3 讨论
3.1 甲砜霉素在红笛鲷血浆的药代动力学特征 本研究通过经典房室模型分析两种给药方式下氟苯尼考在红笛鲷血液的药代动力学特征,结果表明红笛鲷单剂量腹注和口灌给药的血药代谢过程均符合一级吸收二室模型,与大西洋鲑[8]、眼斑拟石首鱼[13]体内房室模型结果相一致,与大西洋鳕[9]、大黄鱼[10]、鲫[11]、罗非鱼[12]、眼斑拟石首鱼[13]、斑点叉尾鮰[16]和黄鳝[17]等动物的模型研究结果存在差异,此差异可能是由于种属、给药方式、给药剂量、温度等试验条件不同造成。肝脏、肾脏和肌肉、的药代动力学数据则采用非房室模型统计矩原理处理,由于非房室模型的限制性假设较少,目前已逐渐成为国际上药动学研究的主流方法[13],提示进行药动学分析时可同时采用两种方法进行分析,以确保分析的准确性和一致性,同时也有利于不同研究之间的比较。

表2 氟苯尼考单剂量腹腔注射及口灌方式给药后红笛鲷血浆中的药代动力学参数
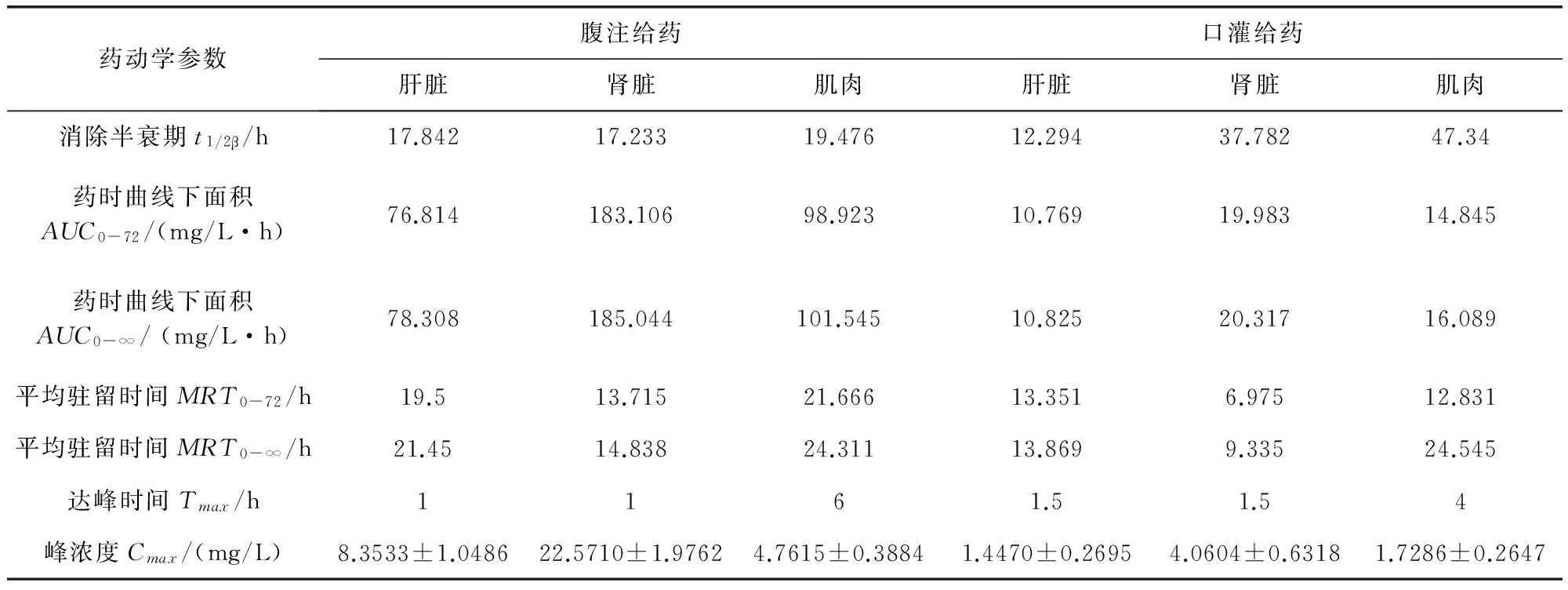
表3 氟苯尼考单剂量腹腔注射及口灌方式给药后红笛鲷组织中的药代动力学参数
3.2 氟苯尼考在红笛鲷体内的吸收和分布特征Tmax和Cmax是衡量药物吸收速率和吸收程度的重要药动学参数。氟苯尼考以10~30 mg/kg的剂量口服给药后水生爬行动物和鱼类的血药Tmax较长,如大西洋鲑(7 h)[9]、大西洋鳕(10.3 h)[8]、大黄鱼(7.93 h)[10]、罗非鱼(5.05~12 h)[12, 18]、中华鳖(3.54 h)[19]、牙鲆(4 h)[20]、鲫(4.1~13.79 h)[11, 21]和斑点叉尾鮰(5.953~11.136 h)[16, 22]。该研究中口灌给药后红笛鲷血药Tmax为2.688 h,与眼斑拟石首鱼(2 h)接近。氟苯尼考以10mg/kg的剂量口灌给药后大西洋鲑[8]、大西洋鳕[9]、斑点叉尾鮰[16]、鲫[11]、眼斑拟石首鱼[13]的血药Cmax分别为4.0、10.8、4.07~7.06、2.99和6.307 μg/mL,该研究中红笛鲷血药Cmax为2.35 μg/mL,低于上述鱼类。相比较而言,药物在虾、蟹等甲壳动物体内的吸收速率比其他水生动物不仅吸收迅速,而且吸收程度更高。中国明对虾[23]单剂量口服30 mg/kg氟苯尼考后血药Tmax为0.605 h,凡纳滨[14]对虾口服氟苯尼考后血浆Tmax为1 h,远快于上述的水产动物,究其原因可能与虾蟹的血液循环系统为开放式循环系统有关。
此外,该研究中红笛鲷腹注和口灌氟苯尼考后鱼体内的药时曲线均呈现双峰现象,与鲫灌服氟苯尼考和吉富罗非鱼口灌氧氟沙星以及眼斑拟石首鱼腹注和口灌氟苯尼考的药代动力学试验中均出现双峰现象结果一致[11, 13, 24]。双峰现象通常在口灌给药的药物代谢过程中较为常见[25],其原因可能是药物在小肠的吸收存在肝肠循环和非齐性吸收[25-26]。
AUC和Vd是反映药物在机体内吸收和分布的主要药动学参数。甲砜霉素以10 mg/kg剂量口服给药后,大西洋鲑[8]、大西洋鳕[9]、斑点叉尾鮰[16, 22]、眼斑拟石首鱼[13]血浆AUC分别为112.0、524、81.279~174.547和137.675 h·μg/mL,该研究中腹注和口服给药红笛鲷血浆、肝脏、肾脏和肌肉AUC分别为158.118和35.767 h·μg/L、76.814和10.769 h·μg/L、98.923和14.845 h·μg/L,其血浆AUC远小于上述鱼类。该文中口服给药方式下氟苯尼考血药Vd为3.375 L/kg,与鲫(2.87 L/kg)[11]和锦鲤(2.9 L/kg)[27]较为接近,与大西洋鲑(1.12 L/kg)[7]、大西洋鳕(0.015 L/kg)[8]和眼斑拟石首鱼(26.515 L/kg)[13]差别较大,这差异可能是因为种属不同所导致。目前的研究表明,氟苯尼考在水生动物体内的Vd大多都大于1.0 L/kg[27],说明氟苯尼考在水生动物体内分布较广泛,在组织中药物浓度高,这可能是与氟苯尼考的高脂溶性和低血浆蛋白结合率特性密切相关[27]。
3.3 氟苯尼考在红笛鲷组织的消除特征t1/2β是反映药物体内消除规律的重要参数,在不同动物体内存在差异。该研究中红笛鲷腹注给药后血浆分别为29.758 h,远长于日本囊对虾(Marsupenaeusjaponicus)(3.766 h)[28]、鲫(1.367 h)[21]和眼斑拟石首鱼(7.288 h)[13];口灌给药后红笛鲷血药t1/2β为40.594 h,远长于日本鳗鲡(Anguillajaponica)(21.24 h)、罗非鱼(11.18 h)[12]、斑点叉尾鮰(2.301~9.11 h)[16, 22]和眼斑拟石首鱼(12.08 h)[13],与大西洋鳕(43 h)[18]和牙鲆(51 h)[20]相近,表明腹注跟口灌氟苯尼考在红笛鲷体内消除相对较慢。刘永涛[16]等研究发现18 ℃和28 ℃两种不同温度条件下斑点叉尾鮰经口灌给药后血药t1/2β分别为3.845和2.301 h。Martinsen等[8]研究表明,大西洋鲑在静脉注射和口灌给药后t1/2β分别为12.2和14.7 h。可见,t1/2β还可能与水温和给药途径有关。此外,t1/2β与药物制剂形式、剂量及等因素也有一定关系。
综上所述,氟苯尼考在红笛鲷体内具有吸收迅速、峰浓度高、消除相对较缓慢及组织中广泛分布的特征。因此,在临床实践中,要根据实际情况制定给药方案及休药期,避免耐药性的产生和药物残留,以保障水产品的质量安全。
氟苯尼考胺是氟苯尼考主要的活性代谢产物。栾鹏[27]和王瑞雪[29]等以15 mg/kg体重的剂量口灌鲤和西伯利亚鲟,用HPLC-MS/MS检测在鲤和西伯利亚鲟的血液、肌肉、肝肾等组织中检出主要代谢物氟苯尼考胺,而刘永涛[16]等在18 ℃和28 ℃条件下给斑点叉尾鮰单剂量以10 mg/kg混饲给药,用HPLC法检测在血浆中未检出氟苯尼考胺;8 ℃条件下大西洋鳕鱼以单剂量10 mg/kg静脉注射及口服给药,用HPLC法检测在血浆中也未检出氟苯尼考胺;该试验中在红笛鲷的血液和组织中均未检出氟苯尼考胺,这一结果表明,氟苯尼考胺在血浆中含量的多少可能与试验鱼种类、水温、药物剂量、检测方法以及代谢速度等有关,为水产品中氟苯尼考和氟苯尼考胺的残留检测提供了有益的参考。
3.4 休药期探讨 氟苯尼考在动物组织中残留不仅直接危害动物和人健康,而且导致细菌耐药性增强,已成为社会关注的公共卫生问题,因此各国都规定了其在动物性食品中最高残留限量(Maximum Residue Level,MRL)。我国、欧盟均规定在氟苯尼考(胺)可食用动物组织中MRL为1000 μg/kg[16, 30],本研究通过计算可得到红笛鲷腹注和口灌两种给药方式下理论休药期分别为 4 和2 d,与氟苯尼考在大黄鱼的休药期结果相似[10]。在实际给药时,还应综合考虑制剂类型、给药方式、给药剂量、给药次数、给药时间间隔、鱼的健康状况、温度、养殖环境等因素对休药期的影响,因此建议氟苯尼考的休药期均不少于7 d,以确保水产品中药物残留量低于MRL和水产品质量。
[1] Fukui H, Fujihara Y, Kano T.Invitroandinvivoantibacterial activities of florfenicol, a new fluorinated analog of thiamphenicol, against fish pathogens[J]. Fish Pathology, 1987, 22(4): 201-207.
[2] Kim E H, Aoki T. Drug resistance and broad geographical distribution of identical R plasmids of Pasteurella piscicida isolated from cultured yellowtail in Japan[J]. Microbiology and Immunology, 1993, 37(2): 103-109.
[3] Nordmo R, Varma K J, Sutherland I H,etal. Florfenicol in Atlantic salmon,Salmosalar, L.: field evaluation of efficacy against furunculosis in Norway[J]. Journal of Fish Diseases, 1994, 17(3): 239-244.
[4] Ho S P, Hsu T Y, Che M H,etal. Antibacterial effect of chloramphenicol, thiamphenicol and florfenicol against aquatic animal bacteria[J]. Journal of Veterinary Medical Science, 2000, 62(5): 479-485.
[5] 杨倩,吴志新,陈孝煊,等. 氟苯尼考的药效学及其在水产动物中的代谢动力学研究进展[J]. 水生态学杂志,2010,3(5):116-121.
[6] 陶昕晨. 三种氯霉素药物在对虾残留消除的研究[D]. 湛江:广东海洋大学,2013:1-39.
[7] 徐力文,廖昌容,王瑞旋,等. 氟苯尼考在九孔鲍体内的药代动力学初步研究[J]. 台湾海峡,2006,25(2):216-221.
[8] Martinsen B, Horsberg T E, Varma K J,etal. Single dose pharmacokinetic study of florfenicol in Atlantic salmon (Salmosalar) in seawater at 11°C[J]. Aquaculture, 1993, 112(1): 1-11.
[9] Samuelsen O B, Bergh O, Ervik A. Pharmacokinetics of florfenicol in codGadusmorhuaand in vitro antibacterial activity againstVibrioanguillarum[J].Diseases of Aquatic Organisms, 2003, 56(2): 127-33.
[10]秦方锦,金珊,邢晨光,等.氟苯尼考在大黄鱼体内的药动学及组织分布研究[J]. 水生态学杂志,2010,01:102-106.
[11]刘海侠,刘晓强,张振龙,等. 氟苯尼考单剂量腹腔注射和灌服后在鲫体内的药代动力学[J]. 西北农业学报,2011,05:54-58.
[12]王伟利,罗理,姜兰,等. 适温条件下氟苯尼考在罗非鱼体内的药物动力学[J]. 大连海洋大学学报,2010,25(4):285-288.
[13]黄月雄,汤菊芬,简纪常,等. 氟苯尼考在美国红鱼体内的药代动力学和组织分布[J]. 广东海洋大学学报,2014,34(3):58-64.
[14]陶昕晨. 三种氯霉素药物在对虾残留消除的研究[D].湛江:广东海洋大学,2013.
[15]梁俊平,李健,张喆,等. 肌注和口服恩诺沙星在大菱鲆体内的药代动力学比较[J]. 水生生物学报,2010,34(6):1122-1129
[16]刘永涛,艾晓辉,杨红. 不同水温下氟甲砜霉素在斑点叉尾鮰体内的药代动力学研究[J]. 水生生物学报,2009,33(1):1-6.
[17]谢玲玲,吴志新,袁娟,等. 口灌氟苯尼考在黄鳝体内的药物代谢动力学及其残留[J]. 华中农业大学学报,2013,32(1):97-102.
[18]冯敬宾,李刘冬,贾晓平. 氟苯尼考在罗非鱼体内的药物动力学[J]. 南方水产,2006,2(5):25-29.
[19]朱丽敏,杨先乐,林启存,等. 肌注和口服氟苯尼考在中华鳖体内残留分析及药代动力学[J]. 水产学报,2006,30(4):515-519.
[20]崔毅,周明莹,陈碧鹃,等. 氟苯尼考在牙鲆体内残留的消除规律[J]. 渔业科学进展,2012,33(5):48-52.
[21]张收元,操继跃,罗宇良. 氟苯尼考在鲫体内的药动学研究[J]. 水利渔业,2007,27(3):97-99.
[22]Gaunt P S, Langston C, Wrzesinski C,etal. Single intravenous and oral dose pharmacokinetics of florfenicol in the channel catfish (Ictaluruspunctatus) [J]. Journal of Veterinary Pharmacology and Therapeutics, 2012, 35(5): 503-507.
[22]李静云,李健,王群,等. 氟苯尼考3种不同给药方式在中国明对虾体内的药代动力学研究[J]. 海洋科学,2006,30(7):64-68.
[23]郑重莺,丁雪燕,张海琪,等. 氟苯尼考在南美白对虾体内药物代谢及残留消除规律[J]. 宁波大学学报(理工版),2007,20(1):23-26.
[24]王贤玉,宋洁,王伟利,等. 氧氟沙星在吉富罗非鱼体内的药代动力学及残留的研究[J]. 大连海洋大学学报,2011,26(2):144-148.
[25]Kroboth P D, Smith R B, Rault R,etal. Effects of end-stage renal disease and aluminum hydroxide on temazepam kinetics[J]. Clinical Pharmacology & Therapeutics, 1985, 37(4): 453-459.
[26]Curtis E W. Pharmacokinetic Studies of Florfenicol in Koi Carp and Threespot Gourami Trichogaster trichopterus after Oral and Intramuscular Treatment[J]. Journal of Aquatic Animal Health, 2005, 17(2):129-137.
[27]栾鹏,王瑞雪,王荻,等. 氟苯尼考及氟苯尼考胺在鲤体内的残留[J]. 水产学杂志,2012,25(2):15-18.
[28]宋维彦,苏永全,张曼,等. 氟苯尼考在日本囊对虾体内的药代动力学研究[J]. 水产科技情报,2011,38(6):302-306.
[29]王瑞雪,王荻,李绍戊,等. 氟苯尼考及氟苯尼考胺在西伯利亚鲟体内的药动学及组织分布[J]. 上海海洋大学学报,2012,21(4):568-574.
[30]中华人民共和国农业部. 动物性食品中兽药最高残留限量[S].
(编辑:陈希)
Pharmacokinetics of Florfenicol inLutjanussanguineus
HUANG Yu-cong1,2, TANG Ju-fen1,2, QIN Qing-ying1,2,JIAN Ji-chang1,2*, HUANG Yue-xiong1,2, LIAO Jian-meng3
(1.FisheriesCollegeofGuangdongOceanUniversity,Zhanjiang,Guangdong524088,China;2.GuangdongProvincialKeyLaboratoryofPathogenicBiologyandEpidemiologyforAquaticEconomicAnimals,Zhanjiang,Guangdong524088,China; 3.GuangdongZhanjiangFoodandDrugAdministration,Zhanjiang,Guangdong524022,China)
The pharmacokinetics of florfenicol inLutjanussanguineuswas investigated after intraperitoneal injection and oral administration with a single dose of 10 mg/kg body weight at water temperature of (20±2) ℃. The concentrations of florfenicol in plasma and tissues were determined by means of liquid chromatography with MS/MS detection. The pharmacokinetics data were analyzed with pharmacokinetic program DAS 3.0. The results showed that the concentration-time data in plasma following intraperitoneal injection and oral adminstration were best described by a two-compartment open model with first-order absorption. After intraperitoneal injection of florfenicol, theCmaxin plasma, liver, kidney and muscle were 10.62 μg/mL, 8.36, 22.57, 4.76 μg/g,and theTmaxwere 1.2, 1.0, 1.0, 6.0 h, and thet1/2βwere 29.76, 17.84, 17.23, 19.48 h, respectively. After oral administration of florfenicol, theCmaxof in plasma, liver, kidney and muscle were 2.35 μg/mL, 1.45, 4.06, 1.73 μg/g, and theTmaxwere 2.69, 1.5, 1.5, 4.0 h, and thet1/2βwere 40.59, 12.29, 37.78, 47.34 h, respectively. The results indicated quicker absorption, faster elimination in plasma and liver but slower elimination in muscle and kidney by intraperitoneal injection than oral administration. The research results could provide a scientific basis for reasonable clinical applications.
florfenicol;Lutjanussanguineus; pharmacokinetics
公益性行业(农业)科研专项经费项目(201203085)
2016-07-26
A
1002-1280 (2016) 11-0058-07
S859.79

