马波沙星对猪临床分离病原菌的体外抑菌活性研究
岳永波,吴好庭,刘波,范小平,杨芳,王成彬
(1.保定冀中药业有限公司,河北省中兽药工程技术研究中心,河北保定 071500;2.中国兽医药品监察所,北京 100081;3.海南省兽药饲料监察所,海口 570203)
马波沙星对猪临床分离病原菌的体外抑菌活性研究
岳永波1,吴好庭2,刘波1,范小平3,杨芳1,王成彬1
(1.保定冀中药业有限公司,河北省中兽药工程技术研究中心,河北保定 071500;2.中国兽医药品监察所,北京 100081;3.海南省兽药饲料监察所,海口 570203)
考察马波沙星对猪临床分离病原菌的体外抑菌活性,以期为临床应用提供依据。采用琼脂二倍稀释法测定马波沙星对猪临床分离大肠杆菌、金黄色葡萄球菌和链球菌的最小抑菌浓度(MIC),并以土霉素、恩诺沙星、诺氟沙星、环丙沙星、庆大霉素和多西环素作为对照药物。结果表明:马波沙星对猪临床分离病原菌大肠杆菌、金黄色葡萄球菌和链球菌均有较低的最小抑菌浓度,对临床分离大肠杆菌、金黄色葡萄球菌和链球菌的抑菌活性明显高于诺氟沙星、环丙沙星、庆大霉素和强力霉素,对临床分离大肠杆菌的抑菌活性高于恩诺沙星。马波沙星对引起猪乳房炎-子宫炎-无乳综合征(MMA)的主要病原菌的抑菌活性优于常用抗菌药。
马波沙星;体外抑菌;最低抑菌浓度;临床分离病原菌
马波沙星(marbofloxacin MBF)是第三代喹诺酮类抗菌药物,其作用机制是通过抑制细菌脱氧核糖核酸(DNA)合成酶之一的回旋酶(DNA-gyrase),使细菌DNA复制及蛋白质的合成受干扰,从而起到杀菌的怍用,其对革兰氏阴性菌和革兰氏阳性菌和支原体均有很好的抗菌效果,是动物专用抗菌药[1]。马波沙星有抗菌谱广、抗菌活性强、毒性低且不易产生耐药性,口服或注射治疗犬猫的皮肤感染[2]、上呼吸道感染[3]、泌尿道感染[4]及预防外科手术感染[5]等;注射用于治疗猪牛敏感菌引起的呼吸道感染、牛乳腺炎以及猪乳房炎-子宫炎-无乳综合征(MMA)[6-8]。
乳房炎-子宫炎-无乳综合征(MMA)或产后无乳综合症是母猪的一种多病因性疾病,其病原有大肠杆菌、葡萄球菌、链球菌、克雷伯氏菌以及霉形体等,导致仔猪不能哺乳而死亡,临床危害严重[9]。发病后一般采用广谱抗菌药进行抗菌治疗[10],但现有的广谱抗菌药经过长期使用,细菌的耐药性逐年增强,迫切需要新的抗菌药出现。马波沙星作为一种新的动物专用的抗菌药,其体外抑菌试验研究已有报道[11-13],但是尚未见与治疗猪乳房炎-子宫炎-无乳综合征(MMA)药效密切相关的体外抑菌试验研究。本试验旨在探讨马波沙星在体外对引起猪乳房炎-子宫炎-无乳综合征(MMA)常见几种致病性细菌的抑制效果,为临床应用马波沙星提供依据。
1 材料与方法
1.1 材料
1.1.1 受试与参照药物 参照药物:庆大霉素(批号14092011)、土霉素(批号140511)、恩诺沙星(批号20140327)、多西环素(批号140806)、环丙沙星(批号140415)和诺氟沙星(批号131023),由普博欣生物科技公司提供。马波沙星对照品:10%马波沙星注射液,规格50 ml:5 g/瓶,批号2014110512,由保定冀中药业有限公司提供。
1.1.2 试验与参照菌株 试验菌株:临床分离大肠埃希氏菌40株、金黄色葡萄球菌20株和链球菌28株。标准质控菌株:大肠杆菌ATCC25922;金黄色葡萄球菌ATCC29213,均由本实验室保存。
1.1.3 培养基及试剂 培养基:麦康康琼脂(MacConkey Agar)、LB肉汤(Luria-Bertani Broth)、LB琼脂(Luria-Bertani Agar)、水解络蛋白琼脂(Muller-Hinton Agar)、水解络蛋白肉汤(Muler-Hinton Broth)、Baird-Parker琼脂基础(Baird-Parker Agar Base)、甘露醇高盐琼脂(Mannitol Salt Agar)、7.5%氯化钠肉汤(7.5%Sodium Chloride Broth)、胰蛋白胨大豆琼脂基础(Tryptic Soy Agar)、胰蛋白胨大豆肉汤(Trypic Soy Broth),均购自青岛海博生物技术有限公司。无菌脱纤维绵羊血(广州蕊特生物公司)。
1.2 方法
1.2.1 病原菌的分离及鉴定
1.2.1.1 细菌分离 在养猪场选择产后1~3 d内发生缺乳或无乳的母猪,品种为大白、长白和杜洛克,年龄为10个月至4年,体重150~200 kg,胎次为1~8。依据华南农业大学刘宇教授研究的MMA 的诊断标准[14],选择其中具有MMA典型症状的病猪10头,临床表现为体温40 ℃以上,精神沉郁、食欲减退或废绝、不同程度的便秘;阴道排出粘性或脓性分泌物,乳房肿胀、敏感,不愿哺乳。取试验猪的子宫内容物,置灭菌运送培养基中低温保存并带回实验室,用多种选择性培养基培养分离细菌。肠杆菌选择性培养用麦康凯琼脂;葡萄球菌选择性培养用高盐甘露醇琼脂及Baird-Parker琼脂;链球菌选择性培养用添加脱纤维羊血的胰蛋白胨大豆琼脂。菌株纯化培养后进行革兰氏染色镜检,初步确定病原菌种类。
1.2.1.2 细菌鉴定 细菌鉴定采用BD BBL®CrystalTM细菌鉴定系统,其中肠杆菌采用E/NF肠/非发酵菌鉴定板;葡萄球菌采用GP ID革兰氏阳性菌鉴定板;链球菌采用GP ID革兰氏阳性菌鉴定板。
1.2.2 最小抑菌浓度(MIC)测定 采用琼脂二倍稀释法测定受试药物和参照药物的最小抑菌浓度(MIC),参照CLSI的指导原则进行MIC检测。
1.2.2.1 药物的配制 青霉素、庆大霉素、土霉素、恩诺沙星、多西环素、环丙沙星、诺氟沙星和马波沙星均配制成1280 μg/mL 的贮备液, 过滤除菌, - 20 ℃低温保存备用。
1.2.2.2 菌液的制备 将质控菌株和鉴定好的试验菌株接种琼脂平板,置37 ℃过夜培养后,挑取1~2个单菌落接种于MH 培养液,置37 ℃孵育培养6~8 h,取出用生理盐水将菌液校正到0.5麦氏比浊标准 (含菌量约106CFU/mL)。
1.2.2.3 最小抑菌浓度(MIC)的测定 采用琼脂二倍稀释法,将10种药物在空白平皿上稀释到需要的各个梯度,然后将高压灭菌后的MH琼脂降到50~60 ℃,按照药液与MH琼脂的体积比9:1加到各个平皿中,混匀晾干,待用。将稀释好的待测菌液按照一定的顺序转移到96孔板中,用多点接种仪接种细菌至药物平板上,细菌接种量为5×105CFU/点,同时设药物对照、平板阴性对照和平板阳性对照,在37 ℃培养16~18 h后,观察结果。
1.2.2.4 结果判定 参照CLSI判断标准。
2 结果与分析
2.1 细菌分离 共从临床分离大肠埃希氏菌40株、金黄色葡萄球菌20株和链球菌28株。
2.2 药物敏感性 马波沙星对大肠杆菌、金黄色葡萄球菌和链球菌的MIC50分别为8、4、1 μg/mL,均低于诺氟沙星(32、32、8 μg/mL)、环丙沙星(16、16、8 μg/mL)的MIC50,与恩诺沙星的MIC50(16、2、1 μg/mL)接近。对大肠杆菌、金黄色葡萄球菌和链球菌的MIC90分别为64、64、16 μg/mL,均低于诺氟沙星(>128、>128和128 μg/mL)、环丙沙星(>128、>128和128 μg/mL)的MIC90,与恩诺沙星的MIC90(>128、32和32 μg/mL)接近。庆大霉素和强力霉素对大肠杆菌、金黄色葡萄球菌和链球菌的 MIC50和MIC90均高于马波沙星(表1~表3)。
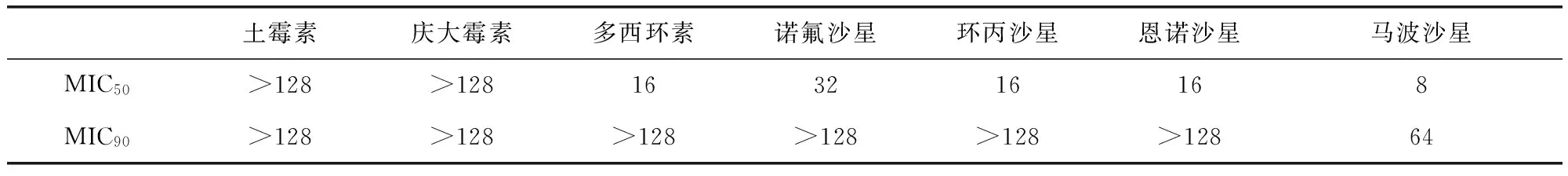
表1 大肠杆菌药物敏感性结果(μg/mL)

表2 葡萄球菌药物敏感性结果(μg/mL)

表3 链球菌药物敏感性结果(μg/mL)
3 讨论与小结
近年来,大量抗菌药物应用于集约化养猪生产中,长期不规范的用药,导致耐药菌株不断增强,兽医临床中常用抗菌药物(如土霉素、庆大霉素等),对致病菌的抑制效果不断减弱[15-17],导致养殖过程中抗菌药物用量越来越大,形成恶性循环。
根据国外Bousquet-Melou的研究[18-19],马波沙星对分离自马的肠杆菌、金黄葡萄球菌、链球菌的最低抑菌浓度范围(MICrange)分别为0.008~0.03 μg/mL、0.12~0.25 μg/mL、0.5~2.0 μg/mL;Schneider等研究[20]表明马波沙星对分离自牛乳中的大肠杆菌与金黄葡萄球菌的最低抑菌浓度范围为0.008~4 μg/mL和0.016 μg/mL;根据国内张玲玲、王令等的研究[12-13],马波沙星对临床分离的鸡、猪、鸭的大肠杆菌、金黄葡萄球菌、链球菌的最低抑菌浓度范围分别为0.125~0.500 μg/mL、0.125~0.250 μg/mL、0.125~0.250 μg/mL。与以上数据比较,本试验所得的马波沙星最小抑菌浓度(MIC)偏高,但Dinh等研究[21]表明马波沙星对分离自猪粪的大肠杆菌MIC范围为0.03~32 μg/mL,与本试验数据接近,表明不同来源的菌株耐药性存在差异。另外,Dinh等研究[21]还表明马波沙星对猪粪中分离的大肠杆菌的抑菌活性与恩诺沙星、环丙沙星相当,但本试验表明马波沙星优于恩诺沙星、环丙沙星,表明由于长期使用,菌株已经对恩诺沙星、环丙沙星产生耐药性,但对马波沙星依然敏感,没有产生交叉耐药性[22]。
随着病原菌耐药性的增强,使用标准菌株研究已经不能满足临床需要。本试验采用猪临床分离病原菌,以验证马波沙星对引起猪乳房炎-子宫炎-无乳综合征(MMA)的主要病原菌的抑菌活性的真实情况,为临床应用提供可靠的依据。结果表明马波沙星对猪临床分离大肠杆菌、金黄色葡萄球菌和链球菌的抑菌活性明显高于诺氟沙星、环丙沙星、庆大霉素和强力霉素,对临床分离大肠杆菌的抑菌活性高于恩诺沙星。马波沙星与对照药物中的环丙沙星等同为喹诺酮类药物,但是马波沙星的是兽用专用的新药,病原菌对其不易形成耐药性,因此对引起猪乳房炎-子宫炎-无乳综合征(MMA)的主要病原菌的抑菌活性优于常用的抗菌药物,为此类病菌感染的治疗提供了新的选择。
[1] 王志强, 陈杖榴: 动物专用氟喹诺酮为抗菌新药——麻保沙星[J]. 中兽医医药杂志, 2001, 4: 38-41.
[2] D N Carlotti, E. Guaguere, D Pin,etal. Therapy of difficult cases of canine pyoderma with marbofloxacin: a report of 39 dogs [J]. The Journal of small animal practice, 1999, 40 (6): 265-270.
[3] O. Dossin, P. Gruet, E. Thomas. Comparative field evaluation of marbofloxacin tablets in the treatment of feline upper respiratory infections [J]. The Journal of small animal practice, 1998, 39(6): 286-289.
[4] Cotard J P, Gruet P, Pechereau D,etal. Comparative study of marbofloxacin and amoxicillin-clavuanic acid in the treatment of urinary tract infection in dogs [J]. J Small Anim. Pract, 1995,36(8): 349-353.
[5] Gruet P, Richard P, Thomas E,etal. Prevention of surgical infection in dogs with single intravenous injection of marbofloxacin: an experimental model[J]. Vet. Pec, 1997, 22: 199-202.
[6] E Thomas, A Madelenat, P Gruet, P. Pommier, S. Wessel-Robert und P. Le Coz Wirksamkeit und Unschädlichkeit einer 10%igen Marbofloxacin-Lösung im Vergleich mit Amoxicillin bei der Behandlung des MMA-Syndroms bei Sauen Praktischer Tierarzt. 2000, 81(8):654-662.
[7] Thomas E, Grandemange E, Pommier P,etal. Field evaluation of efficacy and tolerance of a 2% marbofloxacin injectable solution for the treatment of respiratory disease in fattening pigs[J]. Vet Q,2000,22(3): 131-135.
[8] E Thomas, G L Caldow, D Borell,etal. A field comparison of the efficacy and tolerance of marbofloxacin in the treatment of bovine respiratory disease[J]. Journal of Veterinary Pharmacology.and.Therapeutics,2001,24(5): 353-358.
[9] 李兴明.母猪产后子宫炎, 乳房炎, 无乳综合症[J]. 青海畜牧兽医杂志, 2014, (1): 6-9.
[10]刘东军.母猪产后泌乳障碍综合症的病因及防治措施[J]. 吉林畜牧兽医,2009, 30(2): 21-22.
[11]胡功政, 陈学周.麻波沙星对犬猫分离菌的抗菌活性[J]. 国外兽医学—畜禽疾病, 1996, 17(3): 46-48.
[12]张玲玲, 赵杰, 郭宽,等. 国产麻保沙星的毒性及体外抗菌活性研究[J]. 西北农林科技大学学报, 2009, 37(7): 16-22.
[13]王令, 曾振灵, 陈杖榴,等.麻保沙星对鸡实验性葡萄球菌病的药效学研究[J]. 中国预防兽医学报, 2002, 24(5): 380-383.
[14]刘宇, 陈琳,黄群山,等. 母猪产后子宫炎- 乳房炎- 无乳综合症[J]. 广东畜牧兽医科技,1999, 24 (3): 6-9.
[15]杜冬冬. 一株猪源大肠杆菌的分离鉴定及耐药性分析[D]. 泰安:山东农业大学, 2012.
[16]邵士慧, 李槿年, 王评评,等. 猪源致病性金黄色葡萄球菌的分离鉴定及其耐药性分析[J]. 中国微生态学杂志, 2010,4: 308-311.
[17]李彩英, 岳修伟, 侯怡轩,等. 上海地区31株2型猪链球菌的分离鉴定及其耐药性分析[J]. 中国动物传染病学报, 2011, 6: 54-59.
[18]陈军, 张淑华. 氟喹诺酮类抗菌药马波沙星的研究进展[J]. 中国兽药杂志,2006, 12: 38-43.
[19]Bousquet-Melou A, Bernard S, Schneider M,etal. Pharmacokinetics of Marbofloxacin in Horses [J]. Equine Vet J, 2002, 34(4): 366-372.
[20]Schneider M, Valle M, Woehrle F,etal. Pharmacokinetics of Marbofloxacin in Lactating Cows after Repeated Intramuscular Administrations and Pharmacodynamics Against Mastitis Isolated Strains[J]. J Dairy Sci, 2004, 87(1): 202-211.
[21]Dinh N L, Belloc C, Pellerin J L,etal. Levels of Quinolone Resistance in Escherichia Coli from Faecal Flora of Pigs[J]. RevueMed Vet, 2004, 155(8/9): 422-426.
[22]Kroemer S1, Galland D, Guérin-Faublée V,etal. Survey of marbofloxacin susceptibility of bacteria isolated from cattle with respiratory disease and mastitis in Europe[J]. Vet Rec,2012,170(2):53-55.
(编辑:侯向辉)
inVitroAntibacterial Activities of Marbofloxacin against Bacterial Strains Isolated from Swine
YUE Yong-bo1,WU Hao-ting2,LIU Bo1,FAN Xiao-ping3,YANG Fang1,WANG Cheng-bin1
(1.BaodingJizhongPharmaceuticalCoLtd,Engineering﹠TechnologyResearchCenterofTraditionalChineseVeterinaryMedicineofHebeiProvince,Baoding,Hebei071500,China;2.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China;3.HainanProvincialInstituteofVeterinaryDrugandFeedControl,Haikou570203,China)
To study theinvitroantibacterial activity of marbofloxacin against bacterial strains isolated from swine and provided scientific evidence for clinical use,theinvitroantibacterial activities of marbofloxacin were examined by agar dilution method with clinical isolated bacterial strains from swine, compared with oxytetracycline, enrofloxacin, norfloxacin, ciprofloxacin, gentamycin and doxycycline. Result showed that marbofloxacin had low MIC against clinical isolatedEscherichiacoli,Staphylococcusaureusandstreptococcusstrains. Marbofloxacin had superior antibacterial activities against clinical isolatedEscherichiacoli,Staphylococcusaureusandstreptococcusstrains compared with norfloxacin, ciprofloxacin, gentamicin and doxycycline, and better than enrofloxacin againstEscherichiacoli. Marbofloxacin had good antibacterial activities against main bacterial strains cause MMA than commonly used antibacterial agents.
marbofloxacin;invitroantibacterial activities; MIC; clinical isolated bacterial strains
岳永波,正高级工程师,从事兽用新药研究。E-mail:2403675478@qq.com
2016-07-13
A
1002-1280 (2016) 10-0032-04
S859.796

