一株猪流行性腹泻病毒的分离鉴定和遗传进化分析
孙丰廷,史红丽,高小聪,杜恩岐
(1.陕西诺威利华生物科技有限公司,陕西杨凌 712100;2.北京康宝利华生物科技有限公司,北京 100176;3.南通市动物疫病预防控制中心,江苏南通 226000;4.西北农林科技大学,陕西杨凌 712100)
一株猪流行性腹泻病毒的分离鉴定和遗传进化分析
孙丰廷1,史红丽2,高小聪3,杜恩岐4*
(1.陕西诺威利华生物科技有限公司,陕西杨凌 712100;2.北京康宝利华生物科技有限公司,北京 100176;3.南通市动物疫病预防控制中心,江苏南通 226000;4.西北农林科技大学,陕西杨凌 712100)
从陕西地区26个疑似猪流行性腹泻病毒感染的猪场,采集发病仔猪的肛门拭子、粪便以及死亡仔猪的小肠,将其接种于Vero细胞,在添加胰酶的情况下,连续传代培养并观察,直至细胞出现典型的合胞体病变,经RT-PCR检测、测序、基因比对分析与动物回归实验,最终确定分离到一株PEDV病毒强毒株。经过测定毒株的S基因序列,进行序列比对分析和遗传进化分析,发现本次分离到的毒株与疫苗株CV777同源性较低,进化分支位于目前流行的PEDV G2a亚群。
猪流行性腹泻病毒;分离鉴定;S基因
1973年猪流行性腹泻(Porcine Epidemic Diarrhea, PED)在中国上海首次发生,直到1984年才明确其病原体为猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus, PEDV)[1]。2010年末开始我国东南沿海地区暴发PED并扩散至全国各地,主要以高发病率和高死亡率为特征[2-4]。近年来由PEDV引起的猪流行性腹泻(PED)对养猪产业造成了巨大损失,饲养管理不当非常容易导致PEDV的暴发,由于其临床症状与猪传染性胃肠炎(Transmissible Gastroenteritis of Swine,TGE)等肠道疾病类似,临床诊断比较困难。PEDV可感染各种年龄段的猪,以呕吐、腹泻及脱水为主要临床特征,该病主要发生于冬季,夏秋季节也可发生,造成养猪业严重经济损失[5-6]。S基因易发生变异,因此常被用来研究不同年代和地点毒株之间的亲缘关系,本研究对2013年9月12日从陕西26个猪场疑似PEDV样品分离到一株病毒,经鉴定确认为PEDV,对毒株病毒的S基因进行同源性与遗传进化分析,为疫苗研发提供了理论依据[7]。
1 材料与方法
1.1 病料与细胞 从陕西地区26个疑似猪流行性腹泻病毒感染的猪场采集病料大约380份,包括仔猪的肛门拭子、粪便以及死亡仔猪的小肠等。Vero细胞(非洲绿猴肾细胞)购自中国兽医药品监察所。
1.2 主要试剂 RNA提取试剂盒,购自OMEGA公司;Oligo(dt)、M-MLV反转录酶、Taq 酶等购自TaKaRa公司;胎牛血清与DMEM培养基,购自Hyclone公司;胰酶,购自Sigma公司。国内外建立了各种RT-PCR方法检测PEDV,大部分针对保守的M基因[8],引物:检测引物与S基因引物序列参考何振洋硕士论文[9],P EDV检测引物目的片段大小645~647 bp,猪轮状病毒(Porcine Rotavirus PoRV)检测引物目的片段大小309 bp,猪传染性胃肠炎病毒(TGEV)检测引物目的片段大小528 bp检测引物,由上海Invitrogen公司合成。
1.3 病料处理 采集到的病料样品按照1∶10的比例加入PBS缓冲液,进行研磨处理,反复冻融三次后,使用3000 r/min离心15 min,取上清液经0.22 μm微孔滤膜过滤,滤液分装,-80 ℃保存。
1.4 RT-PCR检测 取病料处理后的上清液,使用RNA提取试剂盒提取病毒RNA,使用随机引物和M-MLV酶反转录成cDNA,扩增条件为:42 ℃反应 60 min,72 ℃ 15 min。以cDNA 为模板,检测引物进行PCR扩增,循环参数:94 ℃预变性 3 min,94 ℃变性1 min,56 ℃退火45 s,72 ℃延伸1 min,共35个循环,72 ℃延伸 10 min。PCR 产物进行电泳检测(表1)。

表1 本研究用到的检测引物与测序引物
1.5 病毒的分离 按常规方法传代Vero 细胞,培养 48 h至单层,按10%接种检测阳性的病毒液,并添加胰酶至终浓度 10 μg/mL,37 ℃吸附1 h ,其间轻摇2次。待吸附结束后,加入含有终浓度 10 μg/mL胰酶的DMEM 溶液作为维持液,置于37 ℃ 5% CO2培养箱培养,72 h后收毒。将收毒后的病毒液反复冻融 3 次,按上述方法进行盲传下一代,直至出现细胞病变。
1.6 病毒的鉴定 细胞毒RT-PCR的鉴定:将细胞培养物在-80 ℃冻融3次,提取RNA进行RT-PCR检测,具体方法同1.4项。
细胞病变观察:病毒接种细胞后盲传几代会出现细胞病变,用倒置显微镜能观察到明显的细胞病变同时记录病变情况。
动物回归实验:用Vero F5代细胞毒灌胃接种5日龄抗原抗体阴性未吸初乳仔猪3只,1 mL每头份,每日观察临床症状。
1.7 病毒基因组核酸序列分析 核酸提取与反转录:根据试剂盒的说明书进行,反应程序为42 ℃1 h,70 ℃15 min,完成后-20 ℃冻存备用。20 μL反转录体系:RNA 12 μL,5×Reaction Buffer 4 μL,10 mM dNTPs 1 μL,随机引物(10 mmol/L)1 μL,M-MLV反转录酶1 μL,RNase Inhibitor 1 μL。
RT-PCR产物电泳检:取10 μL扩增的RT-PCR产物进行琼脂糖凝胶电泳,在凝胶成像系统中进行观察有无特异性条带,阳性条带产物送大连宝生物公司进行测序。50 μL RT-PCR反应体系:cDNA 2 μL,10×Buffer 5 μL,10 mM dNTPs 2 μL,上、下游引物(10 mmol/L)各1μL,Taq酶1 μL,ddH2O 38 μL。
序列比对分析:使用MEGA5.5软件分析S基因,对本次PEDV毒株进行遗传进化分析。
2 结果与分析
2.1 PEDV的分离及在Vero细胞中的传代培养 将处理后病料上清接种Vero细胞后,F3代开始出现细胞脱落等明显细胞病变,连续传至F10代病变出现时间稳定(图1)。
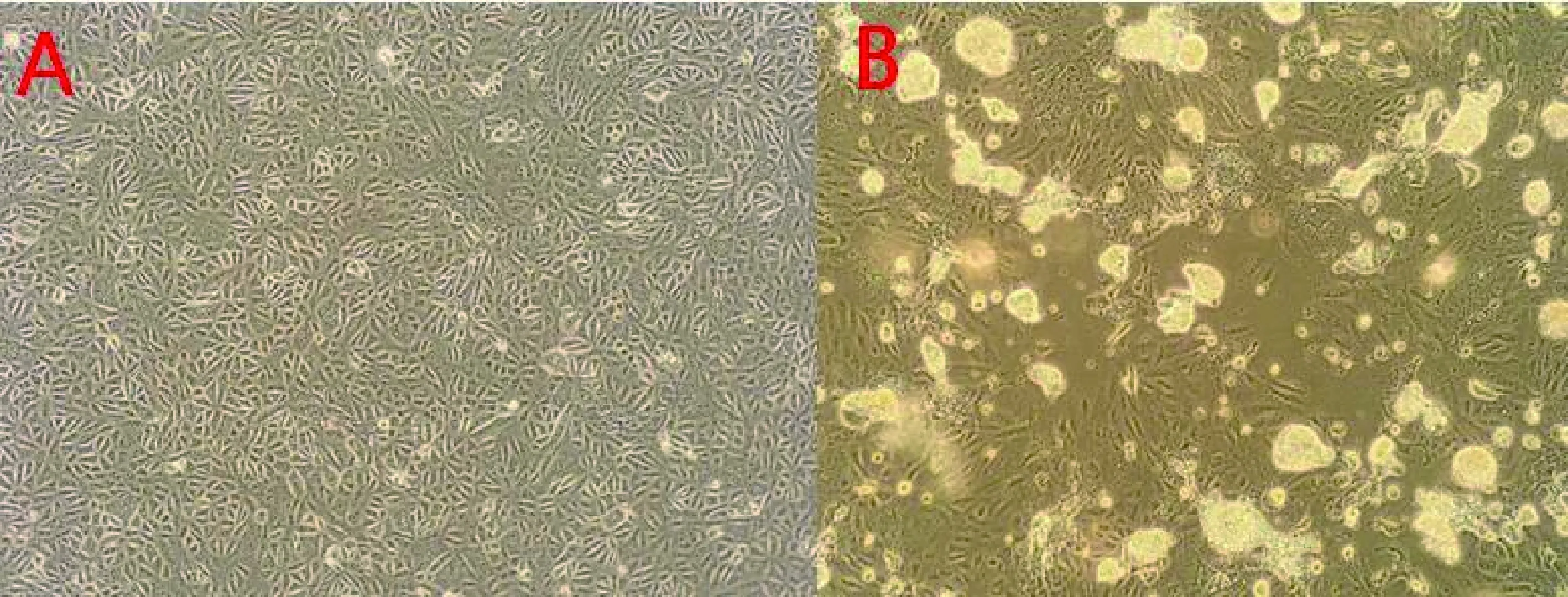
图1 A为正常Vero细胞,B为PEDV感染后48 h的Vero细胞(200×)
2.2 PCR鉴别检测 用PEDV的引物PEDV-F/R进行PCR 扩增,粪便样品均可以扩增到一条645 bp左右的特异性条带。TGEV 和PoRV 的引物均没有扩增出特异条带(图2),PEDV S基因扩增见图3。
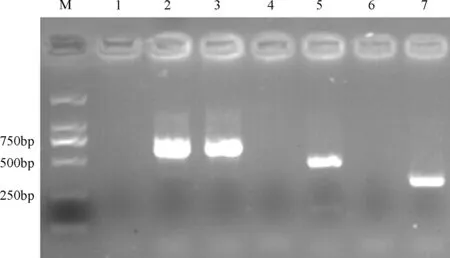
M: Marker DL2000;1.PEDV阴性对照;2.PEDV阳性对照;3.PEDV样品;4.TGEV阴性对照;5. TGEV阳性对照;6.PoRV阴性对照;7.PoRV阳性对照图2 鉴别检测PCR结果的电泳图

图3 S基因测序引物扩增结果的电泳图(M: Marker DL2000;1.阴性对照;2~5分别为覆盖S基因的四个片段(S1~S4))
2.3 动物回归试验 接种动物后24 h发病,出现呕吐、腹泻,48 h出现明显消瘦(图4),48~72 h出现死亡,解剖观察胃、小肠粘膜病变,胃内有大量白色未消化食物,胃壁出现溃疡、出血、坏死、小肠充血鼓气,肠壁变薄,肠黏膜脱落见图4,并于3~4 d全部死亡,表明通过细胞培养获得的PEDV对乳猪有较强的感染性,病毒分离成功。2.4 序列比对分析 选取不同亚群代表性毒株的S基因,推导氨基酸序列,根据推导的氨基酸序列进行同源性比对分析,KB2013-4与2011-2014年中国分离毒株(JS-HZ2012、BJ-2011-1、CHZJCX-12012、CPGEN-20140427)、美国毒株USA-Colorado-2013、中国分离毒株GD-B同源性较高,分别为99.5%、99.4%、99.4%、99.1%、99.3%、99.1%,与比利时疫苗株CV777、韩国毒株(atternuated DR13、SM98)、中国分离株AH-M同源性较低,分别为9%、8.5%、10.7%、8.5%(表2)。
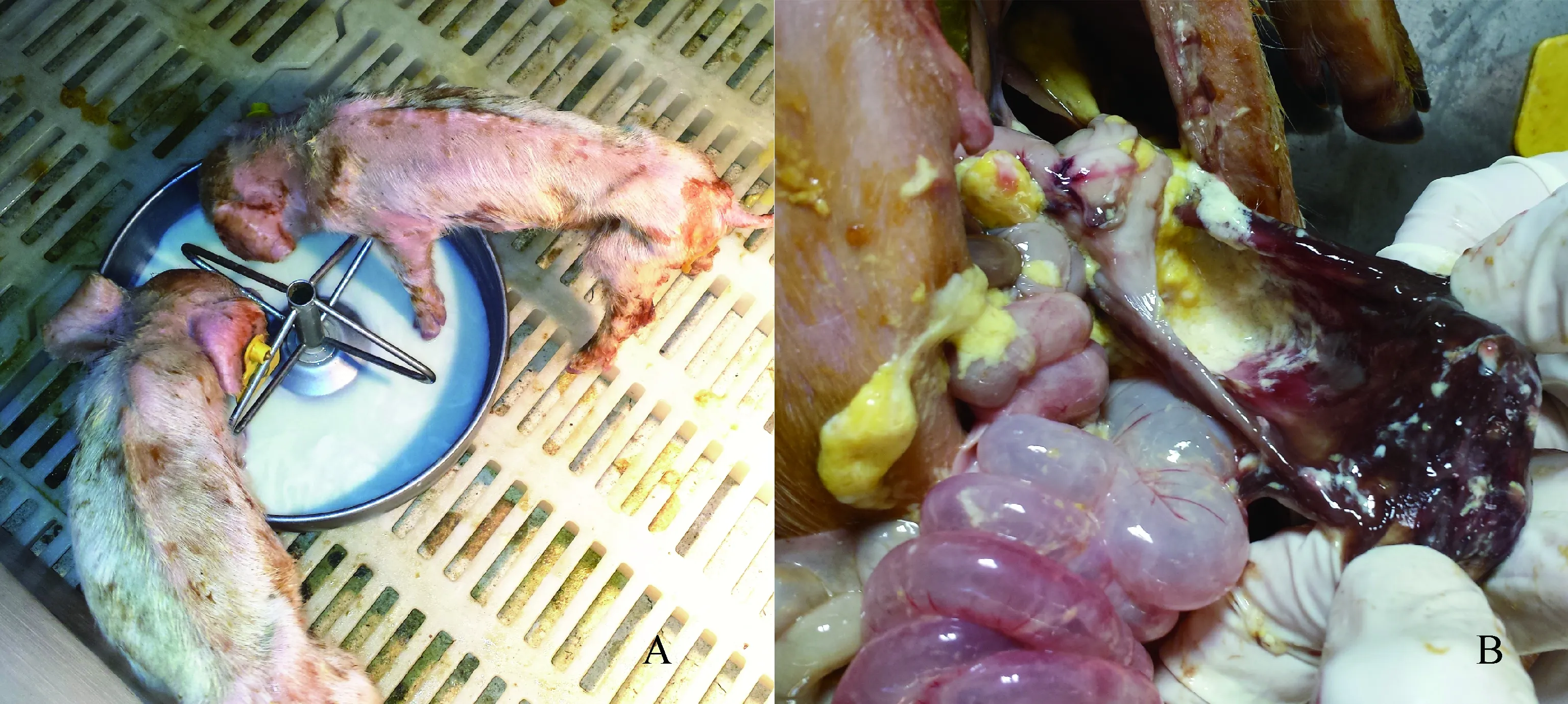
A: 乳猪接种KB2013-4毒株后第2天,出现明显消瘦;B: 乳猪接毒后第3天死亡,剖检可见小肠壁明显变薄,胃内容物为乳糜样图4 仔猪接种PEDV KB2013-4株后临床剖解图片

表2 各群代表毒株之间S蛋白氨基酸序列比较
比较G2a亚群中毒株氨基酸变化发现,KB2013-4毒株没有插入或缺失氨基酸,但存在四个氨基酸突变,分别为389位 A→S,503位 T→A,1009位N→S,1109位Q→R。
2.5 遗传进化分析 基于PEDV S基因进行遗传进化分析,可以看出,PEDV的亚型众多,主要可分为G1亚型与G2亚型,而G1与G2又可细分为G1a、G1b、G2a、G2b与G2c,此外还存在一些特殊变异的毒株亚型,比如重组的毒株与存在插入和缺失突变的毒株(INDEL, insertion and deletion)。从图5可以看出KB2013-4 株属于G2a亚型,与AH2012株属于同一亚型。
3 讨论与小结
猪流行性腹泻病毒是猪场发生流行性腹泻疾病的主要病原之一,对规模化养殖带来巨大经济损失,此外免疫系统抑制病病毒如PCV2、PRRSV也是导致PED控制难度增加的重要因素。目前,PED的防控主要靠PED-TGE二联苗免疫。但是,随着病毒的变异和进化,现有疫苗免疫保护力呈下降趋势。为防控猪流行性腹泻疫病,研究安全、有效的疫苗刻不容缓。
细胞培养PEDV难度高,本实验在Vero细胞培养液中加入终浓度10 μg/mL的胰酶,从猪腹泻粪便中分离出一株PEDV。并通过PT-PCR、细胞培养、动物回归试验等多种方法对该分离病毒进行鉴定,结果表明,此分离株为猪流行性腹泻病毒。通过对测序结果的遗传进化分析, 发现M基因比较保守,是研究PEDV遗传演化的优先选择基因。有研究表明PEDV的变异主要集中在S 基因上[10],该区核酸序列变异而引起氨基酸突变可能是病毒变异的主要原因。因此,比较不同病毒株PEDV S基因的亲缘关系,对疫苗的研制及使用具有重要的意义。
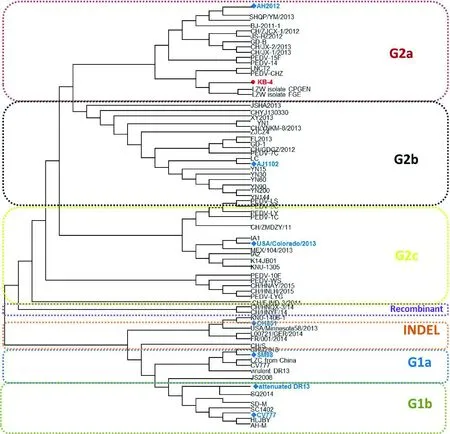
红色字体KB-4为本研究的分离株,蓝色字体毒株为各亚型的代表毒株图5 基于PEDV-S基因核苷酸序列的遗传进化分析
本研究分离的PEDV同时经过核酸序列分析及遗传进化树分析,发现分离毒株的S蛋白与疫苗株CV777同源性仅为9%,存在较大差异。而与JS-HZ2012毒株S基因同源性最高为99.5%,在遗传进化上属于当前流行毒株G2a亚群分支。因此,将其作为候选疫苗株,对于猪流行性腹泻防控具有重要的实践意义。
[1] Xuan H, Xing D, Wang D,etal. Study on the culture of PEDV adapted to fetal porcine intestine primary cell monolayer [J]. Chin J Vet Sci, 1984, 4: 202-208.
[2] Sun Rui-Qin, Cai Ru - Jian, Chen Ya - Qiang ,etal. Outbreak of porcine epidemic diarrhea in suckling piglets, China [J]. Emerging infectious diseases , 2012 , 18 (1) : 161-163.
[3] Zhou Yan-jun, Wu Yu-lu .Complete genome sequence of a virulent porcine epidemic diarrhea virus strain[J]. J Virol, 2012, 86: 138-162.
[4] Wen-tao Li,Heng Li,Yun-bo Liu,etal. New variants of porcine epidemic diarrhea virus,China, 2011 [J].Emerging infectious diseases, 2012 , 18 (8): 1350-1353.
[5] 殷震,刘景华. 动物病毒学(第二版)[M]. 北京:科学出版社,1997:688-690.
[6] 蔡宝祥. 动物传染学(第四版)[M]. 北京:中国农业出版社,2001:300-301.
[7] 李衡. 猪流行性腹泻病毒S、M、ORF3基因的克隆和序列分析[D].武汉:华中农业大学,2013:9.
[8] Kim O , Choi C , Kim B,etal.Detection and differentiation of porcine epidemic diarrhoea virus and transmissible gastroenteritis virus in clinical samples by multiplex RT - PCR [J]. The Veterinary record, 2000, 146 (22) : 637-640.
[9] 何振洋. 我国部分地区猪流行性腹泻病毒的分离与进化分析[D].杨凌:西北农林科技大学,2015:10.
[10]刘孝珍,陈建飞,时洪艳,等.2011年猪流行性腹泻病毒的遗传变异分析[J].中国预防兽医学报,2012,34(3):180-183.
(编辑:侯向辉)
Isolation and Identification of One Porcine Epidemic Diarrhea Virus Strains and Genetic Evolution Analysis
SUN Feng-ting1,SHI Hong-li2,GAO Xiao-cong3,DU En-qi4*
(1.ShaanxiNovaleverBiologicalTechnologyCoLtd,Yangling,Shaanxi712100,China;2.BeijingCanboleverBiologicalTechnologyCoLtd,Beijing100176,China;3.NantongAnimalDiseasePreventionandControlCenter,Nantong,Jiangsu226000,China;4.NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
The anal swab and feces for the onset of piglets, and dead piglets intestine were gathered from 26 pig farms which were suspected porcine epidemic diarrhea virus (PEDV) infection in Shaanxi area. Then the samples were subcultured by vero cell line in the case of adding the pancreatic enzyme, until the syncytial cells showed typical pathological changes. By methods of RT-PCR detection, sequence analysis, gene comparison and animal regression experiment, one PEDV virulent strain was confirmed. After sequence alignment analysis and genetic evolution analysis of S gene, results showed that there was low homology between the isolated strain and vaccine strains CV777, and evolutionary branch was located in the current popular PEDV G2a subgroup.
porcine epidemic diarrhea virus;isolation and identification;S gene
孙丰延,硕士,从事兽用生物制品研究。
2016-08-12
A
1002-1280 (2016) 10-0010-05
S852.65

