基于金纳米花表面增强拉曼散射光谱的三聚氰胺检测方法
吴一萍, 徐 钦, 马 俊, 杨海峰
(上海师范大学 生命与环境科学学院,上海 200234)
基于金纳米花表面增强拉曼散射光谱的三聚氰胺检测方法
吴一萍, 徐 钦, 马 俊, 杨海峰
(上海师范大学 生命与环境科学学院,上海 200234)
以罗丹明6G为探针分子,结合紫外-可见吸收光谱,优化了两种还原剂:抗坏血酸和盐酸羟胺的加入体积,确定了金纳米花的最佳合成条件.以制备的金纳米花为增强试剂,结合便携式拉曼光谱仪,建立了可用于三聚氰胺检测的分析方法.以679 cm-1处特征峰为定量依据,确定该方法线性检测范围为5~100 μmol/L,标准偏差R2=0.9875,检测限达到1 μmol/L,远低于国家标准(19.8 μmol/L).
金纳米花; 表面增强拉曼; 三聚氰胺
0 引 言
三聚氰胺(Melamine)简称三胺,又名蜜胺,氰尿三酰胺,是一种三嗪类含氮杂环有机化合物,纯品呈白色晶体粉末,具有D3h对称性.三聚氰胺由于具有不易燃,耐水、耐热、耐老化、耐电弧、耐化学腐蚀,绝缘性好,光泽度和机械强度佳等优良性能,而被广泛应用于木材、涂料、塑料、造纸、皮革、纺织、电气、医药等行业[1-2].此外,在部分亚洲国家三聚氰胺也被用于制造化肥.
自2007年3月起,陆续有报道在宠物食品,甚至婴儿奶粉中有三聚氰胺的检出[3].食品工业通常采用凯氏定氮法来估算蛋白质含量,即通过将含氮量乘以6.25得出蛋白质含量[4].三聚氰胺虽然没有任何营养价值,但含氮量很高,而凯氏定氮法在检测食品或饲料中蛋白质含量时不能排除这类“伪蛋白氮”的干扰.三聚氰胺自身毒性较小,几乎不能被机体所代谢,但容易吸附体内的草酸、鞣酸及钙等物质,形成结石,沉积在泌尿系统中.科学研究发现动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,如膀胱、肾结石,并可进一步诱发膀胱癌[5].
传统的可用于三聚氰胺检测的方法主要有苦味酸法、升华法和电位滴定法[6-7].近几年,随着仪器和分析技术的发展酶联免疫吸附、高效液相色谱、气相色谱-质谱、液相色谱-质谱/质谱、毛细管电泳-质谱以及近红外检测等技术也被应用于三聚氰胺的检测[1,8-12].其中,酶联免疫试剂盒法虽然操作简单,但特异性不强;色谱-质谱联用技术准确性虽高,但是样品预处理复杂、设备昂贵,且需要专业的操作人员.在拉曼光谱基础上发展起来的表面增强拉曼散射(SERS)光谱同样属于表面检测技术,它是指当一些分子吸附到经特殊处理或制备的粗糙金属或胶体表面(如金、银、铜等)时,它们的拉曼光谱信号强度会增加104~106倍[13-15].因此,SERS技术不仅继承了拉曼光谱提供分子结构信息、实现无损快速检测的优点,还有效解决了拉曼光谱在表面科学和衡量分析中存在的低灵敏度问题.目前,可作为SERS光谱的基底有很多,其中金属纳米粒子由于制备简单、增强效果好而被广泛应用.考虑到金属纳米粒子稳定性较差,很多工作报道通过加入表面活性剂或稳定剂的方式来提高纳米粒子的稳定性.但是稳定剂的加入可能会干扰目标样品的检测,从而引起不必要的误差.
本文作者在无任何表面活性剂的条件下可控合成干净、结构完美的金纳米花,将其作为表面增强试剂,结合便携式拉曼检测仪,建立了可以简单、快速有效检测三聚氰胺的分析方法.
1 实验部分
1.1 仪器与试剂
S-4800型扫描电子显微镜(日本Hitachi公司);H-600型透射电子显微镜(日本Hitachi公司);UV-1800型紫外-可见吸收光谱仪(日本岛津公司);便携式拉曼光谱仪(美国Enwave公司);Smart-P型纯水仪(中国力康公司);H-1850离心机型(中国湘仪公司).
罗丹明6G (美国Sigma公司);氯金酸、抗坏血酸和盐酸羟胺 (国药集团化学试剂有限公司);碳酸钾(上海润捷化学试剂有限公司);所用试剂均为分析纯;实验用水为力康超纯水系统制备的电阻率为18.2 MΩ·cm 的去离子水.
1.2 实验过程
1.2.1 金纳米花的合成
采用两步还原法可控合成金纳米花.首先室温搅拌条件下将1 mL 物质的量浓度为0.2 mol/L的碳酸钾加入到25 mL物质的量浓度为3× 10-4mol/L的氯金酸溶液中;然后加入5 μL物质的量浓度为10 mmol/L的抗坏血酸,持续搅拌5 min;之后快速加入1 mL物质的量浓度为10 mmol/L的盐酸羟胺,见溶液立即由明黄变为深蓝色,表明金纳米花形成.将所获溶液于离心机上以3 000 r/min转速离心6 min,除去上清,加入去离子水离心清洗两次,最后加入0.5 mL去离子水定容,形成的金纳米花溶胶在4 ℃下储存备用.
1.2.2 三聚氰胺的检测
取上述金纳米花溶胶5 μL,将5 μL不同浓度的三聚氰胺溶液加入到溶胶溶液中,于室温下孵育10 min,然后取出混合液,滴于干净的锡箔纸上,室温干燥,形成印环后检测拉曼信号.
1.2.3 拉曼光谱信号的采集条件
共聚焦拉曼采用波长为785 nm,激光功率为300 mW的激光作为光源,信号采集时间为1 s,累计扫描次数为3次,采谱范围500~2 000 cm-1.
2 结果与讨论
2.1 金纳米花合成条件的研究
首先,通过紫外-可见光谱考察了抗坏血酸(AA)和盐酸羟胺两种还原剂不同用量对最终合成的金纳米花尺寸的影响.在保证盐酸羟胺过量(1 500 μL,10 mmol/L)的条件下,金种子溶液的紫外-可见光谱随着抗坏血酸量的增大发生蓝移,且峰宽逐渐变窄,如图1(a)所示,表明最初由抗坏血酸还原产生的金种子随着抗坏血酸量的增加而减小,大小分布逐渐变的均匀.当抗坏血酸量固定为5 μL(物质的量浓度为10 mmol/L)时,金纳米花溶液的紫外-可见光谱先随着盐酸羟胺量的增大发生红移,如图1(b)所示,表明金纳米花不断长大,当盐酸羟胺的量到达1 000 μL后,基本保持不变.

图1 不同量还原剂下合成的金纳米花的紫外-可见吸收光谱.(a) NH2OH·HCl量固定(1 500μL,10 mmol/L);(b) AA量固定(5 μL,10 mmol/L)
图2是以罗丹明6G为拉曼探针,考察不同条件下合成的金纳米花的拉曼增强效果.结合图2(a)、(b)可以确定,当抗坏血酸的量为5 μL,盐酸羟胺的量为1 000 μL时所合成的金纳米花的增强效果最佳.该结果与上面紫外-可见吸收光谱相吻合,因此在接下来的研究中选择两种还原剂的用量分别为5 μL和1 000 μL.
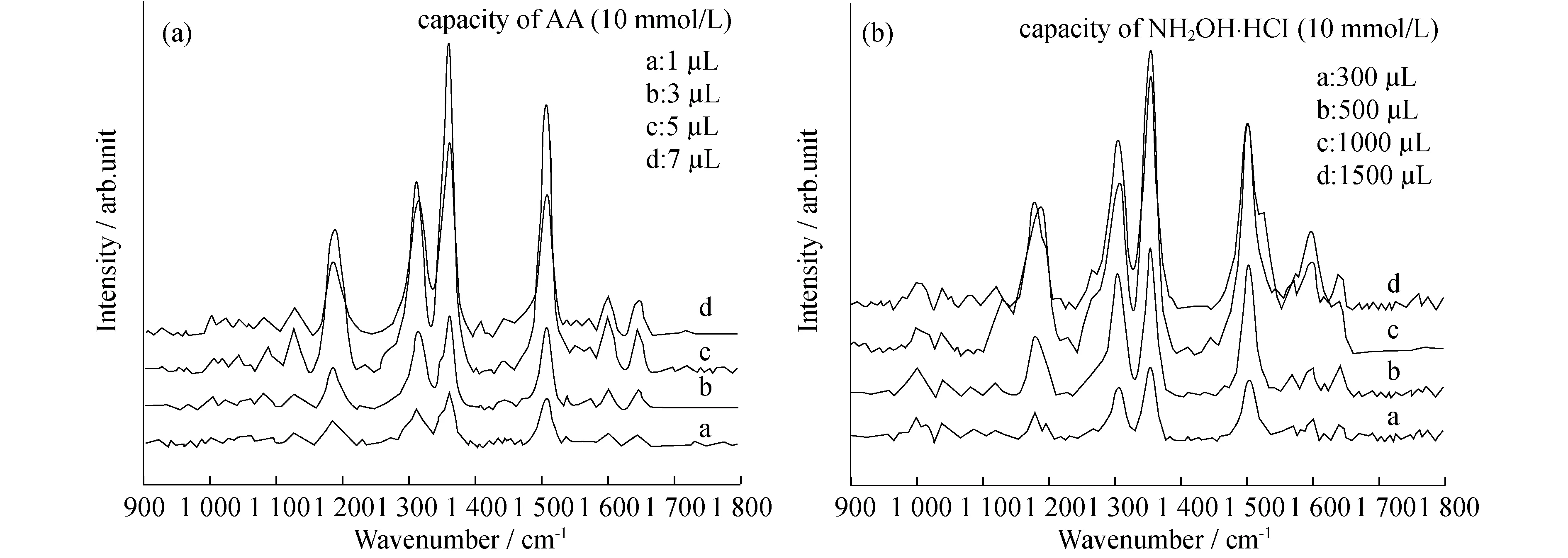
图2 不同基底上罗丹明6G (5× 10-7mol/L)的SERS光谱.(a)NH2OH·HCl量固定 (1 500 μL,10mmol/L);(b) AA量固定(5 μL,10 mmol/L)
2.2 金纳米花的表征
图3为金纳米花的扫描电子显微镜(SEM)图和透射电子显微镜(TEM)图.从图3可以看出,虽然没有加任何表面活性剂,但所合成的金纳米粒子呈三维的花状结构,每个纳米粒子所含有的花瓣数有差异,但整体粒径分布均匀,直径约80 nm.与金纳米粒子比,该花状结构不仅提供更大的比表面,有效增加基底与待测物的接触,还有利于不同粒子之间形成针尖效应,大大提高基底的增强效果.因此,可以预计所合成的金纳米花基底可以很好地应用于三聚氰胺的检测.
2.3 金纳米花对罗丹明6G增强效果的考察
图4为不同浓度的罗丹明6G在金纳米花上的拉曼响应,可以看到基线响应平整,表明所合成的金纳米花基底很干净,这与没有使用任何表面活性剂有关;随着罗丹明6G浓度的升高,1 300~1 400 cm-1处的两个特征峰不断增强,该基底最终可以检测到的罗丹明6G物质的量浓度为5×10-8mol/L,对应的增强因子约为1.8×105.

图3 金纳米花表征图.(a)SEM;(b)TEM
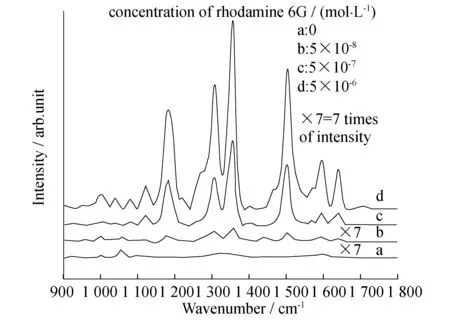
图4 不同物质的量浓度罗丹明6G的表面增强拉曼光响应
2.4 三聚氰胺的测定
在最优化的实验条件下进行三聚氰胺的定量检测.图5为加入不同浓度三聚氰胺的拉曼光谱图.由图5可见,从下到上,随着三聚氰胺浓度的增加,679 cm-1处特征峰的强度也随之增强.以三聚氰胺的物质的量浓度为横坐标,679 cm-1处的峰高为纵坐标进行数据处理拟合发现,所得的检测线并非线性(图6).当三聚氰胺的物质的量浓度为1×10-4mol/L时,出现一个平台,这可能与待测分子在基底表面吸附饱和有关.如果将所得数据进行部分拟合,发现在5~100 μmol/L范围内,三聚氰胺的浓度和拉曼峰高呈良好的线性关系,且线性相关系数R2=0.9875.取10 μL 三聚氰胺探针溶液,拉曼测试10次,利用3倍信噪比求得该检测体系的检测限(LOD)为1 μmol/L,低于国家奶制品标准(19.8 μmol/L).
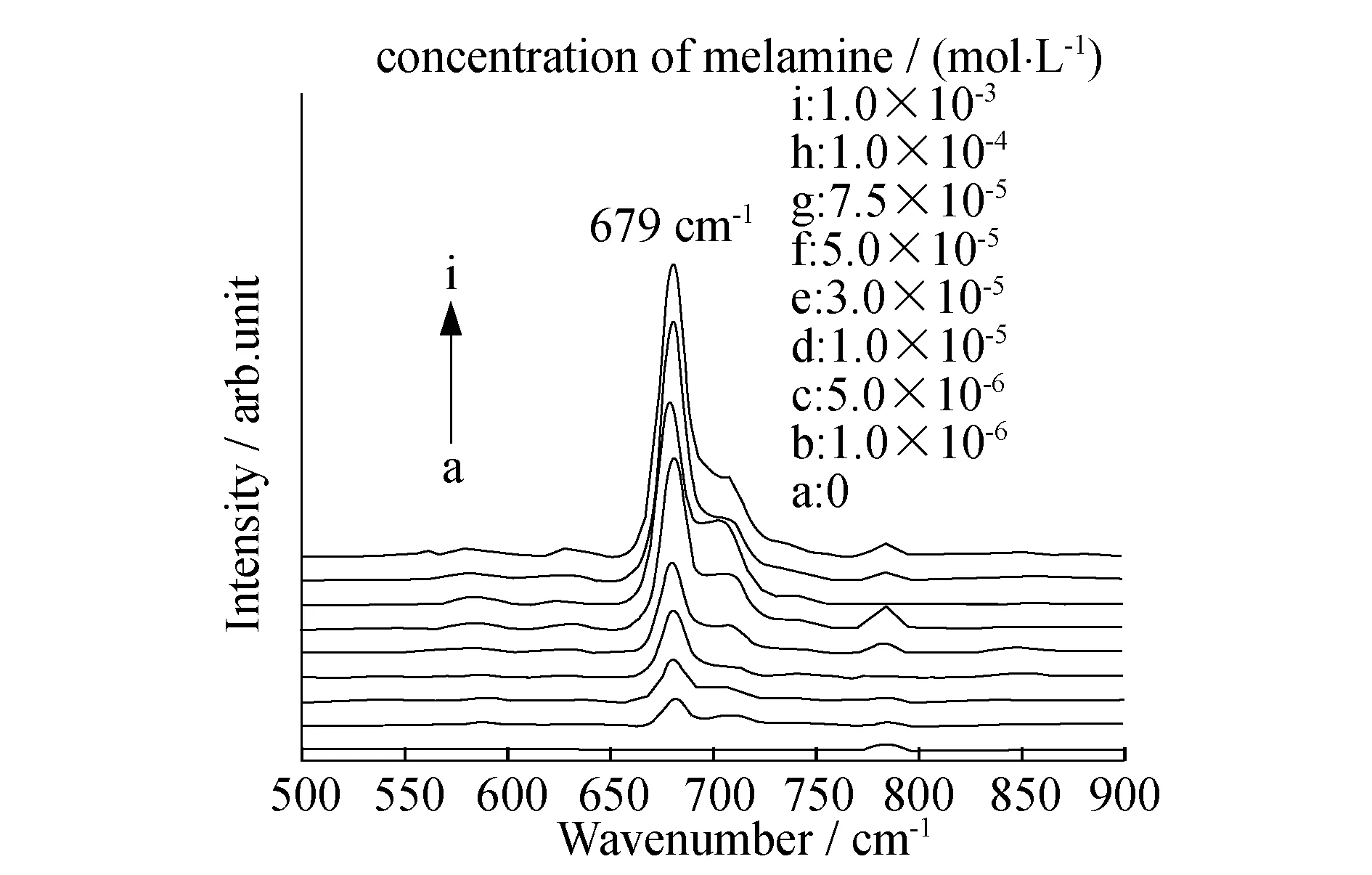
图5 不同物质的量浓度三聚氰胺的表面增强拉曼光响应
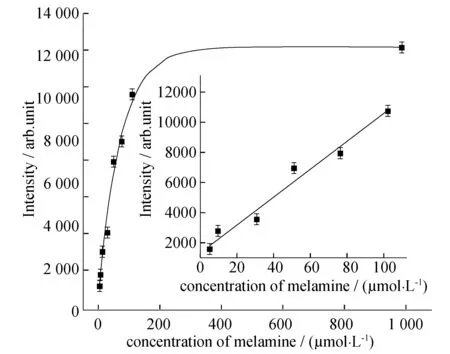
图6 三聚氰胺物质的量浓度与拉曼光强关系曲线(内插图为线性范围)
3 小 结
在不使用任何表面活性剂的条件下通过两步还原法室温快速制备了粒径均匀的金纳米花;以罗丹明6G为拉曼探针,考察所合成的金纳米花的拉曼增强效果,发现它对罗丹明6G的增强因子为1.8×105.结合便携式拉曼光谱仪,建立了可用于三聚氰胺检测的分析方法,确定该方法线性检测范围为5~100 μmol/L,标准偏差R2=0.9875,检测限达到1 μmol/L.该方法适用于对三聚氰胺的定量测定,具有较好的应用前景.
[1] Mauer L J,Chernyshova A A,Hiatt A,et al.Melamine detection in infant formula powder using near and mid-infrared spectroscopy [J].Journal of Agricultural and Food Chemistry,2009,57(10):3974-3980.
[2] Wu H N,Li H Y,Chua F Z H,et al.Rapid detection of melamine based onimmunoassay usingportable surface plasmon resonance biosensor [J].Sensors and Actuators B:Chemical,2013,178:541-547.
[3] 王征.GC-MS法测定动物食品中的三聚氰胺 [J].福建分析测试,2008,17(2):1-2.
Wang Z.Determination of melamine and the related analogs inanimalfood by gas chromatography-mass spectrometry [J].Fujian Analysis and Testing,2008,17(2):1-2.
[4] 焦嫚,董学芝.三聚氰胺分析检测方法的研究进展 [J].化学研究,2010,21(1):91-95.
Jiao M,Dong X Z.Research progress in analysis and test methods for melamine [J].Chemical Research,2010,21(1):91-95.
[5] 孙贵朋,谢云飞,陏丽敏,等.三聚氰胺的危害及其检测 [J].上海食品药品监管情报研究,2008,94(5):42-47.
Sun G P,Xie Y F,Sui L M,et al.Damage and detection of melamine [J].Shanghai Food and Drug Information Research,2008,94(5):42-47.
[6] 全国化学标准化技术委员会.工业三聚氰胺:GB/T 9567-1997[S].北京:中国标准出版社,1998:4.
[7] 袁立勇,马朝卫,杜亚辉.溶液中三聚氰胺含量的快速测定 [J].河南化工,2004(4):42.
Yuan L Y,Ma C W,Du Y H.Rapid determination of melamine in solution [J].Henan Chemical Industry,2004(4):42.
[8] Lei H T,Su R,Haughey S A,et al.Development of a specifically enhanced enzyme-linked immunosorbent assay for the detection of melamine in milk [J].Molecules,2011,16(7):5591-5603.
[9] Venkatasami G,Sowa J R.A rapid,acetonitrile-free,HPLC method for determination of melamine in infant formula [J].Analytica Chimica Acta,2010,665(2):227-230.
[10] Xu X M,Ren Y P,Zhu Y,et al.Direct determination of melamine in dairy products by gas chromatography/mass spectrometry with coupled column separation [J].Analytica Chimica Acta,2009,650(1):39-43.
[11] Yu H,Tao Y F,Chen D M,et al.Development of a high performance liquid chromatography method and a liquid chromatography-tandem mass spectrometry 66method with pressurized liquid extraction for simultaneous quantification andconfirmation of cyromazine,melamine and its metabolites in foods of animalorigin [J].Analytica Chimica Acta,2010,682(1-2):48-58.
[12] Thanh V T D,Himmelsbach M,Haunschmidt M,et al.Improved analysis of melamine-formaldehyde resins by capillary zoneelectrophoresis-mass spectrometry using ion-trap and quadrupole-time-of-flight mass spectrometers [J].Journal ofChromatography A,2008,1213(1):83-87.
[13] Kneipp K,Haka A S,Kneipp H,et al.Surface-enhanced Raman spectroscopy in single living cells using gold nanoparticles [J].Applied Spectroscopy,2002,56(2):150-154.
[14] He L L,Liu Y,Lin M S,et al.Detecting single Bacillus sporesby surface enhanced Raman spectroscopy (SERS) [J].Sensing and Instrumentation for Food Quality and Safety,2008,247(2):66-71.
[15] Wang H,Guo X Y,Fu S Y,et al.Raman probing trace melamine in milk by a functionalized test paper [J].Sensors and Actuators B:Chemical,2014,193:630-636.
(责任编辑:顾浩然,郁 慧)
SERS-active gold nanoflower combined with a portable Raman spectrometer for rapid detection of melamine
WU Yiping, XU Qin, MA Jun, YANG Haifeng
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
A simple,rapid,sensitive determination method based on surface enhanced Raman scattering effect of gold nanoflowers for melaminewas developed.The gold nanoflowers with the highest enhancement factor (EF) value for rhodamine 6G weresynthesized with 5 μL ascorbic acid and 1 000 μL hydroxylamine hydrochlorideunder mild condition without any surfactants as template.The characteristic Raman peak of melamine is at 679 cm-1.It was found that the Raman intensity of the characteristic peak increased with the increase of melamine concentration.Hence,the qualitative and quantitative detection for melaminecould be achieved.The linear range of melamine detection was 5~100 μmol/L with the standard deviationR2=0.9875.The limit of detection (LOD) reached 1 μmol/L,which is much lower than that in the National dairy products standard (19.8 μmol/L).
gold nanoflower; surface-enhanced Raman spectroscopy; melamine
2016-09-22
国家自然科学基金(21475088,21507087);上海市扬帆计划(15YF1409000)
吴一萍,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:yipingwu@shnu.edu.cn
O 652.1
A
1000-5137(2016)06-0693-06

