铜绿假单胞菌耐药性检测及整合子分布
于魁魁,谢 凯
(徐州市中心医院检验科,江苏徐州 221100)
铜绿假单胞菌耐药性检测及整合子分布
于魁魁,谢凯△
(徐州市中心医院检验科,江苏徐州 221100)
摘要:目的了解临床分离铜绿假单胞菌(PA)的耐药特征及耐药整合子分布,探讨整合子携带与耐药的关系。方法收集并保存该院临床分离的非重复PA菌株260株;药物敏感试验采用纸片法(K-B法);药物敏感结果统计分析采用WHONET5.0软件;整合子检测采用聚合酶链式反应(PCR)方法。结果临床分离的260株PA菌株对14种抗菌药物耐药率由低到高依次为:亚胺培南(18.5%)、阿米卡星(18.8%)、头孢吡肟(20.3%)、哌拉西林/他唑巴坦(21.5%)、头孢他啶(22.6%)、氨曲南(31.9%)、妥布霉素(31.9%)、头孢哌酮(38.1%)、庆大霉素(38.8%)、哌拉西林(41.9%)、环丙沙星(49.2%)、头孢噻肟(61.9%)和磺胺甲噁唑/甲氧苄啶(70.4%);检出Ⅰ类整合子阳性菌株109株(41.9%),Ⅱ类整合子4株(1.5%),未检测出Ⅲ类整合子;发现除多黏菌素外,Ⅰ类整合子检测阳性菌株对不同种类抗菌药物的耐药率明显高于Ⅰ类整合子检测阴性菌株,差异有统计学意义(P<0.05)。结论该地区临床分离PA菌株携带整合子类型为Ⅰ、Ⅱ型,菌株携带整合子与该地区PA耐药密切相关。
关键词:铜绿假单胞菌;整合子;耐药性
铜绿假单胞菌(PA)是引起医院内感染的重要条件致病菌之一。近年来随着抗菌药物的广泛使用,特别是抗菌药物的不合理使用,PA的耐药性逐渐增加,多重耐药形式也十分严峻,给临床抗感染治疗造成极大的困难。PA的耐药机制较为复杂,除其本身表现出对多种抗菌药物天然耐药外,该菌也可以通过一些基因水平传播元件的参与,从而迅速获取外界耐药基因。整合子是近年来发现的一组基因水平转移元件,与PA耐药的形成密切相关。目前已经出现3种类型的耐药整合子,其中Ⅰ和Ⅱ类整合子最为普遍,且与临床的关系也最为密切[1-2]。为了解整合子携带与PA耐药的关系,本研究对本地区临床收集的260株PA菌株的耐药性及整合子加以检测,现报道如下。
1材料与方法
1.1菌株来源本院2013年7月至2014年6月临床分离非重复PA菌株260株,其中分离自痰液标本198株(76.15%),尿液标本23株(8.85%),血液标本10株(3.85%),引流液标本10株(3.85%),分泌物标本5株(1.92%),其他种类标本14株(5.38%)。
1.2方法
1.2.1细菌鉴定采用法国生物梅里埃公司VITEK2 Compact全自动细菌鉴定系统进行菌株的鉴定。
1.2.2药物敏感试验药物敏感试验采用纸片扩散法(K-B法),结果判读参照美国临床实验室标准化协会(CLIS)2010年标准[3]。共测试14种抗菌药物,包括哌拉西林(PRL,30 μg)、头孢哌酮(CFP,75 μg)、头孢他啶(CAZ,30 μg)、头孢噻肟(CTX,30 μg)、头孢吡肟(FEP,30 μg)、亚胺培南(IPM,10 μg)、氨曲南(ATM,30 μg)、哌拉西林/他唑巴坦(TZP,100 μg/10 μg)、阿米卡星(AK,30 μg)、庆大霉素(GEN,10 μg)、妥布霉素(TOB,10 μg)、环丙沙星(CIP,5 μg)、多黏菌素(PB,300 U)和磺胺甲噁唑/甲氧苄啶(SXT,1.25 μg/23.75 μg)。质控菌株大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853,均来自江苏省临床检验中心。
1.2.3整合子基因检测细菌模板提取采用煮沸方法。引物设计参照文献[4],见表1。引物由上海英骏公司负责合成。聚合酶链式反应(PCR)产品购自大连宝生生物公司。整合子基因PCR反应体系为50 μL,包括10×PCR反应缓冲液5.0 μL、dNTP 4.0 μL、引物各1 μL、模板2 μL、Taq酶1 μL,最后加蒸馏水至50 μL。PCR反应参数:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,反应35个循环,最后72 ℃延伸7 min。1%的凝胶电泳,紫外灯下观察结果。

表1 整合酶基因检测所需的引物序列
1.3统计学处理药敏结果中介归于耐药,并将药敏结果输入WHONET5.0软件进行分析,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1PA对14种抗菌药物的耐药性260株PA对CTX和SXT的耐药率高(均大于60%),对IPM和AK的耐药率低(均小于20%),对PB全敏感。对其他种类抗菌药物的耐药率由低到高依次为:FEP(20.3%)、TZP(21.5%)、CAZ(22.6%)、ATM(31.9%)、TOB(31.9%)、CFP(38.1%)、GEN(38.8%)、PRL(41.9%)及 CIP(49.2%)。见表2。

表2 PA菌株对14种抗菌药物的耐药率(n=260)
2.2PA主要多重耐药模式以耐3种以上抗菌药物为多重耐药菌株,本次临床分离的PA菌株有123株呈多重耐药,多重耐药率为47.3%。多重耐药模式以对β-内酰胺类、氨基糖苷类及喹诺酮类抗菌药物同时耐药为主,共89株(34.2%)。
2.3Ⅰ、Ⅱ及Ⅲ类整合子分布260株PA共检出Ⅰ类整合子阳性菌株109株,检出率为41.9%;检出Ⅱ类整合子阳性菌株4株,检出率为1.5%,且4株Ⅱ类整合子阳性菌株同时也检出Ⅰ类整合子;未检出Ⅲ类整合子。Ⅰ、Ⅱ类整合子PCR结果,见图1、2。

图1 Ⅰ类整合子PCR检测结果
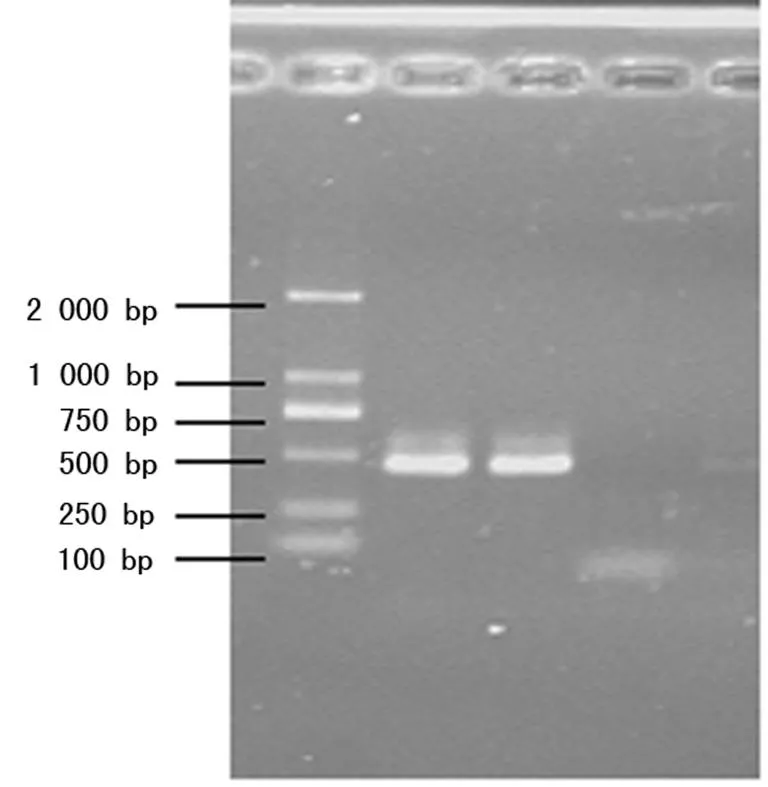
图2 Ⅱ类整合子PCR检测结果
2.4Ⅰ类整合子与PA菌株耐药的关系Ⅰ类整合子检测阳性PA菌株对不同种类的抗菌药物耐药率除PB外,均明显高于Ⅰ类整合子检测阴性的菌株,差异均有统计学意义(P<0.05)。见表3(见《国际检验医学杂志》网站主页“论文附件”)。
2.5Ⅰ类整合子与PA多重耐药的关系109株Ⅰ类整合子检测阳性PA菌株有87株呈多重耐药,多重耐药率为79.8%;151株Ⅰ类整合子检测阴性菌株有36株呈多重耐药,多重耐药率为23.8%。经χ2检验,两者多重耐药率差异有统计学意义(χ2=5.26,P<0.01)。
3讨论
β-内酰胺类抗菌药物具有抗菌谱广、抗菌能力强及不良反应少的优点,是治疗PA感染的首选药物。本次耐药检测结果显示,PA对此类药物的耐药率由低到高依次为IPM(18.5%)、FEP(20.3%)、TZP(21.5%)、CAZ(22.6%)、ATM(31.9%)、CFP(38.1%)、PRL(41.9%)、CTX(61.9%)。结果表明,PRL和CTX对PA的抗菌活性差,已不适于PA感染的常规治疗,而IPM仍显示出对PA良好的抗菌活性,可以用作治疗PA引起的重度感染的首选药物,其他种类药物可以依据药敏结果合理使用。本次检测IPM的耐药率为18.5%,略低于2010年中国东北、西南及华南地区耐药性监测结果[5-7],原因可能与各地区之间的药物使用差别有关。值得注意的是,绝大多数IPM耐药菌株呈现一定的泛耐药性,表现出对除PB外所有的抗菌药物耐药。结果提示此类菌株感染的治疗,临床可以选择的药物有限,因此加强泛耐药菌株流行趋势监测具有十分重要的意义。
氨基糖苷类抗菌药物是治疗革兰阴性杆菌感染的又一类强效药物,与β-内酰胺类抗菌药物联合使用可以产生强大的抗菌效果。近年来,PA对此类药物耐药率呈上升趋势。资料显示,1994~2008年,PA对AK的耐药率由11.0%上升至25.7%,对TOB的耐药率由17.7%上升至38.6%,对GEN的耐药率由42.1%上升至62.2%[8-9]。本次耐药检测结果显示,PA对AK、TOB及GEN的耐药率分别为18.8%、31.9%及38.8%。结果明显要低于上述耐药监测地区的报道,可能与地区间的用药习惯有关,细菌耐药存在明显的地区差异。本次检测PA对CIP的耐药率为49.2%,明显高于原卫生部全国细菌耐药监测网西北地区(19.7%)、华北地区(23.1%)、东北地区(27.0%)及西南地区(42.6%)耐药率的报道[5-7],结果可能与本地区CIP的使用量增加,导致PA耐药率上升有关。
PA耐药机制比较复杂,包括固有耐药机制及获得性耐药机制。PA固有耐药机制主要是由于其低渗透性能力外膜蛋白、染色体编码的AmpC酶及主动外排所介导。PA的获得性耐药机制则是通过自身基因组突变或者是通过水平获取外界耐药基因的方式获得对药物的耐药性,而后者是导致PA迅速耐药及耐药范围扩大最为直接的原因。在上述耐药性获取过程中,整合子起了重要作用。典型的整合子结构是由两端的保守区和中间可变区组成。保守区分5′端和3′端。5′端保守区域即整合酶活性区域,具有整合和切除耐药基因的功能;3′端保守区包含qacΔE和sul基因,分别编码对季铵盐化合物及磺胺的耐药[10];可变区是由一系列串联排列的耐药基因盒组成。整合子本身不可以移动,但是其常位于可移动基因元件如转座子和质粒上,从而介导耐药基因水平转移[11]。根据整合酶基因编码氨基酸的差异,目前已经出现了4种耐药相关整合子,其中Ⅰ、Ⅱ和Ⅲ类整合子与耐药基因的转移密切相关[12]。
本研究在260株PA菌株中共检出109株Ⅰ类整合子阳性菌株,检出率为41.9%;检出4株Ⅱ类整合子阳性菌株;未发现Ⅲ类整合子。检测结果表明,Ⅰ类整合子是所有整合子类型中分布最为广泛的一种,而Ⅱ、Ⅲ类整合子比较少见,这与国内外文献报道相一致[13]。此外,研究发现4株Ⅱ类整合子阳性PA菌株也同时携带Ⅰ类整合子,这也表明PA菌株的耐药可以由Ⅰ、Ⅱ类整合子共同介导。有关PA菌株同时携带Ⅰ、Ⅱ类整合子的情况,国内已有相关文献报道,但比较少见,本研究结果再次证实此种菌株在国内的流行[14]。本研究发现,携带Ⅰ类整合子的PA菌株对除PB外的所有测试抗菌药物的耐药率明显高于Ⅰ类整合子检测阴性菌株,提示携带Ⅰ类整合子的PA菌株更容易形成耐药。另外,本研究还发现,携带Ⅰ类整合子的PA菌株其多重耐药率也明显高于Ⅰ类整合子检测阴性菌株。这一结果说明携带Ⅰ类整合子的PA菌株具有一定的多重耐药性。研究表明,整合子不仅可以整合外界耐药基因,并且可以充分表达这些耐药基因。这些基因以基因盒形式排列于整合子可变区,因此,整合子携带的菌株往往表现多重耐药[15]。目前已经发现的耐药基因盒约200多种,编码的耐药基因包含了对β-内酰胺类、氨基糖苷类及喹诺酮类等抗革兰阴性杆菌关键药物耐药。本试验初步证实了Ⅰ类整合子携带与这些药物耐药形成的相关性,然而是否在这些菌株整合子可变区携带相关耐药基因盒有待进一步深入研究。
综上所述,本研究表明,在临床微生物实验室开展整合子检测不仅有助于监测菌株耐药动态,控制耐药菌株的传播和流行,而且可以通过对整合子介导的分子耐药机制的深入研究,开发新型抗菌药物种类,为临床治疗,延缓耐药菌株的发生都有积极的意义。
参考文献
[1]王志锐,李力,张坚磊,等.耐药铜绿假单胞菌携带的整合子及其耐药基因盒检测分析[J].中华检验医学杂志,2007,30(7):802-803.
[2]陆思静,刘又宁,管希周,等.细菌整合子系统研究新进展[J].国外医学:呼吸系统分册,2005,25(3):228-231.
[3]Clinical and Laboratory Standards Institute.M100-S18 Performance standards for antimicrobial susceptibility testing[S].Wayne,PA,USA:CLSI,2010.
[4]Xu H,Su Z,Wang S,et al.Four novel resistance integron gene-cassette occurrences in bacterial isolates from Zhenjiang,China[J].Curr Microbiol,2009,59(2):113-117.
[5]张智洁,王军,孙继梅,等.卫生部全国细菌耐药监测网2010年东北地区细菌耐药监测[J].中国临床药理学杂志,2011,27(12):948-953.
[6]艾效曼,陶凤蓉,许宏涛,等.卫生部全国细菌耐药监测网2010年华北地区细菌耐药监测[J].中国临床药理学杂志,2011,27(12):932-939.
[7]黄湘宁,喻华,乔宁,等.卫生部细菌耐药监测网2010年西南地区细菌耐药性监测[J].中国临床药理学杂志,2011,27(12):954-958.
[8]付艳芳.铜绿假单胞菌感染及抗生素耐药分析[J].中国实用医药,2009,4(22):51-52.
[9]卢锦萍,罗征秀,符州.铜绿假单胞菌耐药性及耐药机制研究进展[J].儿科药学杂志,2011,17(6):53-55.
[10]Paulsen IT,Littlejohn TG,Rådström P,et al.The 3′ conserved segment of integrons contains a gene associated with multidrug resistance to antiseptics and disinfectants[J].Ant Ag Chem,1993,37(4):761-768.
[11]Hall RM,Collis CM.Mobile gene cassettes and integrons:capture and spread of genes by site-specific recombination[J].Mol Microbiol,1995,15(4):593-600.
[12]Partridge SR,Tsafnat G,Coiera E,et al.Gene cassettes and cassette arrays in Mobile resistance integrons[J].FEMS Microbiol Rev,2009,33(4):757-784.
[13]Wu K,Wang F,Sun J,et al.Class 1 integron gene cassettes in multidrug-resistant Gram-negative bacteria in southern China[J].Int J Antimicrob Agents,2012,40(3):264-267.
[14]Xu Z,Li L,Shirtliff ME,et al.Occurrence and characteristics of class 1 and 2 integrons in Pseudomonas aeruginosa isolates from patients in southern China[J].J Clin Microbiol,2009,47(1):230-234.
[15]Hall RM,Collis CM.Mobile gene cassettes and integrons:capture and spread of genes by site-specific recombination[J].Mol Microbiol,1995,15(4):593-600.


·论著·
The detection of drug resistance and prevalence of integrons in clinical isolates of Pseudomonas aeruginosa
YuKuikui,XieKai△
(DepartmentofClinicalLaboratory,XuzhouCentralHospital,Xuzhou,Jiangsu221100,China)
Abstract:ObjectiveTo investigate the drug resistance and prevalence of integrons in clinical isolates of Pseudomonas aeruginosa(PA) and to analyze the correlation between presence of integrons and drug resistance.MethodsA total of 260 non-repetitive clinical isolates of PA were obtained from this Hospital;antimicrobial susceptibility testing was performed by using the K-B disk diffusion methods;statistical analysis was performed by using the WHONET5.0 software.Integrons were detected by using polymerase chain reaction(PCR).ResultsAmong the 260 clinical isolates of PA,the resistance rates against 14 antibacterial agents from low to high were imipenem(18.5%),amikacin(18.8%),cefepime(20.3%),piperacillin/tazobactam(21.5%),ceftazidime pentahydrate(22.6%),aztreonam(31.9%),tobramycin(31.9%),cefoperazone(38.1%),gentamicin(38.8%),piperacillin(41.9%),ciprofloxacin(49.2%),cefotaxime(61.9%) and sulfamethoxazole/trimethoprim(70.4%),respectively.A total of 109 isolates presented Class Ⅰ integrons and 4 isolates presented class Ⅱintegrons,while no class Ⅲ integrons were found in any isolates.Except for polymyxin,the resistance rates of class Ⅰ integrons positive isolates against antibacterial agents examined in this study were significantly higher than those of class Ⅰ integrons negative isolates (P<0.05).ConclusionThe classⅠand class Ⅱ integrons are the prevalent types in the local region,which might be closely related to the drug resistance in clinical isolates of PA.
Key words:Pseudomonas aeruginosa;integron;drug resistance
作者简介:迟绍琴,女,主任检验技师,主要从事分子生物诊断学研究。
收稿日期:(2015-07-05)
文献标识码:
DOI:10.3969/j.issn.1673-4130.2015.24.016A
文章编号:1673-4130(2015)24-3547-03

