农杆菌介导含硫氨基酸γ-zein转化菊苣的初步研究
张玉,白史且,李聪
(1.四川省草原科学研究院,四川 成都611731;2.中国农业科学院北京畜牧兽医研究所,北京 100094)
农杆菌介导含硫氨基酸γ-zein转化菊苣的初步研究
张玉1*,白史且1,李聪2
(1.四川省草原科学研究院,四川 成都611731;2.中国农业科学院北京畜牧兽医研究所,北京 100094)
摘要:含硫氨基酸具有动物营养与免疫相关的重要生理功能,为提高菊苣中含硫氨基酸含量,采用根癌农杆菌介导法将玉米种子贮藏蛋白含硫氨基酸基因γ-zein和绿色荧光蛋白GFP融合基因转入到菊苣无菌苗叶片中,经过共培养、潮霉素抗性筛选、分化、再生和炼苗, 得到抗性植株。对抗性植株进行PCR、PCR-Southern、斑点杂交和RT-PCR分析,结果表明,外源目的基因已经整合到菊苣基因组中并且得到了表达,为提高菊苣含硫氨基酸含量,改善其品质奠定了基础。
关键词:γ-zein基因;菊苣;农杆菌转化;含硫氨基酸
Preliminary studies on transgenic chicory using the sulphur-amino acid gene, γ-zein, mediated byAgrobacteriumtumefacien
ZHANG Yu1*, BAI Shi-Qie1, LI Cong2
1.SichuanGrasslandScienceAcadem,Chengdu611731,China; 2.InstituteofAnimalScience,ChineseAcademyofAgriculturalScience,Beijing100094,China
Abstract:Sulfur-containing amino acids have important physiological functions related to animal nutrition and immunity. To improve the sulfur-amino acid content of chicory, leaves of chicory were transformed with the Sulphur-amino acid gene γ-zein, an important prolamin storage protein from Zea mays and a green fluorescent protein (GFP) gene using Agrobacterium mediated transfusion. After co-culture, selective differentiation and regeneration, hygromycin resistant plants were obtained. Resistant plants were detected using PCR, PCR-southern, dot blot hybridization and RT-PCR. The results demonstrated that the γ-zein genes had been integrated into the genome of chicory and expressed on a nucleic acid level in the transgenic plants.
Key words:γ-zein genes; chicory (Cichorium intybus); agrobacterium-mediated transformation; sulphur-amino acid
蛋白短缺包括蛋白含量短缺和营养品质低下,是21世纪全球性的严重问题,在尽快提高作物品种的蛋白质含量的同时,积极改善蛋白质的氨基酸组成,提高营养价值,具有重要意义。
含硫氨基酸如甲硫氨酸(也称为蛋氨酸,methionine,Met)、胱氨酸、半胱氨酸(cysteine, Cys)等是合成蛋白质的重要氨基酸,蛋白质中含硫氨基酸的含量与种子萌发、生长和作物品质均有密切关系。含硫氨基酸是人体必需氨基酸之一,也是形成动物毛发角蛋白的必需组分,并且研究表明含硫氨基酸含量的增加可提高羊毛产量22%以上,增产的幅度在22%~104%[1-2],同时还可增加牲畜的重量,含硫氨基酸的这种独特作用是别的氨基酸不具有的[2]。如能提高牧草或动物饲料中含硫氨基酸的含量,对提高动物重量、改善动物品质,具有重要的经济价值。是稳定畜产品价格和确保畜产品安全的有效途径之一[3]。
菊苣(Cichoriumintybus)为菊科菊苣属多年生宿根草本植物,其适应性广,根系发达,产量高,营养丰富,粗蛋白质16.44%~27.35%,菊苣常用作牧草饲料、蔬菜、制糖原料及咖啡的替代品,也是工业和药品的生产原料[3-4]。虽然菊苣蛋白质含量高,但是蛋白质中氨基酸组成不平衡,含硫氨基酸含量较低。
近年来,基因工程的诞生使人类的农业生产史发生了巨大的变化,通过转基因技术提高植物抗性、改善织物品质,具备并已展现了巨大的应用价值和经济价值[5]。目前已经从玉米(Zeamays)、水稻(Oryzasativa)、向日葵(Helianthusannuus)及豌豆(Pisumsativum)等中分离得到富含硫氨基酸的蛋白及其编码基因。玉米醇溶蛋白(zein)是玉米种子中的主要贮藏蛋白质,可分为α-、β-、γ-和δ-zein 4种主要类型。其中β-、γ-和δ-zein富含蛋氨酸和半胱氨酸2种含硫氨基酸[6]。通过转γ-zein基因来提高植物的含硫氨基酸已经在拟南芥(Arabidopsisthaliana)[7]、烟草(Nicotianatabacum)[8]、白三叶草(Trifoliumrepens)[9]、紫花苜蓿(Medicagosativa)[10-11]等中取得良好的结果。γ-zein基因的成功转入和表达为增加牧草可食性组织的含硫氨基酸含量提供了新的途径,但这在菊苣上还没见报道。本文通过农杆菌介导将GFP和γ-zein融合基因转化菊苣,对获得的转基因植株进行检测,以期提高菊苣植株含硫氨基酸的含量,改善菊苣品质,同时也为菊苣新品种的培育提供中间材料。
1材料与方法
1.1 植物材料
普那菊苣(Cichoriumintybuscv. puna)由四川省草原科学研究院提供。普那菊苣是一个产量高、抗虫性强的国家登记牧草品种。
1.2 质粒及菌种
本实验中使用根癌农杆菌菌株LBA4404、植物表达载体pCAMBIA1302和γ-zein基因均由中国农业科学研究院畜牧兽医研究所李聪实验室提供。质粒图谱见图1。该质粒包括CaMV35S启动子、γ-zein、GFP蛋白基因。
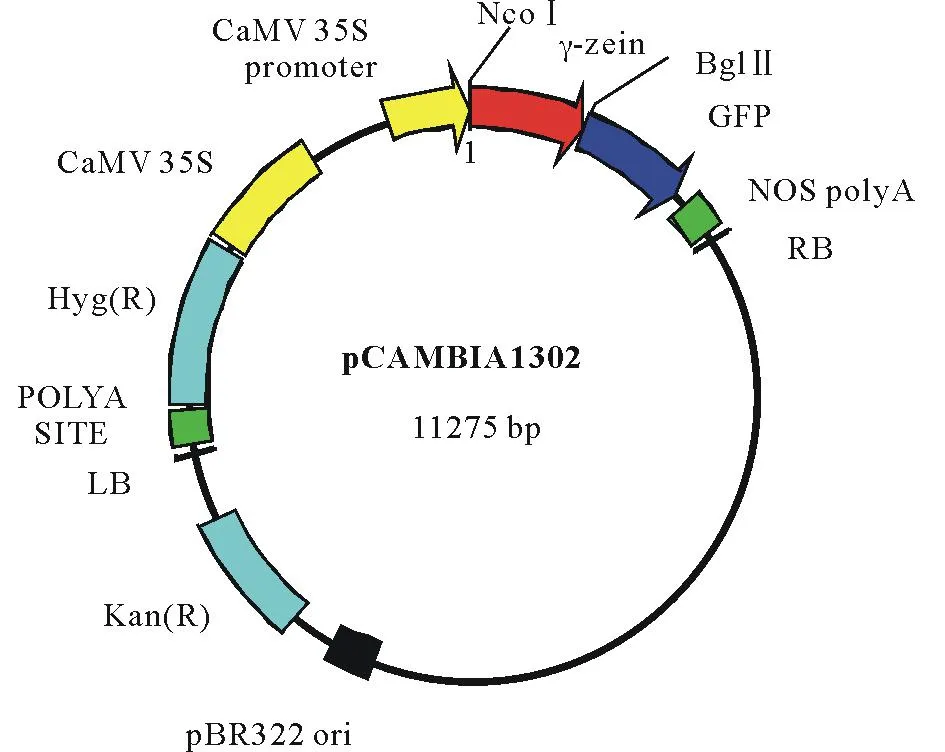
图1 植物表达载体pCB-GFP-zein结构Fig.1 Schematic maps of plant expression vectors pCB-GFP-zeinLB为左边界Left T-border;RB为右边界Right T-border.
1.3 试验用培养基成分
见表1。
1.4 方法
1.4.1菊苣无菌苗的获得选取饱满菊苣种子,经体积分数75%乙醇浸泡2 min,倒出浸泡液,再用0.1%的升汞浸泡10 min,无菌水反复清洗4~5次,无菌滤纸吸干水分后, 接种于1/2 MS培养基上,放于温室,待植株成苗。

表1 培养基成分
1.4.2菌液的活化参照王关林和方宏药(2002)的方法,略有变动。取-80℃加入15%甘油保存的菌液于碎冰上融化,用接种针蘸取少量菌液,在添加有50 mg/L Kan和50 mg/L Str的固体平板培养基上划线,于28℃恒温培养箱中倒置暗培养2 d。待长出单菌落后,用牙签挑取单菌落于含50 mg/L Kan和50 mg/L Str的液体LB或YMB培养基中,振荡培养16~24 h至对数生长期,然后按1∶100比例转入不含抗生素的新鲜液体培养基中继续振摇培养至OD600达0.6左右。无菌条件下取新鲜菌液于50 mL离心管中于常温5000 r/min离心10 min,去除上清液,用1/2 MS无菌液体培养基重悬沉淀至需要的OD值,用于侵染转化。
1.4.3转基因抗性植株的获得选取无菌苗中上部充分展开、生长健壮、均匀一致的幼嫩叶片,用5~10 mm打孔器制取叶盘外植体,将其接种在预培养基中预培养2 d后,用OD600=0.4 Abs农杆菌菌液浸泡10 min, 其间不断摇动,取出后用无菌滤纸吸取受体表面多余菌液,迅速将受体材料移置铺有一层无菌滤纸的共培养基上,黑暗中共培养到有肉眼可见微菌落。共培养结束后,将其转入含25 mg/L Hyg和500 mg/L Cef的筛选培养基中筛选得到抗性芽。当抗性芽长到1 cm时,转入含15 mg/L Hyg和500 mg/L Cef的分化培养基中扩繁,将扩繁芽转入含10 mg/L Hyg和250 mg/L Cef的生根培养基中进行生根培养,直到长成完整的小植株,然后驯化移栽,得到转基因抗性植株。
1.4.4抗性植株的检测1) PCR检测
用CTAB法和普博欣植物基因组DNA小量提取试剂盒提取抗性植株及对照(未转化植株)的总DNA,根据标记基因GFP和目的基因γ-zein序列用primer 5.0设计引物进行PCR扩增,GFP引物序列为:
5′-CAGTGGAGAGGGTGAAGGTG-3′
5′-CGAAAGGGCAGATTGTGTGG-3′
预期扩增长度为538 bp。
γ-zein引物序列为:
5′-TGCCACTACCCTACTCAACCG-3′
5′-GGAGGACCAAGCCGAAGAT-3′
预期扩增长度为283 bp。
以质粒pCB-GFP-zein作为阳性对照,以未转化的植株作为阴性对照。PCR反应体系为:10×PCR Reaction Buffer 2.5 μL,dNTP Mixture(10 mmol/L)2 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,基因组DNA 1 μg Taq DNA Polymerase(5 U/μL) 0.5 μg, 添加 ddH2O 补充到 25 μL。PCR反应程序为:94℃ 4 min,94℃ 30 s,50℃ 30 s, 72℃ 1 min,30个循环, 最后72℃ 10 min。电泳完后,取5 μL PCR扩增产物在浓度为1.5%的琼脂糖凝胶上电泳,检测扩增结果。
2) PCR-Southern
以质粒pCB-GFP-γ-zein DNA 为模板进行PCR,对PCR产物进行回收,用回收产物做探针标记,具体标记方法见Roche 公司的DIG High Prime DNA Labeling and Detection Starter Kit I,然后对PCR 产物进行电泳、转膜、预杂交、杂交和显色检测,具体方法见Roche 公司的说明书。
3)斑点杂交
对阳性植株DNA变性,冰中速冷。在带正电荷尼龙膜上用钝铅笔划0.5 cm×0.5 cm方格网,先用蒸馏水浸润尼龙膜,然后用20×SSC浸泡,用Tip将变性DNA点于膜上,以质粒pCB-GFP-zein DNA为阳性对照,以未转基因植株为阴性对照,每个样点2~10 μg DNA,室温晾干,烘烤,进行预杂交、杂交和显色检测[12]。
4) 转基因植株RT-PCR检测
利用TRIzol法对菊苣阳性转化植株和非转化植株的总RNA进行提取、纯化,然后对RNA进行反转录。逆转录反应体系为25 μL,含模板RNA 2 μg,Oligo(dT)15 Primer 1 μL,M-MLV Reaction Buffer 5 μL,Dntp (10 mmol/L) 5 μL,Ribonuclease Inhibitor 1 μL,M-MLV RT 200 U,加DEPC水补足25 μL。用γ-zein基因引物对反转录的cDNA进行PCR检测和电泳分析。
2结果与分析
2.1 转基因菊苣获得
菊苣无菌苗叶片预培养2 d后,叶片边缘开始膨大,用含pCB-gfp-zein的LBA4404浸染,浸染后的菊苣叶片(图2A)在黑暗下共培养2~3 d,转于含20 mg/L Hyg和500 mg/L Cef的筛选培养基上,20 d后分化出具有抗性的不定芽(图2B),将抗性芽转入含15 mg/L Hyg和500 mg/L Cef的分化培养基中扩繁1~2周 (图2C),再转入含10 mg/L Hyg和250 mg/L Cef的生根培养基中进行生根培养,2~3周后植株生根(图2D)发育成完整植株(图2E),炼苗室内盆栽,最终获得48株形态特征正常的菊苣抗性再生植株 (图2F)。

图2 转化菊苣分化与再生Fig.2 Differentiation and regeneration of transformed chicory A:浸染后的菊苣叶片Leaf soaked of chicory;B:不定芽的筛选(箭头指向为抗性芽) Screen the Hyg-resistant regeneration buds (the arrowed places are the transgene buds);C: 抗性植株生根培养Radicating of the Hyg-resistant regeneration buds; D:抗性芽的分化Differentiation of the Hyg-resistant regeneration buds;E:完整的抗性植株Intact plant;F:移栽成活的抗性植株The survival Hyg-resistant regeneration plant transplanted to plate.
2.2 抗性植株的PCR检测
提取转化抗性植株DNA,用GFP基因和γ-zein基因引物分别对转化植株及非转基因植株总DNA进行PCR扩增,结果显示转化的48株抗性再生植株中有29株能扩增出γ-zein基因的283 bp预期片段,只列出部分PCR图(图3),有26株能扩增出GFP基因538 bp的预期片段(图4,只列出部分PCR图),而非转基因植株均未扩增出任何条带(图3,图4)。

图3 转基因植株γ-zein-PCR 检测Fig.3 PCR analysis of γ-zein gene from transformed chicory 1: DL 2000 DNA marker;2: pCB-gfp-zein质粒Plasmid pCB-gfp-zein;3:阴性对照(非转基因菊苣) Negative control(non-transgenic );4~10:转化植株Transformed plants.

图4 转基因植株gfp-PCR 检测Fig.4 PCR analysis of gfp gene from transformed chicory
2.3 抗性植株的PCR-Southern检测
对gfp 和γ-zein基因PCR检测都为阳性的植株进行γ-zein-PCR——Southern检测,检测结果(图5)表明:检测的植株都为阳性,初步说明外源目的基因γ-zein已经转化到菊苣基因组中。

图5 转基因植株γ-zein-PCR-Southern 检测Fig.5 PCR-Southern analysis of γ-zein gene from transformed chicory
M: DL 2000 DNA marker; P: pCB-gfp-zein质粒Plasmid pCB-gfp-zein; CK: 阴性对照(非转基因菊苣) Negative control(non-transgenic );1~7: 转化植株Transformed plants.1: pCB-gfp-zein质粒Plasmid pCB-gfp-zein; 2: 阴性对照(非转基因菊苣) Negative control(non-transgenic);3~7: 转化植株Transformed plants.
2.4 抗性植株的斑点杂交检测
对上面检测均为阳性的转基因植株DNA进行斑点杂交,所用探针为pCB-gfp-zein质粒DNA的γ-zein-PCR回收产物,杂交结果显示(图6):除阴性对照外,转基因植株都有杂交信号,说明γ-zein已经整合到菊苣基因组中。

图6 转基因植株γ-zein斑点杂交检测Fig.6 Dot blot hybridization analysis of γ-zein gene P: pCB-gfp-zein质粒Plasmid pCB-gfp-zein; CK: 阴性对照(非转基因菊苣) Negative control (non-transgenic);1~8: 转化植株Transformed plants.
2.5 抗性植株的RT-PCR检测
采用TRIzol法对菊苣转化植株和未转化植株提取RNA,经检测RNA质量良好(图7),经过RT-PCR检测,结果表明(图8),除1株为阴性外其余都为阳性,表明大部分基因在转基因菊苣植株中得到了表达。检测表明阴性的植株是假阳性,还是在RNA上沉默,还有待Southern杂交的进一步检测。

图7 提取的植株RNA Fig.7 RNA extraction of plants
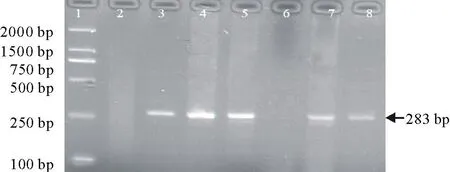
图8 转基因植株γ-zein-RT-PCR 检测Fig.8 RT -PCR analysis of γ-zein gene 1: DL 2000 DNA marker; 2:pCB-gfp-zein质粒Plasmid pCB-gfp-zei; CK: 阴性对照(非转基因菊苣) Negative control (non-transgenic);3~8: 转化植株Transformed plants.
3结论与讨论
改进农作物品质历来为各国科学工作者所重视。菊苣中缺乏蛋氨酸和半胱氨酸, 蛋氨酸和半胱氨酸成了其营养限制,菊苣是一个多用途的经济作物、药用植物和饲料作物, 提高其蛋氨酸和半胱氨酸含量具有巨大的潜在经济价值。该论文以菊苣无菌苗叶片为外植体,利用根癌农杆菌介导法对含硫氨基酸γ-zein基因和GFP基因的融合基因转移到菊苣的研究,迄今还未见报道。在菊苣中利用基因工程法进行基因转化的报道并不多见,目前在国内外报道的只有与花发育相关AFL2基因[13]、β-glucuronidase (uidA)基因[14]、抗坏血酸过氧化物酶(APX)基因[15]、pBI121-GFP载体[16]、菊苣中分离克隆的DREB基因[17]和茅液泡膜Na+/H+逆向转运蛋白基因(ALNHX)[18]被导入菊苣,并且这些报道都只做了最初的PCR检测,没有在RNA的表达上进行检测。
在植物遗传转化中,预培养的主要作用是促进细胞分裂,因为处于分裂状态的细胞更易整合外源DNA,提高转化率。研究发现菊苣预培养时间比较短,只需要2 d即可,如果预培养时间超过3 d,外植体边缘除了膨大外,还开始分化出绿点,影响转化效率。根癌土壤农杆菌只能感染植物的损伤部位,在植物细胞损伤及修复过程中,植物细胞释放出一些化学物质(酚类物质、酸性多糖等),这些诱导物可以通过外膜蛋白将环境中的植物损伤信号传递到农杆菌细胞内,最终引起vir 基因的表达和T-DNA 的转移。其中诱导效果最佳的为乙酰丁香酮(AS),它可以使农杆菌质粒上的vir 基因活化,提高转化率。也有报道称AS对于转化效果没有明显影响。本研究中得出共培养中AS浓度对抗性率影响差异显著,其中以浓度为100 μmol/L最佳。有报道AS 对于河北杨的侵染转化并没有促进效果,随着施加浓度的增加反而还会产生一定的抑制作用。不同研究获得结果不一致,可能与所选用材料、菌液浓度和菌株的类型有关系。
PCR的高度灵敏极易产生假阳性结果。DNA插入植物基因组后易发生重排,即使载体上的抗性基因或其他基因能表达, 目的基因也未必完整的存在于转化体中,从而造成检测结果的假阳性。而且,转基因植株存在基因沉默等现象,影响外源基因的正常表达,因此,转基因PCR检测结果可能不是百分之百准确,所以,除了PCR检测外,还有必要在DNA水平用点杂交、Southern Blot检测,在RNA表达水平上用RNA-PCR进行检测。本文通过转化叶片进行不同浓度梯度潮霉素的筛选,分化和再生得到了菊苣抗性植株,通过PCR、PCR-Southern和斑点杂交检测证明了γ-zein基因已经转化到菊苣基因组中。再通过RT-PCR进一步证明了γ-zein基因已整合到菊苣基因组中,并在转录水平上得到了正确表达,并且该转化方法抗性率高,阳性率也较高,为菊苣以后的遗传转化和育种中间材料的创制奠定了基础。一个完整的转基因植株的检测应该包括DNA、RNA方面的检测,还应该包括该基因表达产物的检测。本试验中,γ-zein基因表达的产物主要为含硫氨基酸的蛋氨酸和半胱氨酸,但是由于含硫氨基酸在转基因菊苣中表达量的检测,需要一定量的菊苣干样并打成草粉,因此,该指标只有等到转基因菊苣单株样品比较多的情况下才能进行测定。
References:
[1]Radcliffe B C, Hynd P I, Benevenga N J,etal. Effects of cysteine ethyl ester supplements on wool growth tate. Australian Journal of Agricultural Resear, 1985, 36: 709-715.
[2]Reis P J. Effects of amino acids on the growth and properties of wool. Physiological and Environmental Liminations to Wool Growth[M]. Amidale: University of New England Publishing Unit, 1979: 223-242.
[3]Wang C M, Yang L J, Chang S H,etal. Price analysis of domestic and international major livestock and forage products. Acta Prataculturae Sinica, 2014, 23(1): 300-311.
[4]Sanderson M A, Labreveux M, Hall M H. Nutritive value of chicory and English plantain forage. Crop Science Society of America, Madison, USA, 2003, 43(5): 1747-1804.
[5]Xu L M, Zhang Z B, Liang X L,etal. Advances in genetic engineerin for drought tolerance in plant. Acta Prataculturae Sinica, 2014, 23(6): 293-303.
[6]Shewry P R, Casey R. Seed Protein[M]. Netherlands: Kluwer Academic Publishers, 1999: 109-139.
[7]Geli M I, Torrent M, Ludevid D. Two structural domains mediate two sequential events in γ-zein targeting: protein endoplasmic reticulum retention and protein body formation. Plant Cell, 1994, 6(12): 1911-1922.
[8]Bellucci M, Alpini A, Paolocci F,etal. Accumulation of maize γ-zein and γ-zein: KDELTo high levels in tobacco leaves and differential increase of BiP synthesis in transformants. Theoretical and Applied Genetics, 2000, 101(5-6): 796-804.
[9]Sharma S B, Hancock K R, Ealing P M,etal. Expression of a sulphur-rich maize seed storage protein, δ-zein, in white clover (Trifoliumrepens) to improve forage quality. Molecular Breeding, 1998, 4: 435-448.
[10]Bellucci M, Alpini A, Arcioni S. Zein accumulation in forage species (LotuscorniculatusandMedicagosativa) and co-expression of the γ-zein: KDEL and β-zein: KDEL polypeptides in tobacco leaf. Plant Cell Reports, 2002, 20(9): 848-856.
[11]Lu D Y, Fan Y L, Yu M M,etal. Transgenic plant regeneration with high sulfur-containing amino acids protein gene about alfalfa. Acta Genetic Sinica, 2000, 27(4): 331-337.
[12]Li S J, Zhang Z Y. Expression of the Ta6-SFT gene in brassica napus under drought stress. Acta Prataculturae Sinica, 2014, 23(5): 161-167.
[13]Cheng L M, Cao Q F, Gao H W. Study on the efficient systems for regeneration and AFL2 gene transformation of puna chicory (CichoriumintybusL). Acta Agrestia Sinica, 2004, 12(3): 199-203.
[14]Zhang L J, Cheng L M, Du J Z. Estabilishent and optimization of puna chicory genetic transformation system with agrobacterium-mediated method. Acta Agrestia Sinica, 2008, 2: 130-134.
[15]Fanny Frulleuxl, Guy Weyens, Michel Jacobs. Agrobacterium tumefaciens-mediatated transformation of shoot-buds of chicory. Plant Cell, Tissue and Organ Culture, 1997, 50: 107-112.
[16]Song S F, Cao F, Yang P Z,etal. High efficient system establishment on plant regeneration and study on genetics Transformation in Puna Chicory (CichoriumintybusL.). Molecular Plant Breeding, 2006, 4(4): 565-570.
[17]Zhao L. Isolation and Characterization of the DREB Transcription Factor from Commander Chicory and Establishment of Genetic Transformation System of Commander[D]. Nanjing: Nanjing Agricultural University Library, 2013.
[18]Zhao L, Chen D D, Ling M X,etal. Comparative study on regeneration and genetic transformation between puna chicory and commander chicory. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(11): 2169-2176.
参考文献:
[3]王春梅, 杨林杰, 常生华, 等. 国内外主要畜产品与饲料价格分析. 草业学报, 2014, 23(1): 300-311.
[5]徐立明, 张振葆, 梁晓玲, 等. 植物抗旱基因工程研究进展. 草业学报, 2014, 23(6): 293-303.
[11]吕德扬, 范云六, 俞梅敏, 等. 苜蓿高含硫氨基酸蛋白转基因植株再生. 遗传学报, 2000, 27(4): 331-337.
[12]李淑洁, 张正英. Ta6-SFT 基因对油菜的转化及抗旱性分析. 草业学报, 2014, 23(5): 161-167.
[13]程林梅, 曹秋芬, 高洪文, 等. 菊苣再生体系的建立及转AFL2基因的研究. 草地学报, 2004, 12(3): 199-203.
[14]张丽君, 程林梅, 杜建中, 等. 菊苣农杆菌介导转化受体系统的研究. 草地学报, 2011, 6: 1042-1049.
[16]宋书锋, 曹凤, 杨培志, 等. 普那菊苣高效再生体系建立和遗传转化研究. 分子植物育种, 2006, 4(4): 565-570.
[17]赵龙. 将军菊苣DREB家族基因的克隆、功能研究及其遗传转化体系的建立[D]. 南京: 南京农业大学, 2013.
[18]赵龙, 陈丹丹, 梁明祥, 等. 2种菊苣再生体系及遗传转化效率的比较. 西北植物学报, 2012, 32(11): 2169-2176.
张玉, 白史且, 李聪. 农杆菌介导含硫氨基酸γ-zein转化菊苣的初步研究. 草业学报, 2015, 24(9): 73-79.
ZHANG Yu, BAI Shi-Qie, LI Cong. Preliminary studies on transgenic chicory using the sulphur-amino acid gene, γ-zein, mediated byAgrobacteriumtumefacien. Acta Prataculturae Sinica, 2015, 24(9): 73-79.
通讯作者*Corresponding author.
作者简介:张玉(1975-),女,四川仁寿人,博士。E-mail:zhyforage@126.com
基金项目:四川省十二五牧草育种攻关(2011NZ0098-11),四川省应用基础项目(2013JY0111)和国家牧草产业技术体系阿坝综合试验站资助。
收稿日期:2014-07-07;改回日期:2015-03-10
DOI:10.11686/cyxb2014307http://cyxb.lzu.edu.cn

