珠芽蓼内生细菌ZA1的抑菌物质产生条件的优化及其稳定性测定
杨成德,畅涛,薛莉,冯中红,姚玉玲,李婷,陈秀蓉
(草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃省草业工程实验室,
中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
珠芽蓼内生细菌ZA1的抑菌物质产生条件的优化及其稳定性测定
杨成德*,畅涛,薛莉,冯中红,姚玉玲,李婷,陈秀蓉
(草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃省草业工程实验室,
中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
摘要:从珠芽蓼中分离的内生细菌ZA1对马铃薯坏疽病菌具有良好的抑菌效果,鉴定为莫海威芽孢杆菌。本文通过平板对峙法对ZA1分泌物抑制马铃薯坏疽病菌的培养条件进行了优化,并对ZA1抑菌粗提物的稳定性进行了测定。结果表明,ZA1的最佳培养基为B培养液,最佳发酵温度为17.8℃,培养基的最佳pH是6.9,150 mL三角瓶的最佳装液量为20 mL,最佳培养方式为暗处理振动培养96 h,经对ZA1进行优化培养,其对马铃薯坏疽病菌的EC50=0.1228 μL/mL,是优化前EC50=4.5888 μL/mL的37倍。ZA1的抑菌粗提物90℃下处理2 h,其相对活性达到76.62%,具有耐高温的特性;对紫外线照射30 min后相对活性差异不明显; pH为3和11时,其相对活性分别为92.87%和85.11%;对蛋白酶和Ag+、Cu2+、Zn2+和Fe3+等金属离子不敏感,经Ag+处理后的相对活性可达到86.93%。
关键词:珠芽蓼内生菌;莫海威芽孢杆菌;抑菌粗提物;培养条件;稳定性
Optimizing the culture conditions and determining the stability of antibiotic secretion byPolygonumviviparumof the endophytic bacteriaBacillusmojavensis
YANG Cheng-De*, CHANG Tao, XUE Li, FENG Zhong-Hong, YAO Yu-Ling, LI Ting, CHEN Xiu-Rong
KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,CollegeofPrataculturalScience,GansuAgriculturalUniversity,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China
Abstract:One strain of Bacillus mojavensis (ZA1) is known to have a strong antibacterial effect against the pathogen of potato gangrene (Phoma foveata). In this study, P. foveata was isolated as a fungal pathogen and the method of petri dish confrontation was used to determine culture conditions for optimizing and stabilizing production of the antibiotic secreted by ZA1. The results showed that the optimum culture medium for ZA1 consisted of 200 g potato, 10 g peptone, 20 g sucrose and 1000 mL distilled water. The optimum fermentation temperature of ZA1 was 17.8℃.The optimum pH value of ZA1’s culture medium was 6.9. The optimum 150 mL triangle bottle volume of ZA1 was 20 mL. The optimum culture mode of ZA1 was shaking cultivation in the dark for 96 hours. Results showed that the EC50=0.1228 μL/mL against P. foveata after optimization was 37 times higher than the EC50=4.5888 μL/mL against P. foveata before optimization. Crude extracting of bacteriostatic from ZA1 showed that the characteristics of high temperature resistance and relative activity could reach 76.62% after it was treated at 90℃ for 2 hours. Relative activity was stable and could not be destroyed under UV irradiation for 30 minutes. The bacteriostatic extract of ZA1 had good acid and alkali resistance. When it was treated by pH=3 and pH=11, the relative activity was 92.87% and 85.11% respectively. It was not sensitive to protease and heavy metal ions such as Ag+, Cu2+, Zn2+and Fe3+. Relative activity remained at 86.93% after Ag+treatment.
Key words:Polygonum viviparum endophytic bacteria; Bacillus mojavensis; antagonistic substances; condition of culture; stability
微生物资源作为除动物和植物之外的第三类生物资源,而生防菌资源是微生物资源中的一类重要生物资源,随着绿色农业的深入推广,利用微生物源农药对植物病害进行防治的研究成为了热点。目前,除所推测的太空微生物资源未见生防菌报道之外,其他微生物资源如植物内生菌、土壤微生物、极端环境微生物、湿地微生物、海洋微生物及动物肠道和粪便菌均有生防菌的报道[1],且从植物和土壤中分离得到了拮抗细菌、真菌、放线菌等拮抗微生物的报道较多[2-8]。近年来,对生防菌抑菌机制的研究和明确其抑菌物质的种类更是受到了众多学者的青睐。研究表明,芽孢杆菌可以通过其核糖体途径产生某些细菌素和酶类及活性蛋白质类物质来溶解病原菌的细胞壁,也可以通过非核糖体途径产生的抗菌肽、脂肽物质或抗菌素通过锌离子通道或其他机制作用于病原菌的细胞膜[9-12]。随着研究的不断深入,学者报道了许多胞外分泌型抑菌蛋白[10]、抑菌酶[13]、抗生素[14],其中,多数抑菌物质制剂已用于农业生产当中;近年来,学者更是借助超滤杯及小分子分离柱等分离得到具有抑菌作用的小分子抗菌肽[15-17],这些抗菌肽的结构一般为环形或线形,且其一般具有耐高温和耐蛋白酶的特性,对酸碱和紫外线稳定[18-19]。
马铃薯(Solanumtuberosum)是世界第四大粮食作物,在甘肃种植面积较大,近年来马铃薯贮藏期病害发生严重,其中以我国检疫病害马铃薯坏疽病菌(Phomafoveata)最为严重,可在马铃薯的贮藏期造成大量腐烂[20]。马铃薯贮藏期长达4至5个月,且温度低,在此期间不便施用化学药剂防治,但从东祁连山高寒草地珠芽蓼(Polygonumviviparum)中分离得到的内生细菌莫海威芽孢杆菌ZA1(Bacillusmojavensis)对马铃薯坏疽病菌的抑制效果明显,且其对马铃薯其他贮藏期病害如马铃薯炭疽病菌(Colletotrichumcoccodes)、褐腐病菌(Stysanusstemonitis)、干腐病菌(Fusariumoxysporum)和早疫病菌(Alternariasolani)亦有较好的抑制效果[21]。因此,本试验研究了莫海威芽孢杆菌ZA1抑菌物质的稳定性,并优化了培养条件,以期为ZA1研发成为微生物农药提供理论依据。
1材料与方法
1.1 供试菌株
马铃薯坏疽病菌为供试病原菌;高寒草地珠芽蓼内生细菌,菌株编号为ZA1,为供试拮抗菌,菌种均由甘肃农业大学植物病理实验室提供。
1.2 培养基
供试培养基为PDA(马铃薯葡萄糖琼脂培养基)、NA(牛肉胨培养基)和NB(牛肉胨培养液)[22]。
1.3 无菌液的提取
将菌株ZA1在NA斜面培养基上活化培养24 h,用无菌水配制悬浮液,接种于NA培养液中,装液量为40 mL/150 mL,摇床培养24 h,即得发酵液,取发酵原液2 mL接种于NB培养液中摇床培养24 h,所得发酵液在转速8000 r/min下离心20 min,取上清液用细菌过滤器(孔径0.22 μm)过滤活菌体,即获得菌株ZA1的无菌液,4℃下保存待用,用于研究优化产抑菌物质的条件和稳定测定。
1.4 ZA1产生抑菌物质最佳条件的优化
ZA1培养基,以PDA、NA培养基分别用于坏疽病菌和拮抗菌的活化;A、B、C、D、E、F、G、H等8种培养液用于研究其对抗菌物质产生的影响。各配方如下:
A:牛肉胨5.0 g、蛋白胨10 g、蔗糖20 g、水1000 mL;
B:马铃薯200 g、蛋白胨10 g、蔗糖20 g、水1000 mL;
C(NB):牛肉胨3 g、蛋白胨5.0 g、葡萄糖2.5 g、水1000 mL;
D(NYDA):牛肉胨8 g、酵母浸膏5.0 g、葡萄糖10 g、水1000 mL;
E:玉米淀粉2.5 g、(NH4)2SO410 g、蔗糖10 g、水1000 mL;
F:玉米淀粉3.0 g、(NH4)2SO410 g、KH2PO415 g、蔗糖10 g、水1000 mL;
G:5×M9, Na2HPO464 g、KH2PO415 g、NaCl 2.5 g、NH4Cl 5.0 g、水1000 mL,取5×M920 mL定容至1000 mL;
H:蛋白胨10 g、酵母浸膏5.0 g、NaCl 10 g、水1000 mL。
将各培养液pH调至7.0,取40 mL培养液装入150 mL三角瓶中,灭菌后分别接入2 mL 拮抗菌原液,每处理3瓶,将各处理置于26~28℃、150 r/min的摇床上分别培养 24 h后制备无菌液,并制成浓度为80 μL/mL的含药平板,以无菌水为对照,测定抑制率,确定拮抗菌产生抗菌物质的最佳培养基。
温度,设(15±1)℃,(20±1)℃,(25±1)℃,(30±1)℃,(35±1)℃,(40±1)℃,(45±1)℃等7个温度处理,3次重复,其他培养条件及测定方法同上。
pH, 培养基pH值分别设置3,4,5,6,7,8,9,10和11(用pH-HJ90B酸度计测定),其他培养条件及测定方法同上。
相对供氧量,在150 mL三角瓶中分装20,40,60,80和100 mL NB培养液,将ZA1原液与NB培养液按1∶20的比例接菌,重复3次,其他培养条件及测定方法同上。
培养方式,设置静止,间歇振(12 h/d),全天24 h振荡3个处理(振速150 r/min),其他培养条件及测定方法同上。
光照,设置24,12 h/d光照和24 h/d黑暗3个处理,其他培养条件及测定方法同上。
发酵时间,分别培养24,48,72,96,120,144 和168 h后,利用无菌液与PDA混合制成浓度25 μL/mL的含药平板测定抑菌率,明确抑菌物质的产生与培养时间的关系。
ZA1产生抑菌物质最佳条件的验证,优化前(25℃于pH为7.0的NB培养基中光照振荡培养48 h,150 mL三角瓶装液量为40 mL),制备浓度依次为6.25,12.5,25,50和100 μL/mL含药平板,以加无菌水为对照。经优化培养后,制备浓度为3.125,6.25,12.5,25和50 μL/mL 的含药平板,计算抑菌率和EC50。
1.5 ZA1抑菌粗提物稳定性的测定
热稳定性的测定:将ZA1的无菌液分别置于20,30,40,50,60,70,80,90和100℃水浴处理2 h及120℃灭菌2 h,取处理液2 mL配制含药平板,采用十字交叉法测定抑制率。
UV稳定性测定:将ZA1 无菌液分别置于2 mL离心管,进行0,5,10,15,20,25,30 min的UV照射,后制成浓度为1.25 μL/mL的含药平板,采用十字交叉法测定抑制率。
pH稳定性测定:将ZA1无菌液的pH分别调至3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0和11.0, 4℃下保存24 h,其他方法同上。
对金属离子的稳定性测定:在无菌液中分别加入Na+,Mg2+,Cu2+,Mn2+,Zn2+,Fe3+和Ag+,使终浓度为10 mmol/L,混匀反应2 h后,以无菌液平板和各离子平板为对照,其他方法同上。
对蛋白酶的稳定性测定:于ZA1的无菌液中分别加入蛋白酶K和胰蛋白酶,使胰蛋白酶的终浓度依次为32,16,8,4,2和0 mg/mL,蛋白酶K 的终浓度依次为40,20,10,5,2.5和0 mg/mL,37℃下反应4 h后,制成浓度为20 μL/mL的含药平板,以无菌液平板为对照,其他方法同上。
1.6 数据处理
应用SPSS 16.0软件进行数据分析。
2结果与分析
2.1 ZA1产生抑菌物质最佳条件的优化
2.1.1不同培养基对ZA1产生抑菌物质的影响ZA1在A,B和D培养液中所产生抑菌物对马铃薯坏疽病的抑制率分别达80.01%,82.99%和79.56%(图1),显著高于其他培养液(P<0.01),在C和H培养液中所产生抑菌物对马铃薯坏疽病的抑制率分别是69.79%和53.49%,其他培养液中所产抑菌物质对该病菌的抑制率均未达到10%,说明不同培养液对ZA1产抑菌物质的量有影响, ZA1最佳培养基为B培养液(马铃薯200 g、蛋白胨10 g、蔗糖20 g、水1000 mL)。

图1 培养液对ZA1产生抑菌物质的影响Fig.1 Effect of ZA1 culture filtrates from different media on growth of P. foveata
2.1.2温度对ZA1产生抑菌物质的影响结果表明,在20℃时,ZA1所产生的抑菌物质对马铃薯坏疽病的抑制率达到了88.50%,通过对温度与抑制率的相关性分析,拟合得到了六次回归曲线(图2):Y=8.222X-0.006X3+2.598×10-8X6-47.107,相关系数R=0.937**,求得ZA1产抑菌物质的最佳温度为17.8℃。

图2 温度对ZA1产生抑菌物质的影响Fig.2 Effect of ZA1 culture filtrates from different temperature on growth of P. foveata
不同字母表示差异显著,小写:P<0.05;大写:P<0.01。下同。 Different capital and small letters are significantly different at 0.05 and 0.01 level. The same below.
2.1.3pH对ZA1产生抑菌物质的影响当培养液的pH为7时,ZA1对马铃薯坏疽病的抑制率达到了82.16%,通过相关性分析,拟合得到了六次回归曲线(图3):Y=41.524X-0.397X3+3×10-3X6-90.989,相关系数R=0.988**,根据曲线方程求得ZA1的产抑菌物质最佳的pH为6.9,表明中性条件下有利于ZA1抑菌物质的积累。
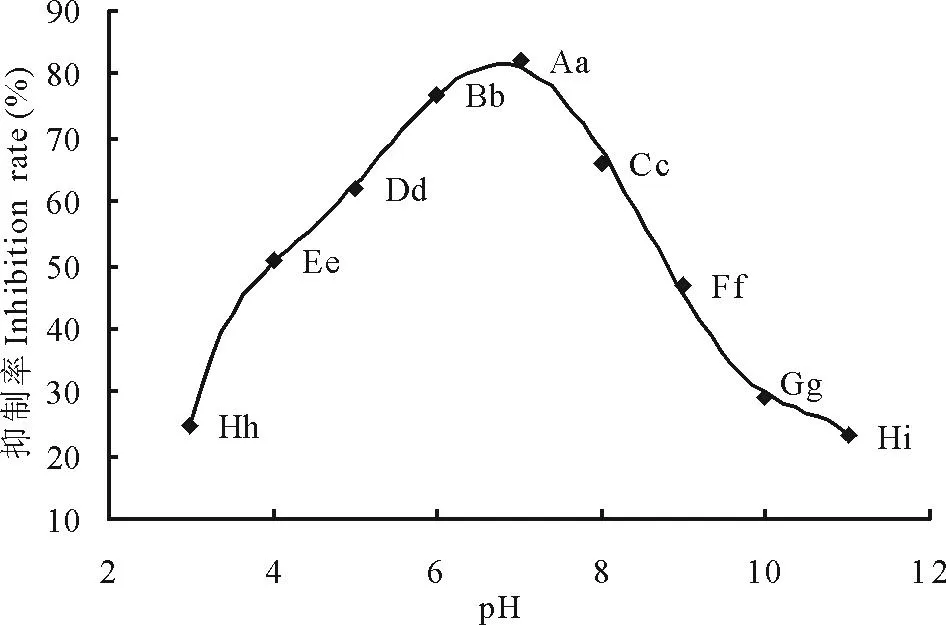
图3 pH对ZA1产生抑菌物质的影响Fig.3 Effect of ZA1 culture filtrates from different pH on growth of P. foveata
2.1.4相对供氧量对ZA1产生抑菌物质的影响150 mL三角瓶装液量为20 mL时,ZA1对马铃薯坏疽病的抑制率为72.23%,通过相关性分析,拟合得到了五次回归曲线(图4):Y=89.349-1.292X+9.261×10-5X3-3.863×10-9X5,相关系数R=0.981**,求得ZA1的产抑菌物质最佳的装液量为150 mL三角瓶装20 mL。

图4 相对供氧量对ZA1产生抑菌物质的影响Fig.4 Effect of ZA1 culture filtrates from different oxygen supply on growth of P. foveata
2.1.5培养方式对ZA1产生抑菌物质的影响ZA1以振动的方式培养时,分泌抑菌物质最多,其对马铃薯坏疽病的抑制率可达76.56%,显著高于只振动培养12 h得到的抑制率68.75%和静置培养24 h得到的抑制率46.16%(表1),说明ZA1的最佳培养方式为全过程振动培养。
2.1.6光照时间对ZA1产生抑菌物质的影响全黑暗培养所得的无菌液对马铃薯坏疽病的抑制率为69.83%(表1),显著高于12和24 h光照的抑制率,说明黑暗培养下培养ZA1,有利于抑菌物质的产生。
2.1.7发酵时间对ZA1产抑菌物质的影响ZA1经96 h的培养所得到的无菌液抑制率与经过120,144和168 h培养得到的无菌液抑制效果差异不显著,抑制率均达到87.6%以上(图5),说明ZA1培养到96 h后抑菌物质不再随培养时间的增加而增加。
2.1.8ZA1产抑菌物质最佳条件的验证生长速率法测定对马铃薯坏疽病的抑制率表明,抑制率与不同浓度的无菌液之间呈正相关,所得回归直线的R=0.995**,差异极显著,根据回归直线求得ZA1无菌液的EC50=4.588 μL/mL(表2)。 按照最佳条件进行培养(最佳培养液:B培养液,马铃薯200 g,蛋白胨10 g,蔗糖20 g,水1000 mL;最佳培养温度:17.8℃;最佳pH:6.3;150 mL三角瓶的最佳装液量20 mL;最佳培养方式:96 h暗处理振动培养)。所得的回归直线R=0.997**,其EC50=0.1228 μL/mL,优化后的EC50比优化前小37倍,差异极显著,说明条件优化后,对ZA1产生抑菌物质的能力有较大的提高。

图5 培养时间对ZA1产生抑菌物质的影响Fig.5 Effect of ZA1 culture filtrates from different culture time on growth of P. foveata

表1 不同培养方式对ZA1产生抑菌物质的影响
注:不同字母表示差异显著,小写:P<0.05;大写:P<0.01。下同。
Note: Different capital and small letters are significantly different at 0.05 and 0.01 level. The same below.2.2ZA1抑菌粗提物的稳定性测定
2.2.1热稳定性测定ZA1无菌液在90℃时,其相对活性达到76.62%(表3),表明ZA1抑菌活性物质具有耐高温的性质,当温度达到和超过100℃后,其相对活性迅速下降,但没有完全丧失,说明ZA1的大多数抑菌活性物质不耐100℃及以上的高温。
2.2.2对pH的稳定性测定无菌液在pH为3和11时,相对活性达到92.87%和85.11%(表4),对马铃薯坏疽病菌的抑制率在50%以上,说明ZA1分泌的抑菌物质耐酸碱。
2.2.3对UV的稳定性测定无菌液经UV照射后,其相对活性均在96%以上,差异不显著(P>0.05)(表5),说明ZA1的抑菌物质对UV具有稳定性。
2.2.4对金属离子的稳定性测定抑菌粗提物对Na+,Mg2+和Mn2+不敏感,相对活性没有变化,对Zn2+,Cu2+,Fe3+和Ag+等重金属离子较为敏感,相对活性有所下降,其中对Ag+最为敏感,但是抑制率仍可达到77.82%(表6),其相对活性下降极显著,但下降幅度不超过15%。说明ZA1的抑菌物质对Ag+,Cu2+,Zn2+,Fe3+等金属离子不太稳定,对其他金属离子均具有稳定性。
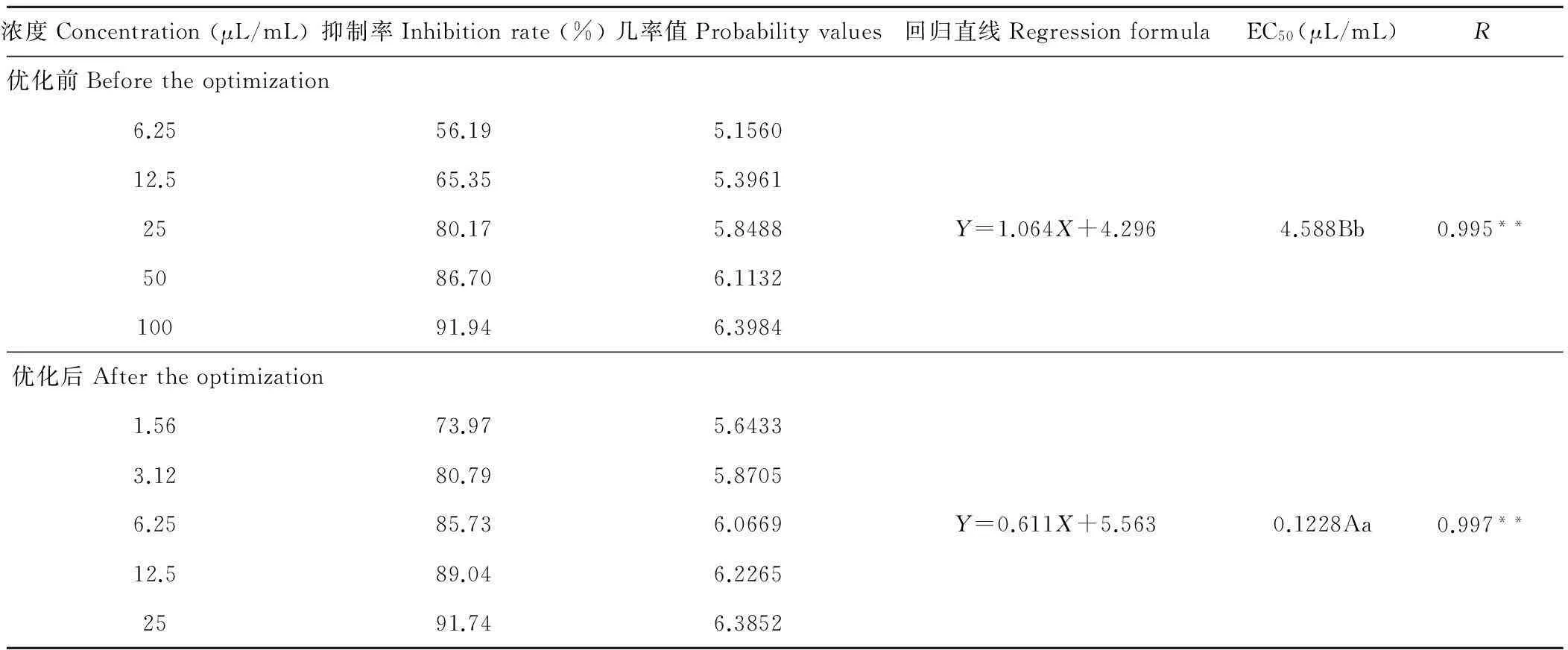
表2 ZA1的无菌液对马铃薯坏疽病菌的抑制作用
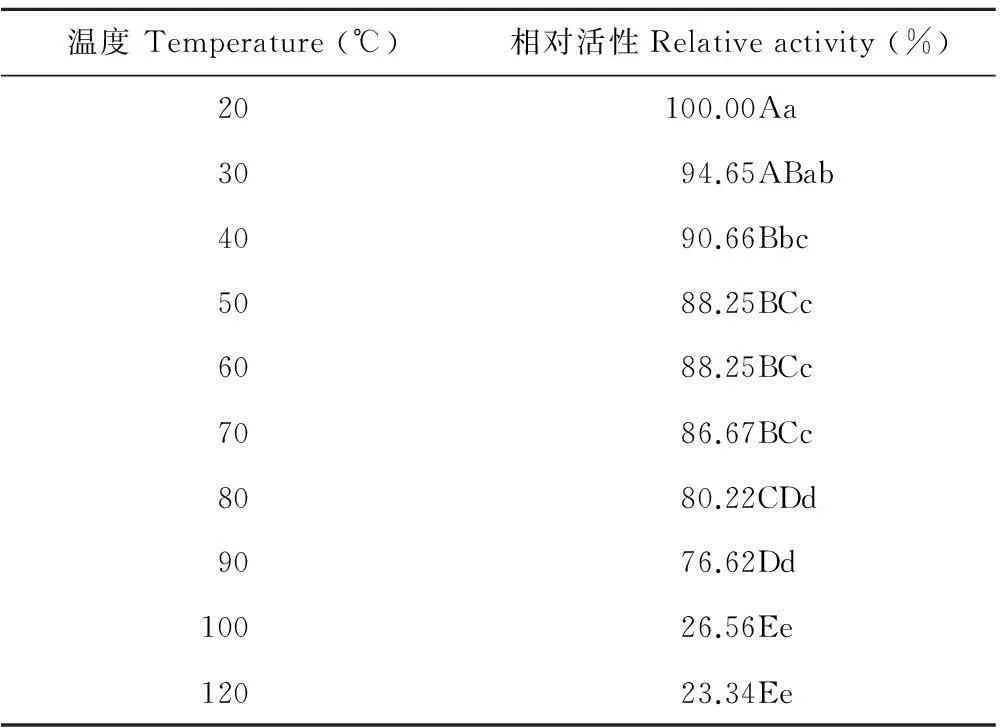
表3 ZA1无菌液的热稳定性

表4 ZA1的无菌液对pH的稳定性
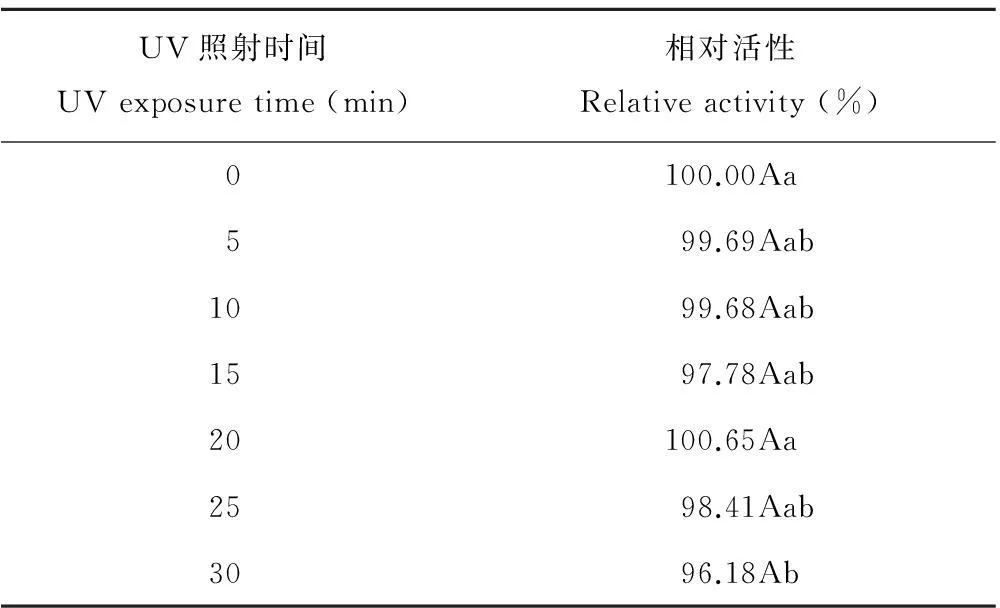
表5 ZA1无菌液的UV稳定性
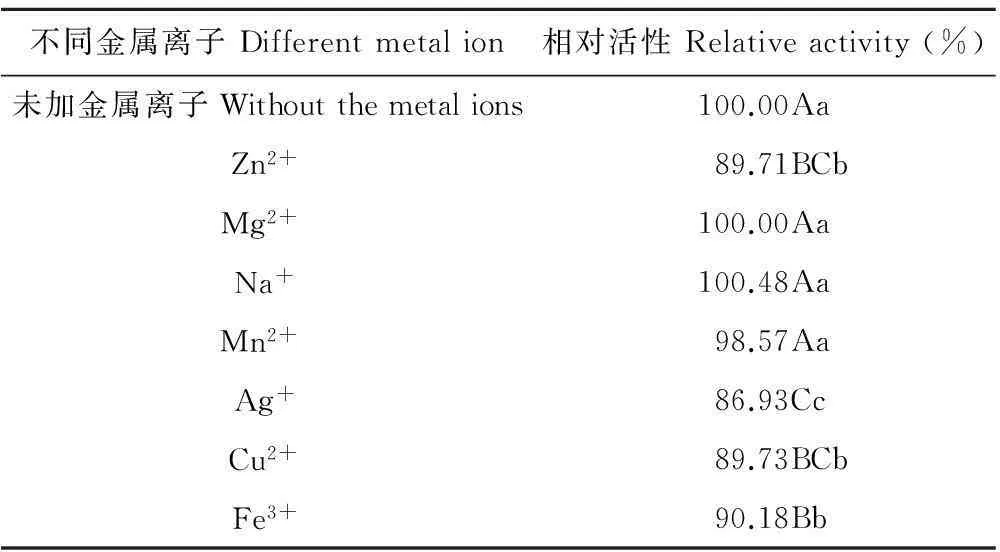
表6 ZA1的无菌液对金属离子的稳定性
2.2.5对蛋白酶的稳定性测定无菌液经不同浓度的蛋白酶K处理后,抑制率和相对活性在P<0.01水平差异不显著;经不同浓度的胰蛋白酶处理后,抑制率和相对活性均差异显著(表7),说明ZA1分泌的抑菌物质对胰蛋白酶较为敏感,即ZA1所分泌的抑菌物质中存在抑菌蛋白。
3讨论
近年来,随着对抑菌机制的不断研究,邢介帅等[10]分离得到的T2可分泌胞外蛋白酶,古丽皮艳等[23]分离得到的NKZ-E能够分泌几丁质酶;高芬等[17]、连玲丽等[24]纯化得到了具有良好稳定性的抗菌多肽。说明拮抗细菌主要以胞外分泌型物质抑制病原菌的生长,刘雪等[11]认为这类物质主要有两种类型:大分子的抑菌蛋白和小分子肽类。ZA1(B.mojavensis)的无菌液对马铃薯坏疽病菌的EC50=0.1228 μL/mL,拮抗效果明显,说明ZA1的抑菌物质主要是胞外分泌型物质。其抑菌粗提物可耐高温、耐酸碱、对紫外线稳定、且对蛋白酶的耐受性稳定,这与王建纲等[25]认为抗菌肽具有的特性一致,说明ZA1可能能够分泌抗菌肽,但对抗菌肽的分离、纯化及结构还需进一步研究。ZA1的抑菌粗提物在90℃处理2 h后,相对活性稳定在76.67%,但是100℃下处理2 h后抑菌活性直线下降,说明ZA1也可能产生一些大分子的抑菌蛋白,随着温度的升高活性降低。由ZA1抑菌粗提物的种种性质推测其可能也会分泌一些大分子量抑菌蛋白和小分子量的抗菌肽。除此之外, 120℃处理无菌液2 h后,相对活性仍达23.34%,说明ZA1胞外分泌的抑菌物质中含有耐高温的抑菌物质,此还需进一步的研究。
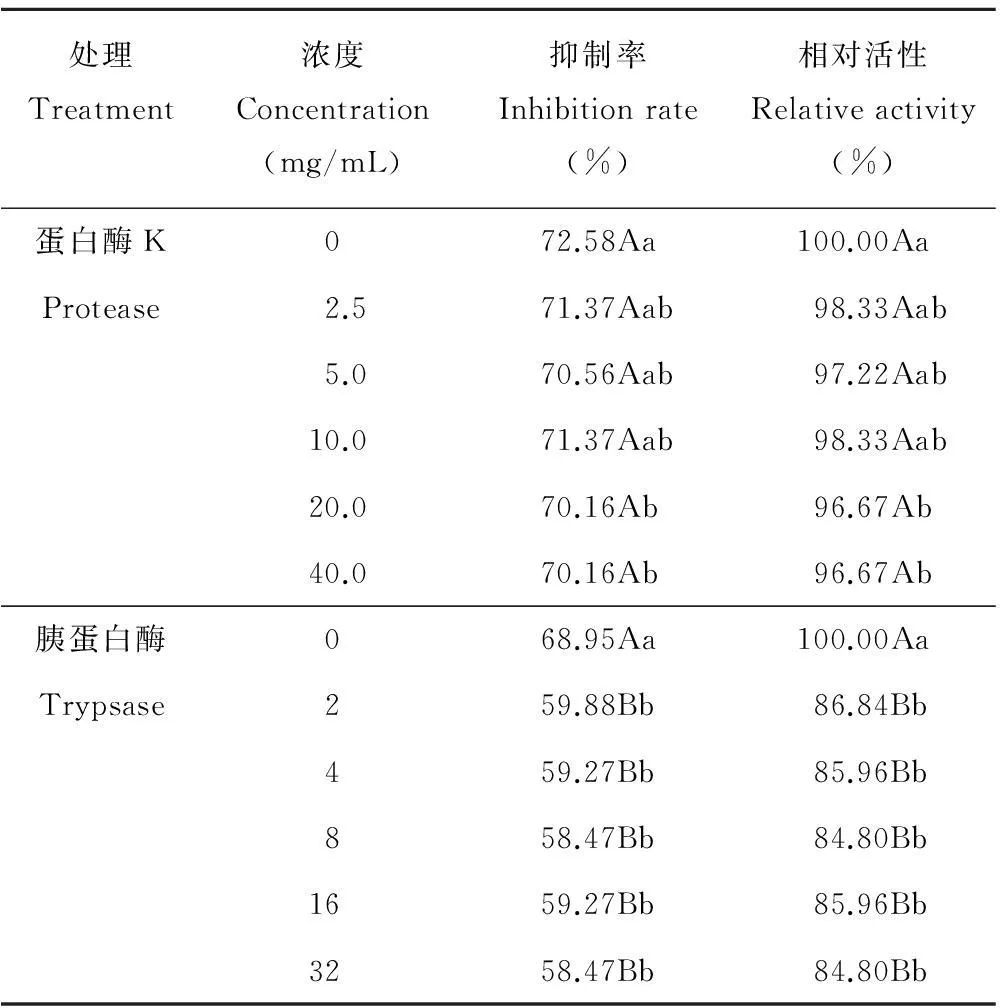
表7 ZA1的无菌液对蛋白酶的稳定性
ZA1对马铃薯坏疽病菌等马铃薯贮藏期的病原菌具有良好的抑制效果,本试验优化得到了ZA1的分泌抑菌物质最佳的培养条件,培养条件与常规培养稍有差异,但其积累抑菌物质的最佳培养温度为17.8℃,这与常规培养存在较大差异,明显低于李晶等[26]、赵瑞等[27]对枯草芽孢杆菌TU100和B29产抑菌物质的最佳温度。由于ZA1是高寒草地珠芽蓼内生菌,其特殊的生境可能是导致差异存在的原因,究其具体原因还需进一步研究。通过优化ZA1产抑菌物质的条件及对抑菌粗提物抑菌活性的初步研究,为ZA1的小试、中试提供技术支持。
References:
[1]Xu L H. Microbial Resource Studies (Second Edition)[M]. Beijing: Science Press, 2010.
[2]Shah M A I, Renukaradhya K M, Jong M K,etal. Effect of plant age on endophytic bacterial diversity of balloon flower (Platycodongrandiflorum) root and their antimicrobial activities. Current Microbiology, 2010, 61: 346-356.
[3]Forchetti G, Masciarelli O, Izaguirre M,etal. Endophytic bacteria improve seedling growth of sunflower under water stress, produce salicylic acid, and inhibit growth of pathogenic fungi. Current Microbiology, 2010, 61: 485-493.
[4]Li C H, Zhao M W, Tang C M,etal. Population dynamics and identification of endophytic bacteria antagonistic toward plant-pathogenic fungi in cotton root. Microbial Ecology, 2010, 59: 344-356.
[5]Bi J T, Ma P, Yang Z W,etal. Isolation of endophytic fungi from the medicinal plantTamarixchinensisand their microbial inhibition activity. Acta Prataculturae Sinica, 2013, 22(3): 132-138.
[6]Gao X X, Chen X R, Yang C D,etal. Identification and determination of biological characteristics ofKobresiacapillifoliaendophytic bacteria X4 in the East Qilian Mountain Alpine grasslands. Acta Prataculturae Sinica, 2013, 22(4): 137-146.
[7]Li Z D, Chen X R, Man B Y,etal. Identification ofPolygonumviviparumendophytic bacteria Z5 and determination of the capacity to secrete IAA and antagonistic capacity towards pathogenic fungi. Acta Prataculturae Sinica, 2010, 19(2): 61-68.
[8]Liu X M, Chen X R, Pu J J. Antagonism ofBacillusspp.B1 and B2 strains againstFusariumoxysporumf.sp.pisi. Microbiology, 2004, 31(3): 1-5.
[9]Zhai R H, Shang Y K, Liu F,etal. Characteristics and inhibitory action of antifungal protein produced byBacillussubtilisstrain G8. Journal of Plant Protection, 2007, 34(6): 592-596.
[10]Xing J S, Li R, Zhao L,etal. Purification, characterization and antagonism of an extracellular protease fromBacillussubtilisstrain T2. Acta Phytopathologica Sinica, 2008, 38(4): 377-381.
[11]Liu X, Mu C Q, Jiang X L,etal. Research progress of the metabolic substances produced byBacillussubtillisand their application on biocontrol of plant disease. Chinese Journal of Biological Control, 2006, 22(supplement):179-184.
[12]Wu X, Zhang S Q. Molecular mechanisms of antibacterial peptides against bacterium. Progress in Biochemistry and Biophysics, 2005, 32(12): 1109-1113.
[13]Gu Z R, Ma C Z, Han C A. Screening and identification of chitinase-producingBacillusspp. and determination of their chitinase activity. Acta Agriculturae Shanghai, 2001, 17(3): 92-96.
[14]Jiang C L, Xu L H. Actinomycetes Research[M]. Kunming:Yunnan University Press, 1998.
[15]Hu R P, Zhang D, Zhang L P,etal. Purification and identification of an antimicrobial peptides fromBacillussubtilisBSD-2. Acta Agriculturae Boreali-Sinica, 2011, 26(6): 201-206.
[16]Liu Y, Xu Q, Chen Z L,etal. Purification and characterization of antifungal peptide LP-1. Acta Microbiologica Sinica, 1999, 39(5): 442-447.
[17]Gao F, Ma L P, Qiao X W,etal. Purification of antifungal peptide produced by antagonisticBacilluscereus BC98-I againstFusariumoxysporum. Acta Phytopathologica Sinica, 2007, 37(4): 403-409.
[18]Liu X Y, Yang S Z, Mou B Z. Molecular structures of microbial lipopeptides. Biotechnology Bulietin, 2005, 4: 18-26.
[19]Xu J. On antimicrobial peptide and its research summary. Journal of Mianyang Normal University, 2012, 31(5): 76-80.
[20]Jiang H X, Yang C D, Chen X R,etal. Identification and biological characteristics of the pathogen causing the potato gangrene in Gansu Province. Acta Prataculturae Sinica, 2013, 22(2): 123-131.
[21]Chang T, Wang H Q, Yang C D,etal. Screening and identification of antagonist bacteria againstPhomafoveataon potato. Chinese Journal of Biological Control, 2014, 30(2): 247-252.
[22]Fang Z D. Research Method of Plant Pathology (Third Edition)[M]. Beijing: Chinese Agriculture Press, 1997.
[23]Gulpiye, Huang L L, Kang Z S. Study on a strain of high chitinase producing bacteria against plant pathogens. Acta Agriculturae Boreali-occidentalls Sinica, 2006, 15(6): 189-191.
[24]Lian L L, Xie L Y, Zhen L P,etal. Identification of antagonistic bacterium SB1 and analysis on its antibacterial substance. Microbiology, 2010, 37(7): 986-991.
[25]Wang J G, Xia L X, Liu X H. The advance on investigation of antimicrobial peptides. Biotechnology Bulietin, 2003, 2: 26-28.
[26]Li J, Yang Q, Zhao L H,etal. Antifungal substance from biocontrolBacillussubtilisB29 strain. China Biotechnology, 2008, 28(2): 59-65.
[27]Zhao R, Jiang M L, Hu X J,etal. The effect of culture conditions on growth and antibiotic production ofBacillussubtilisTU100. Chinese Journal of Oil Crop Sciences, 2007, 29(1): 69-73.
参考文献:
[1]徐丽华. 微生物资源学(第二版)[M]. 北京: 科学出版社, 2010.
[5]毕江涛, 马萍, 杨志伟, 等. 药用植物柽柳内生真菌分离及其抑菌活性初步研究. 草业学报, 2013, 22(3): 132-138.
[6]高晓星, 陈秀蓉, 杨成德, 等. 东祁连山线叶嵩草内生细菌X4的产吲哚乙酸、解磷、抗菌和耐盐特性研究及分子鉴定. 草业学报, 2013, 22(4): 137-146.
[7]李振东, 陈秀蓉, 满百膺, 等. 珠芽蓼内生菌Z5产IAA和抑菌能力测定及其鉴定. 草业学报, 2010, 19(2): 61-68.
[8]刘晓妹, 陈秀蓉, 蒲金基. 芽孢杆菌Bl、B2对豌豆尖镰孢菌抗菌机理的研究. 微生物学通报, 2004, 31(3): 1-5.
[9]翟茹环, 尚玉珂, 刘峰, 等. 枯草芽孢杆菌G8抗菌蛋白的理化性质和抑菌作用. 植物保护学报, 2007, 34(6): 592-596.
[10]邢介帅, 李然, 赵蕾, 等. 生防芽孢杆菌T2胞外蛋白酶的纯化及其抗真菌作用. 植物病理学报, 2008, 38(4): 377-381.
[11]刘雪, 穆常青, 蒋细良, 等. 枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用. 中国生物防治, 2006, 22(增刊): 179-184.
[12]吴希, 张双全. 抗菌肽对细菌杀伤作用的分子机制. 生物化学与生物物理进展, 2005, 32(12): 1109-1113.
[13]顾真荣, 马承铸, 韩长安. 产几丁质酶芽孢杆菌的筛选鉴定和酶活力测定. 上海农业学报, 2001, 17(3): 92-96.
[14]姜成林, 徐丽华. 放线菌研究[M]. 昆明: 云南大学出版社, 1998.
[15]胡瑞萍, 张铎, 张丽萍, 等. 枯草芽孢杆菌 BSD-2一种抗菌肽的分离纯化与鉴定. 华北农学报,2011, 26(6): 201-206.
[16]刘颖, 徐庆, 陈章良, 等. 抗真菌肽LP-1的分离纯化及特性分析. 微生物学报, 1999, 39(5): 442-447.
[17]高芬, 马利平, 乔雄梧, 等. 枯萎菌拮抗芽孢杆菌BC98-I抗菌多肽的纯化. 植物病理学报, 2007, 37(4): 403-409.
[18]刘向阳, 杨世忠, 牟伯中. 微生物脂肽的结构. 生物技术通报, 2005, 4: 18-26.
[19]徐佳. 抗菌肽及其研究进展. 绵阳师范学院学报, 2012, 31(5): 76-80.
[20]姜红霞, 杨成德, 陈秀蓉, 等. 甘肃省马铃薯坏疽病鉴定及其病原生物学特性研究. 草业学报, 2013, 22(2): 123-131.
[21]畅涛, 王涵琦, 杨成德, 等. 马铃薯坏疽病Phomafoveata生防菌的筛选及鉴定. 中国生物防治学报, 2014, 30(2): 247-252.
[22]方中达. 植病研究方法(第三版)[M]. 北京: 中国农业出版社, 1997.
[23]古丽皮艳, 黄丽丽, 康振生. 一株高产几丁质酶细菌对植物病原真菌的抑制作用研究. 西北农学报, 2006, 15(6): 189-191.
[24]连玲丽, 谢荔岩, 郑璐平, 等. 拮抗菌 SB1 的鉴定及其抗菌物质的分析. 微生物学通报, 2010, 37(7): 986-991.
[25]王建纲, 夏乐先, 刘晓辉. 生物抗菌肽研究进展. 生物技术通报, 2003, 2: 26-28.
[26]李晶, 杨谦, 赵丽华, 等. 生防枯草芽孢杆菌B29菌株抗菌物质的初步研究. 中国生物工程杂志, 2008, 28(2): 59-65.
[27]赵瑞, 江木兰, 胡小加, 等. 培养条件对枯草芽胞杆菌TU100生长和产生抗菌物质的影响. 中国油料作物学报, 2007, 29(1): 69-73.
杨成德, 畅涛, 薛莉, 冯中红, 姚玉玲, 李婷, 陈秀蓉. 珠芽蓼内生细菌ZA1的抑菌物质产生条件的优化及其稳定性测定. 草业学报, 2015, 24(9): 104-112.
YANG Cheng-De, CHANG Tao, XUE Li, FENG Zhong-Hong, YAO Yu-Ling, LI Ting, CHEN Xiu-Rong. Optimizing the culture conditions and determining the stability of antibiotic secretion byPolygonumviviparumof the endophytic bacteriaBacillusmojavensis. Acta Prataculturae Sinica, 2015, 24(9): 104-112.
通讯作者*Corresponding author.
作者简介:杨成德(1975-),男,甘肃陇南人,博士。E-mail:yangcd@gsau.edu.cn
基金项目:国家自然科学基金(No.31160122)和草业生态系统教育部重点实验室(甘肃农业大学)开放课题项目(No.CYzs-2011011)资助。
收稿日期:2014-03-04;改回日期:2014-04-21
DOI:10.11686/cyxb2014086http://cyxb.lzu.edu.cn

