肿瘤标志检测联合胸腔镜在恶性胸腔积液诊断中的应用
吴海洪 李 冀 高芳蝶
(海南省人民医院呼吸内科,海南 海口 570311)
肿瘤标志检测联合胸腔镜在恶性胸腔积液诊断中的应用
吴海洪李冀高芳蝶
(海南省人民医院呼吸内科,海南海口570311)
摘要〔〕目的探讨肿瘤标志检测联合胸腔镜在恶性胸腔积液诊断中的应用。方法选取恶性胸腔积液患者120例,根据检查方法不同分为两组,对照组采用肿瘤标志物检测诊断恶性胸腔积液,实验组采用肿瘤标志检测联合胸腔镜,比较两种方法的恶性胸腔积液阳性检出率。结果实验组患者经胸腔镜检查的阳性检出率为96.67%;与对照组相比,实验组行联合检测,恶性胸腔积液的阳性检出率明显升高(P<0.05)。结论肿瘤标志检测联合胸腔镜对恶性胸腔积液诊断的检出率高于单纯使用一种检测手段,对临床恶性胸腔积液的早期诊断和早期治疗有重要意义。
关键词〔〕肿瘤标志物;胸腔镜;联合检测;恶性胸腔积液
第一作者:吴海洪(1974-),男,硕士,副主任医师,主要从事呼吸系统疾病诊治研究。
胸膜腔位于肺和胸壁之间,在生理状况下,脏、壁层胸膜表面有约1~30 ml的液体,起润滑作用〔1〕。当发生如肺、胸膜及其他肺外疾病均可导致胸膜内液体的形成过快或吸收不及时而形成胸腔积液〔2〕。胸腔积液会影响肺功能,是胸膜疾病最多的症状之一。恶性胸腔积液在肿瘤患者中较为常见,恶性肿瘤的死亡患者中有15%发生了恶性胸腔积液〔3〕。恶性胸腔积液的诊断对患者的早期治疗及预后都具有重要意义。目前临床常用的胸腔积液的诊断方法有很多种,包括胸腔积液脱落细胞检查、穿刺化验、肿瘤标志物检验等〔4〕,但其诊断的敏感性不高,且盲目胸部穿刺给患者带来的痛苦大,且检出率不理想。胸腔镜技术是近年发展起来的窥镜技术,具有操作简便等特点,最重要的是其可以直接窥视病灶,提高诊断的准确率〔5〕,并且可以取多部位的活检,以明确病因。现已成为临床胸腔积液的诊断“金标准”〔6〕。但临床联合应用肿瘤标志物及胸腔镜诊断恶性胸腔积液的研究尚少。本研究探讨胸腔镜联合肿瘤标志物对恶性胸腔积液的诊断敏感性和准确率。
1资料与方法
1.1临床资料选取2011年6月至2012年12月我院呼吸科收治住院的恶性胸腔积液患者120例,男79例,女41例,年龄50~80岁,按检查手段不同分为实验组和对照组。两组患者一般资料相比无显著差异,具有可比性(P>0.05),见表1。
表1两组患者一般情况(n=60)

组别男/女(n)平均年龄(x±s,岁)肿瘤类型(n)肺癌鳞癌腺癌小细胞癌乳腺癌胃癌对照组38/2253.38±2.0121221421实验组41/1955.17±1.9319201533
实验组采用肿瘤标志检测联合胸腔镜,对照组采用肿瘤标志物检测诊断恶性胸腔积液。所有患者均经CT及胸部B超确诊为胸腔积液。纳入标准:所有患者经胸腔穿刺检测在胸液中找到肿瘤细胞或者经确诊为肺或其他部位的恶性肿瘤伴胸腔积液;患者经实验室常规检查各指标正常,无胸腔镜检查禁忌证,所有患者同意进行试验措施,并签署知情同意书。排除患有低蛋白血症或者淋巴管阻塞者、其他疾病引起的胸腔积液、其他重要脏器危重疾病者、不同意进行试验措施者。
1.2方法
1.2.1胸腔镜检查方法对实验组患者进行胸腔镜检查。检查前对患者进行超声检查,确保无胸膜腔粘连,胸水较少患者可在胸腔内注射生理盐水300~500 ml,或者胸腔内注射过滤空气400~500 ml制作人工气胸。肌肉注射安定5~10 mg。患者取健侧卧位,局部麻醉至胸膜后,肋间隙平行肋骨切开皮肤,插入金属套管,直到胸膜腔内,经套管插入内科胸腔镜,首先抽出胸腔积液,顺次观察脏层胸膜、壁层胸膜和膈胸膜,检查结束置引流管行闭式引流。检查过程中注意检测心率、血压、血氧饱和度、呼吸频率等。
1.2.2肿瘤标志物检测所有患者经彩超定位胸水位置,并确定穿刺点,局部麻醉穿过胸膜回抽见胸水抽出麻醉针,进行穿刺见有胸水流出后,留取胸腔积液5 ml,应用罗氏电化学发光法检测肿瘤标志物神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、CA125、CA199的水平。
1.3统计学方法采用SPSS17.0统计软件进行单因素方差分析法,使用Turkey检验进行组间检验、校正。
2结果
2.1肿瘤标志物检测结果两组肿瘤标志物水平均显著高于正常值范围,但两组患者之间各指标的水平无差异(P>0.05),两组恶性胸腔积液阳性检出率无差异(P>0.05),见表2。
2.2胸腔镜检查结果根据胸腔镜检查结果显示,肺癌腺癌为多发结节,呈弥散状,胸膜可见胸膜肥厚,结节以及肿块,也可出现溃疡样病变(图1A,B);肺癌鳞癌多为结节影,在壁层胸膜上,呈多发、弥漫状,也可为片状凸起,胸腔镜下可见菜花样肿块(图1C,D);肺癌小细胞癌可见大小不等的结节,散在生长,前胸壁可见新生物及少量白色纤维素沉积(图1E,F);肿瘤转移病变可见大小不等结节,呈白色粟粒样,融合成片,可见胸膜粘连(图1G,H)。实验组患者经胸腔镜检查的阳性检出率为96.67%。见表3,图1。
2.3两组患者恶性胸腔积液阳性检出率比较与对照组相比,实验组患者恶性胸腔积液的阳性检出率明显升高(96.67% vs 88.33%,χ2=12.373,P=0.004)。
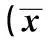

组别NSE(μg/ml)CEA(μg/ml)CA125(U/ml)CA199(U/ml)检出率(%)对照组231.16±36.74165.73±54.381232.37±341.76143.76±28.5388.33实验组244.56±31.36168.83±61.721198.83±297.46151.36±31.3696.67
表3胸腔镜对恶性胸腔积液阳性检出率
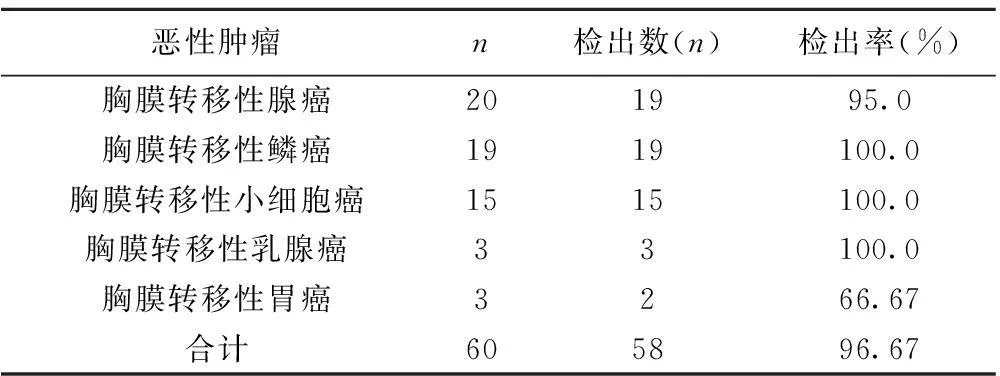
恶性肿瘤n检出数(n)检出率(%)胸膜转移性腺癌201995.0胸膜转移性鳞癌1919100.0胸膜转移性小细胞癌1515100.0胸膜转移性乳腺癌33100.0胸膜转移性胃癌3266.67合计605896.67
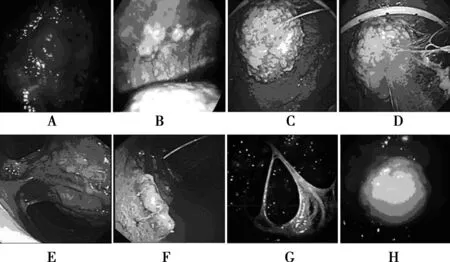
A、B为肺癌腺癌胸膜转移;C、D为肺癌鳞癌胸膜转移;E、F为肺癌小细胞癌胸膜转移;G、H为其他肿瘤胸膜转移图1 恶性胸腔积液患者内科胸腔镜下表现
3讨论
正常人的胸腔为负压,有利于肺进行正常的呼吸运动。胸膜腔位于肺和胸壁之间,胸膜之间有液体,并随着循环的压力梯度在胸膜、胸膜腔一级淋巴管中循环。在生理情况下,这些液体处于形成和吸收的动态平衡中。病理状态下,由于这种动态平衡被打破,因此会出现大量的胸腔积液,破坏肺的正常复张,从而影响患者的呼吸运动。胸腔积液的产生病因有多种且不易诊断,主要有肿瘤和结核疾病引起,分为良性胸腔积液和恶性胸腔积液。其中恶性胸腔积液多由肿瘤引起,约占全部恶性胸腔积液的20%~30%〔7〕。临床上常见的诊断方法有:细菌培养、胸腔积液穿刺化验肿瘤标志物、脱落细胞学检查等,但仍有一部分的病例不能明确诊断明确其病因,胸腔镜具有创伤小、操作简单的特点,在临床上被广泛用于胸腔积液的病因诊断。胸腔镜能够直接窥视病灶,并进行活检,避免盲目活检给患者带来的痛苦。
研究表明〔8〕,当胸膜被癌组织侵袭时,肿瘤标志物的水平明显升高,会加速在癌细胞合成,并释放至浆膜腔,聚集在胸腔积液中,且在胸腔积液中的水平高低提示了癌细胞数量的多少。且由于胸腔积液内的肿瘤标志物无法被循环和代谢,因此,其在胸腔积液中的水平明显高于外周血〔9〕。其中,CEA作为一种大分子量的糖蛋白,提取自结肠腺癌组织,是一种广谱性较强的肿瘤标志物〔10〕。有研究表明〔11〕,CEA可诊断多种类型的肿瘤。在胸腔积液中,CEA 阳性表达最高,因此临床多用CEA联合其他肿瘤标志物用于肿瘤的诊断。CA125最初用于卵巢癌的诊断并且具有较高的特异性〔12〕。 研究表明〔13〕,CA125可以作为肺癌的肿瘤标志物,可用于良恶性胸腔积液的鉴别。NSE被认为是诊断小细胞肺癌的重要首选指标,约80%的小细胞肺癌患者伴有NSE水平的升高〔14〕。CA199主要用于消化道肿瘤的诊断,近年来的研究发现,CA199也可用于肺癌及乳腺癌等的诊断〔15〕。因此,以上4种肿瘤标志物的检测对恶性胸腔积液的病因诊断具有重要意义。但除肿瘤以外的疾病造成的胸腔积液以及检测过程中造成的误差造成的假阳性结果仍会造成一些患者诊断的不准确。
胸腔镜技术是近年来广泛使用的一项操作技术,可直观地观察胸膜腔的病变与否。有研究提示适用于不明原因的胸腔积液诊断以及鉴别诊断、肺癌以及顽固性胸腔积液的诊断〔16〕。有研究〔17〕表明,胸腔镜检查的诊断率约80%~93%。本研究实验组患者的肺癌鳞癌、腺癌、小细胞癌等均能被准确地检测出来,其检查诊断的敏感率达到96.67%。本实验采用前端可以弯曲的胸腔镜,其具有操作性好,观察范围广等优点,可直接观察膜腔,并且可以进行活检取材,因此诊断相对准确且价值大,快速准确。对其他检查手段不能明确诊断的胸腔积液类型能够明确诊断。本实验表明胸腔镜用于辅助诊断可以明显提高患者恶性胸腔积液的诊断准确率。
本研究通过对恶性胸腔积液患者进行肿瘤标志物和胸腔镜的检查,证实了肿瘤标志物联合胸腔镜检查能够大大提高对恶性胸腔积液诊断的敏感性和准确率。但本研究样本的数量和胸腔积液的病因等方面还不够完善,在下一步研究中,我们将对本研究的结果做进一步的分析,为临床胸腔积液的准确诊断提供依据。
参考文献4
1Wang XF,Wu YH,Wang MS,etal.Cea,Afp,CA125,CA153 and CA199 in malignant pleural effusions predict the cause〔J〕.Asian Pacific J Cancer Prev,2014;15(1):363-8.
2涂明利,刘玉全,刘先军,等.电子胸腔镜在不明原因的胸腔积液诊断中的应用〔J〕.中国内镜杂志,2006;1(12):58-9.
3温青久,高桂华,随冬侠,等.血清和胸水肿瘤标志物检测对肺癌所致胸腔积液的诊断价值 〔J〕.中国医刊,2012;47(6):64-6.
4朱元压,陈文彬.呼吸病学〔M〕.北京:人民卫生出版社,2003:1280.
5Zhen S,Bian LH,Chang LL,etal.Comparison of serum human epididymis protein 4 and carbohydrate antigen 125 as markers in ovarian cancer:A meta-analysis〔J〕.Mol Clin Oncol,2014;2(4):559-66.
6李强.介入肺脏病学在呼吸系统疾病诊治中的应用现状与展望〔J〕.中国实用内科杂志,2007;27(3):178-80.
7刘运秋,刘金梅,兰璇,等.多种肿瘤标志物检测对胸腔积液鉴别诊断的价值〔J〕.中国综合临床,2006;22(3):235-7.
8张洁,俞赞临,张美华.生化指标检测在腹水鉴别诊断中的评价〔J〕.诊断学理论与实践,2006;5(5):429-32.
9罗淼,王昌明,曾锦荣,等.不明原因胸腔积液的诊断〔J〕.临床肺科杂志,2010;30(11):1617-8.
10童朗辉,王臻,王辰.内科胸腔镜技术及其临床应用〔J〕.中华结核和呼吸杂志,2007;30(3):220-2.
11Blanc FX,Atassi K,Bignon J,etal.Diagnostic value of medical thoracoscopy in pleural disease:a 6-year retrospective study〔J〕.Chest,2002;121(5):1677-83.
12李芳芳,路尧,张国俊.胸水CA125、CA199、CEA、NSE、CYFRA21-1、CA72-4对原发性肺癌的诊断价值〔J〕.肿瘤基础与临床,2014;27(1):49-52.
13Bhatnagar R,Maskell NA.Medical pleuroscopy〔J〕.Clin Chest Med,2013;34(3):487-500.
14周灵,时国朝,万欢英.胸腔积液中渗出液与漏出液鉴别诊断新进展〔J〕.临床肺科杂志,2008;12(12):1627.
15姜春南.联合检测血清和胸液中肿瘤标志物对肺癌引起的胸腔积液临床意义分析及比较〔J〕.医学信息,2013;10(25):380.
16Guerriero E,Berlingieri MT,Pallante P.UbcH10 is a novel lymphoid proliferation marker associated with the G2/M cell cycle phase〔J〕.Virchows Arch,2009;445(Suppl 1):252-3.
17Rahman NM,Gleeson FV.Image-guided pleural biopsy〔J〕.Curr Opin Pulm Med,2008;14(3):331-6.
〔2014-05-17修回〕
(编辑赵慧玲/曹梦园)
基金项目:海南省应用技术研发与示范推广专项(No.ZDXM2015073)
中图分类号〔〕R73〔
文献标识码〕A〔
文章编号〕1005-9202(2015)23-6824-03;doi:10.3969/j.issn.1005-9202.2015.23.081

