分子印迹滤过型净化柱净化/分子荧光光谱法测定花生根中白藜芦醇
丘秀珍,彭翠红,王少玲,郭会时,卢吕泉
(韶关学院 化学与环境工程学院,广东 韶关 512005)
分子印迹滤过型净化柱净化/分子荧光光谱法测定花生根中白藜芦醇
丘秀珍*,彭翠红,王少玲,郭会时,卢吕泉
(韶关学院化学与环境工程学院,广东韶关512005)
分子印迹技术(Molecular imprinting technology,MIT)是将待分离的目标分子与功能单体通过共价或非共价作用进行预组装,与交联剂共聚制备得到聚合物。除去目标分子后,分子印迹聚合物(Molecularly imprinted polymers,MIPs)中形成与目标分子空间互补并具有预定的多重作用位点的“空穴”,对目标分子的空间结构具有“记忆”效应,能够高选择性识别复杂样品中的印迹分子。由于MIPs 可特异性结合模板分子,兼具生物识别体系和化学识别体系的优点,可选择性识别富集复杂样品中的目标物,因此被广泛用于固相萃取[1-4]、固相微萃取[5-6]、基质固相分散萃取[7]、搅拌棒固相萃取[8-9]等样品前处理技术。

图1 滤过型净化柱示意图Fig.1 Schematic diagram of an m-PFC tip
白藜芦醇( Resveratrol,RES )又称为芪三酚,主要存在于葡萄、虎杖、桑葚、花生植株及其他植物提取物中,是植物在环境恶劣或遭到有害物质侵害时自身排泄的一种可抵抗霉菌传染的抗毒素,具有抗肿瘤、抗菌、抗氧化、保护肝脏和心血管等功能,广泛应用于医药、食品等方面[10]。目前,白藜芦醇的检测方法主要有化学发光法[11]、荧光光谱法[12]、高效液相色谱法[13-15]及定量核磁共振波谱法[16]等。
将分子印迹技术应用于白藜芦醇的检测虽已见报道[17-19],但仍处于起步阶段。本研究采用β-环糊精(β-CD)和甲基丙烯酸(MAA)双功能单体[20],通过在凹凸棒土(ATP)表面接枝印迹白藜芦醇分子印迹聚合物,制备了MIPs 填充滤过型净化柱(Multiplug filtration clean-up ,m-PFC,图1)[21],据此建立了分子印迹滤过型净化柱净化/分子荧光光谱法测定花生根中白藜芦醇的新方法。与分子印迹固相萃取柱净化相比,该方法无需固相萃取装置,用一次性注射器即可完成富集净化过程,可满足快速检测的要求。
1实验部分
1.1材料与试剂
花生根,采集于广东省韶关市大塘镇(洗净,烘干,粉碎,过100目筛);白藜芦醇、乙烯雌酚(DES)、双酚A(BPA) 标准品(美国Sigma公司,纯度>99%);凹凸棒土(ATP,甘肃靖远);β-环糊精(β-CD)、N,N-二甲基甲酰胺(DMF)、乙二醇二甲基丙烯酸酯(EGDMA)、偶氮二异丁腈(AIBN)、α-甲基丙烯酸(MAA)均购自上海阿拉丁试剂有限公司;无水乙醇、甲醇、正己烷(天津科密欧试剂有限公司),未标注试剂均为分析纯;实验用水为二次蒸馏水。
1.2实验仪器
LS-55分子荧光光度计(美国Perkin Elmer 公司);ZF-7B手提紫外检测灯(上海顾村电光仪器厂);滤过型净化柱空柱管(3 mL,天津博纳艾杰尔科技有限公司);真空干燥箱-DZF-6050D(上海齐欣科学仪器有限公司);傅立叶变换红外光谱仪FTIR-8400S(日本岛津公司);场发射电子显微镜(JSM-7001F,日本电子光学公司)。
1.3分子印迹聚合物材料的制备
1.3.1β-CD/ATP复合材料的制备β-CD/ATP复合材料的合成参照文献[21]:称取一定量的ATP,分别用6 mol/L HCl和NaOH回流5 h,活化其表面的硅羟基。然后将3.0 gβ-CD溶于100 mL含 0.3 g NaH的无水DMF中,室温下搅拌至无气体放出后,过滤除去多余的NaH,向滤液中加入1.0 g 2,3-(环氧丙烷)丙基三甲氧基硅烷(KH-560),在90 ℃油浴和氮气保护下搅拌反应5.0 h。随后升温至115 ℃,迅速加入5.0 g ATP,搅拌12 h后,产物分别用DMF、甲醇和水洗涤,55 ℃下真空干燥过夜,即得β-CD/ATP复合材料。
1.3.2分子印迹聚合物(β-CD/ATP-MIPs) 的制备MIPs的合成路线如图2所示:将0.50 mmol白藜芦醇、2.0 mmol MAA、1.0 gβ-CD/ATP及15 mL DMF加入100 mL三颈烧瓶中,室温下振荡12 h,使模板分子与功能单体预聚合。然后加入2 mL(10 mmol) EGDMA和30 mg AIBN及20 mL DMF,通氮除氧15 min后,置于60 ℃油浴下避光反应24 h,防止白藜芦醇异构化。将所得产品过滤后加至50 mL水中,搅拌1.5 h以洗脱未反应的β-CD。最后以甲醇-乙酸(80∶20)作溶剂用索氏提取器洗涤48 h去除模板分子,将所得产物在45 ℃下真空干燥24 h,即得β-CD/ATP-MIPs。 除了不加模板分子外,按相同的方法制得非分子印迹聚合物(NIPs)。将MIPs和NIPs研磨均匀后,过100目筛,置于真空干燥箱中备用。

图2 分子印迹聚合物的合成路线图Fig.2 Schematic of the preparation of resveratrol molecularly imprinted polymers
1.4分子印迹聚合物吸附性能研究
分别取20 mg的MIPs和NIPs于50 mL圆底烧瓶中,加入一定量不同浓度的RES标准溶液,涡旋振荡一段时间后,用分子荧光光度计测定溶液中未被吸附的RES浓度,计算吸附容量。吸附容量Qe(mg/g)=(C0-Ce)V/W。式中,C0(mg/L)和Ce(mg/L)分别是RES的初始浓度和平衡吸附后的浓度,V(mL)和W(mg)分别是溶液的体积和吸附剂用量。
1.5花生根中白藜芦醇的测定
花生根中白藜芦醇的处理方法见文献[22]。将新采集的花生根用水洗净,晾干,剪切成2 cm小段,粉碎后用不同波长的紫外灯照射一段时间。取0.2 g样品置于微波消解罐中,加入5 mL 70%乙醇,微波功率为中火,提取时间为6 min。提取完毕后,过滤,定容至50 mL。取5 mL提取液,缓慢滴入装有50 mg MIPs的滤过型净化柱中,保持滴速为0.5滴/min。上样完毕后,用甲醇-乙酸(80∶20)将RES洗脱,定容后用分子荧光光度计在激发波长λex=310.0 nm,发射波长λem=380.0 nm处测定其荧光强度If。
2结果与讨论
2.1分子印迹聚合物的表征
2.1.1扫描电镜表征图3 为β-CD/ATP复合材料和β-CD/ATP-MIPs的扫描电镜图。从图3可见,光滑的凹凸棒土表面(图3A)接枝了一层致密多孔的分子印迹聚合物(图3B)。



图4 β-CD/ATP(a),β-CD/ATP-MIPs(b)及β-CD/ATP-NIPs(c)的红外光谱图Fig.4 FT-IR spectra of β-CD/ATP(a),β-CD/ATP-MIPs(b) and β-CD/ATP-NIPs(c)
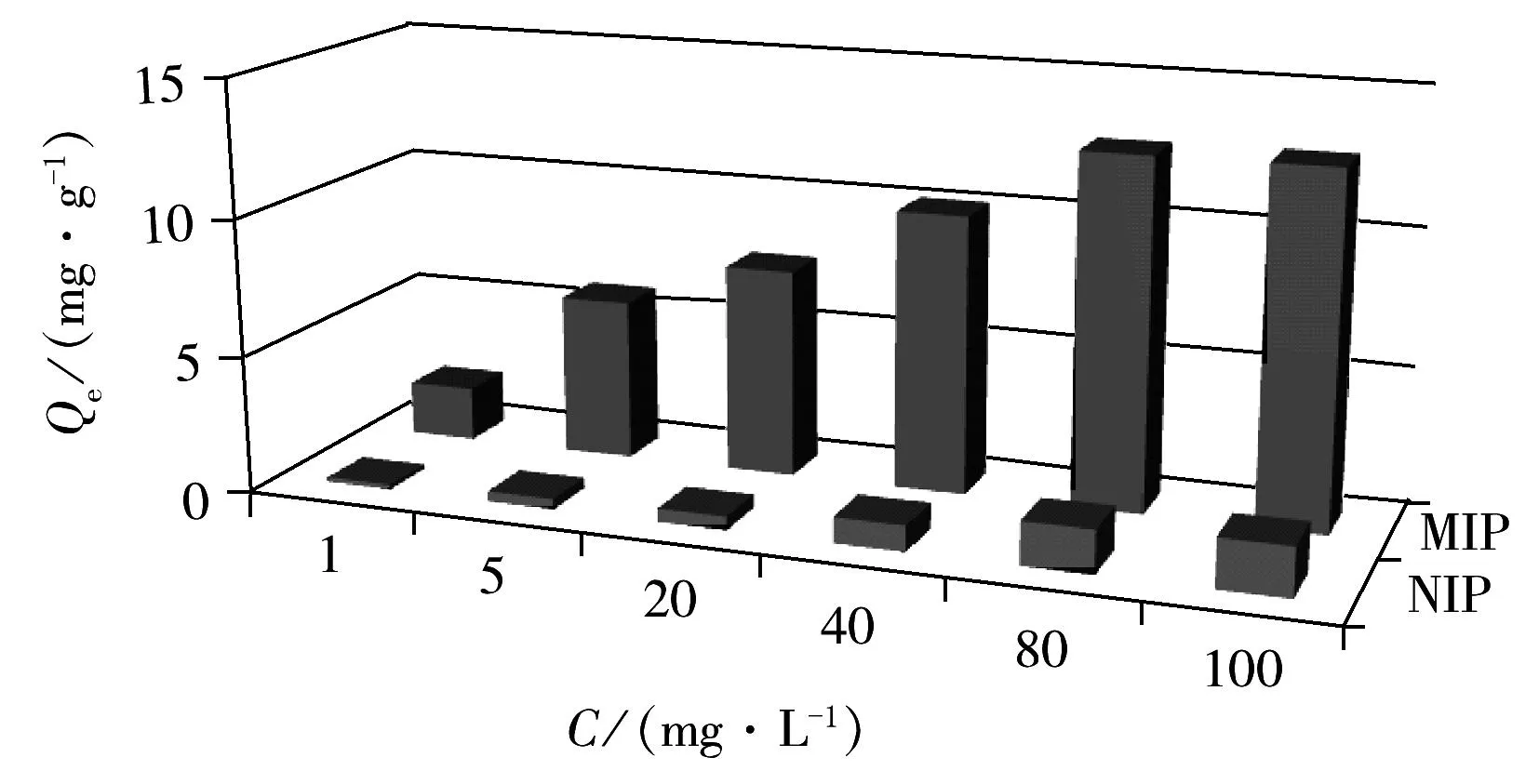
图5 MIPs和NIPs对RES的吸附容量Fig.5 Adsorption capacities of MIPs and NIPs for RES

AnalyteLinearequationrQe(mg/g)LOD(μg/L)RESy=825.18x+2.050.999710.520.048DESy=790.10x+3.740.99903.680.29BPAy=131.78x+3.560.99933.470.85
2.2分子印迹聚合物吸附容量
用静态吸附实验研究了MIPs和NIPs对RES的结合性质,相应的吸附等温曲线见图5。由图可知,在 1~100 mg/L浓度范围内,随着底物浓度的增加,MIPs对RES的吸附容量明显增大;底物浓度增至80 mg/L后,继续增大底物浓度,MIPs对RES的吸附容量增大不明显,表明已基本达到吸附平衡,MIPs的最大吸附容量为12.78 mg/g。而NIPs的吸附量随着底物浓度的增加只有一个缓慢的变化过程,吸附容量仅为1.79 mg/g。说明MIPs和NIPs存在空间结构差异,MIPs对RES存在特异结合位点。
2.3分子印迹聚合物的选择性
以RES的结构类似物乙烯雌酚(DES)和双酚A(BPA)为竞争底物,考察MIPs对RES的选择性。准确移取浓度为40 μg/mL的RES,DES和BPA标准溶液10 mL,分别加入20 mg MIPs,涡旋振荡5 h后,计算各自吸附容量。表1为RES及其类似物的线性方程、相关系数、平衡吸附量及检出限。由表1可知,MIPs对RES的吸附量约为其结构类似物的3倍。结果表明,虽然DES和BPA能形成氢键作用力的基团与RES相同,但其作用位点与RES差别较大,说明MIPs对RES有特异的识别位点。
2.4分子印迹滤过型净化柱(MIPs-m-PFC)的制备及条件优化
将50 mg MIPs湿法装入滤过型净化柱,考察了上样流速、洗脱剂种类及用量、抽提次数对RES吸附净化效果的影响。由最优RES萃取回收率结果确定MIPs-m-PFC 净化富集条件为:上样流速:0.5滴/min;洗脱剂:甲醇-乙酸(80∶20);洗脱剂用量:10 mL;抽-压循环次数:5次。
2.5分子印迹滤过型净化柱的重复使用性能
在最佳净化条件下,用装有50 mg MIPs的净化柱吸附净化10.00 mL 40 μg/mL的RES标准溶液。将上述吸附-解吸附过程循环5次,计算5次循环MIPs净化柱对RES的吸附容量。结果表明,5次吸附-解吸附循环使用后,MIPs净化柱对RES的吸附量变化很小,仅从10.14 mg/g降至9.34 mg/g。
2.6紫外光照对花生根中白藜芦醇含量的影响
用分子印迹净化柱净化/分子荧光光谱法测定了经不同紫外光照射后花生根中白藜芦醇的含量,测得未经紫外光照的花生根样品中白藜芦醇的含量为2.23 mg/g;经365 nm的紫外光距离40 cm处照射20 min后,白藜芦醇的含量为5.17 mg/g;经254 nm的紫外光距离30 cm处照射30 min后,白藜芦醇的含量为6.10 mg/g。由实验结果可知,经紫外光照处理后,花生根中白藜芦醇的含量约为未经光照的2~3倍。这是因为具有细胞活性的花生根在光照环境下,能够刺激自身合成白藜芦醇,导致“逆境物质”白藜芦醇的含量成倍增加[22]。
2.7加标回收实验
分别在微波消解的花生根样品中添加4,8,12 μg/g 3个水平的RES,经MIPs净化柱富集净化后,用分子荧光光度计测定其RES的含量,结果见表2。样品的加标回收率为86.2%~102.1%,相对标准偏差(RSD)为3.5%~5.8%,说明该方法适用于花生根中白藜芦醇含量的测定。
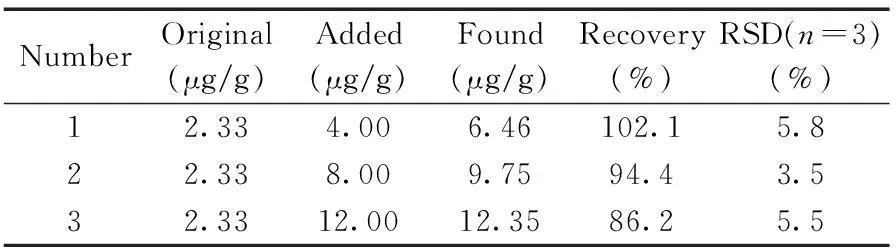
表2 花生根样品中白藜芦醇的加标回收率与相对标准偏差
3结论
本文以白藜芦醇为模板分子,具有疏水性内腔和带羟基亲水性外腔的大环化合物β-CD和MAA为双功能单体,在凹凸棒土表面接枝制备表面分子印迹聚合物。并将MIPs作为吸附剂湿法填充到滤过型净化柱中,用于花生根样品中白藜芦醇的富集纯化,建立了分子印迹滤过型净化柱净化/分子荧光光谱法测定白藜芦醇的新方法。该方法操作简便,准确快速,满足样品中痕量白藜芦醇的快速检测要求。
参考文献:
[1]Lin Z K,Cheng W J,Li Y Y,Liu Z R,Chen X P,Huang C.Anal.Chim.Acta,2012,720:71-76.
[2]Duan Y,Dai C M,Zhan Y L,Chen L.Anal.Chim.Acta,2013,758:93-100.
[3]Zhao D C,Guan X M,Liu X Y,Zhang H X.J.Chromatogr.A,2012,1229:72-78.
[4]Xiang H Y,Fan Y Z,Li M,Zhuo D M,Xie Y.J.Instrum.Anal.(向海艳,范银洲,李曼,卓冬梅,谢扬.分析测试学报),2013,32(1):45-50.
[5]Hu X G,Fan Y N,Zhang Y,Dai G M,Cai Q L,Cao Y J,Guo C J.Anal.Chim.Acta,2012,731:40-48.
[6]Hu X G,Cai Q L,Fan Y N,Ye T T,Cao Y J,Guo C J.J.Chromatogr.A,2012,1219:39-46.
[7]Yan H Y,Wang H,Qiao J D.J.Chromatogr.A,2011,1218:2182-2188.
[8]Liu K F,Chen J,Chen N,Hu M,Gong W J,Zhang Y P.J.Instrum.Anal.(刘坤峰,陈军,陈娜,胡梅,龚文君,张裕平.分析测试学报),2014,33(8):859-865.
[9]Xu Z G,Hu Y F,Hu Y L,Li G K.J.Chromatogr.A,2010,1217(3):3612-3618.
[10]Yin T,Guan X.J.Instrum.Anal.(殷婷,管骁.分析测试学报),2015,34(1):67-72.
[11]Shi Z L,Zhang Z J,Tang H,Zhao Q,Yang X,Chen Y.Chin.J.Anal.Lab.(时作龙,章竹君,唐虹,赵琼,杨曦,陈渝.分析试验室),2011,30(3):5-7.
[12]Zhang H J,Yu J H.FoodRes.Dev.(张寒俊,喻玖宏.食品研究与开发),2006,27(9):107-109.
[13]Dong X L,Chen X M.Chin.J.Spectrosc.Lab.(董秀丽,陈向明.光谱实验室),2011,28(2):810-812.
[14]Ma L Y,Li J M.J.Instrum.Anal.(马丽艳,李景明.分析测试学报),2004,11(6):87-90.
[15]Sun D,Zhang Z X,Wang Y N,Shi W P.Chin.J.Chromatogr.(孙狄,章震兴,王轶男,时卫萍.色谱),2004,22(4):424-427.
[16]Yu S,Guo Q S,Wang H L,Gao J P,Xu X.Chin.J.Anal.Chem.(禹珊,郭强胜,王会琳,高建平,许旭.分析化学),2015,43(1):69-74.
[17]Xiang H Y,Zhou C S,Zhong S A,Lei Q F.Chin.J.Appl.Chem.(向海艳,周春山,钟世安,雷启福.应用化学),2005,22(7):740-742.
[18]Xiang H Y,Zhang Y F,Qi C,Mei F,Li W G.Chin.J.Appl.Chem.(向海艳,张艳芳,祁超,梅芳,李伟国.应用化学),2009,26(7):786-790.
[19]Duan Y Q,Wang Y H,Zhang H H,Zhang C,Ding N,Qin Y,Yan Y S.FoodSci.(段玉清,王艳红,张海晖,张灿,丁宁,秦宇,闫永胜.食品科学) ,2012,33(9):107-109.
[20]Pan J M,Zou X H,Wang X,Guan W,Yan Y S,Han J.Chem.EngJ.,2010,162:910-918.
[21]Ma L L,Jia L,Zhou X R,Liu Y,Fan X J,Pan C P.Chin.J.Chromatogr.(马立利,贾丽,周欣燃,刘艳,范筱京,潘灿平.色谱),2014,32(6):635-639.
[22]Peng C H,Mai K Y,Tan L Y,Qiu X Z.J.ShaoguanUniv.:Nat.Sci.(彭翠红,麦康燕,谭乐茵,丘秀珍.韶关学院学报:自然科学版),2014,35(4):51-55.

摘要:以白藜芦醇(RES)为模板分子,凹凸棒土(ATP)为载体,β-环糊精(β-CD)和甲基丙烯酸(MAA)为双功能单体,采用表面分子印迹技术制备了白藜芦醇分子印迹聚合物(MIPs)。将制得的分子印迹聚合物作为吸附剂填料,填充滤过型净化柱,用于富集净化花生根中的白藜芦醇,建立了分子印迹滤过型净化柱净化/分子荧光光谱测定花生根中白藜芦醇的新方法。在最优化条件下,分子印迹聚合物对RES具有良好的选择性,最大吸附容量可达12.78 mg/g,白藜芦醇在0.1~100 μg/mL浓度范围内呈良好的线性关系(r=0.999 7),方法检出限为0.048 μg/L,样品加标回收率为86.2%~102.1%,相对标准偏差(RSD)为3.5%~5.8%。该方法高效、快速、选择性好,可用于白藜芦醇的快速检测。
关键词:白藜芦醇;分子印迹聚合物;滤过型净化柱;分子荧光光谱法;花生根
Determination of Resveratrol in Peanut Root Using Molecularly Imprinted Polymers Multiplug Filtration Clean-up Column Coupled with Fluorescence SpectrometryQIU Xiu-zhen*,PENG Cui-hong,WANG Shao-ling,GUO Hui-shi,LU Lü-quan
(College of Chemistry and Environmental Engineering,Shaoguan University,Shaoguan512005,China)
Abstract:New molecularly imprinted polymers(MIPs) were prepared by using attapulgite(ATP) as the support,β-CD and methacrylic acid(MAA) as functional monomer,resveratrol as template molecule through surface molecularly imprinted polymerization technology.The MIPs were used as sorbent filled into the multiplug filtration clean-up(m-PFC) column for resveratrol enrichment and purification.A new method was developed for the determination of resveratrol by using multiplug filtration clean-up column with molecularly imprinted polymers extraction(MIPs-m-PFCE) combined with fluorescence spectrometry.The results showed that the present method has a high selectivity for RES under the optimized experimental conditions,the adsorption capacity of MIPs was 12.78 mg/g.The calibration curve was linear in the range of 0.1-100 μg/mL with a correlation coefficient(r) of 0.999 7.The limit of detection was 0.048 μg/L.The proposed method was successfully applied in the determination of RES in peanut root,with average recoveries of 86.2%-102.1% and relative standard deviations(RSDs) of 3.5%-5.8% at three spiked levels.The developed method is rapid and selective,and is adaptable to the analysis of trace RES in real samples.
Key words:resveratrol; molecular imprinted polymers; multiplug filtration clean-up column; molecular fluorescence spectrometry; peanut root
中图分类号:O657.3;TQ460.72
文献标识码:A
文章编号:1004-4957(2015)12-1403-05
doi:10.3969/j.issn.1004-4957.2015.12.013
通讯作者:*丘秀珍,硕士,讲师,研究方向:复杂体系分离分析,Tel:0751-8120118,E-mail:Gold0226@126.com
基金项目:广东省自然科学基金(2014A030307024);2015年广东省大学生创新创业立项项目
收稿日期:2015-06-15;修回日期:2015-07-14

