低温液液萃取/超高效液相色谱-串联质谱法快速测定鲜枣中氟虫腈及代谢物
林 涛,樊建麟,杨东顺,刘兴勇,邵金良,李彦刚,刘宏程*
(1.云南省农业科学院 质量标准与检测技术研究所,云南 昆明 650223;2.农业部农产品质量安全
风险评估实验室(昆明),云南 昆明 650223)
低温液液萃取/超高效液相色谱-串联质谱法快速测定鲜枣中氟虫腈及代谢物
林涛1,2,樊建麟1,杨东顺1,刘兴勇1,邵金良1,李彦刚1,刘宏程1,2*
(1.云南省农业科学院质量标准与检测技术研究所,云南昆明650223;2.农业部农产品质量安全
风险评估实验室(昆明),云南昆明650223)
摘要:采用低温液液萃取技术,对鲜枣中的氟虫腈及其代谢物残留进行提取和净化,并利用超高效液相色谱-串联质谱法(UPLC-MS/MS)进行定性和定量分析。鲜枣样品以乙腈作为提取溶剂,-25 ℃低温液液萃取后,直接进样分析,采用负离子多反应监测(MRM)模式,外标法定量。结果表明,在优化条件下,氟虫腈及其代谢物在0.02~10 μg/L范围内线性关系良好,相关系数(r2)大于0.999,检出限为0.005~0.02 μg/kg,在不同加标浓度下的平均回收率为78.5%~95.8%,相对标准偏差(RSD)为3.4%~6.9%。该方法快速、简便、灵敏,适用于鲜枣中氟虫腈及其代谢物的快速测定。
关键词:低温液液萃取;超高效液相色谱-串联质谱(UPLC-MS/MS);鲜枣;氟虫腈及其代谢物
氟虫腈(Fipronil)是一种广谱的苯基吡唑类杀虫剂,由拜耳作物科学公司于1987年研制开发[1]。氟虫腈在环境中的稳定性较差,使用后经过一系列的物理化学变化会生成氟甲腈(Fipronilde sulfinyl)、氟虫腈砜(Fipronil sulfone)、氟虫腈亚砜(Fipronil sulfide) 3种代谢物(结构式见图1),从而具有较高的毒性[2]。根据我国食品中农药残留限量标准(GB2763-2014)的规定,氟虫腈的残留量是指氟甲腈、氟虫腈砜和氟虫腈亚砜的总量,以氟虫腈表示。
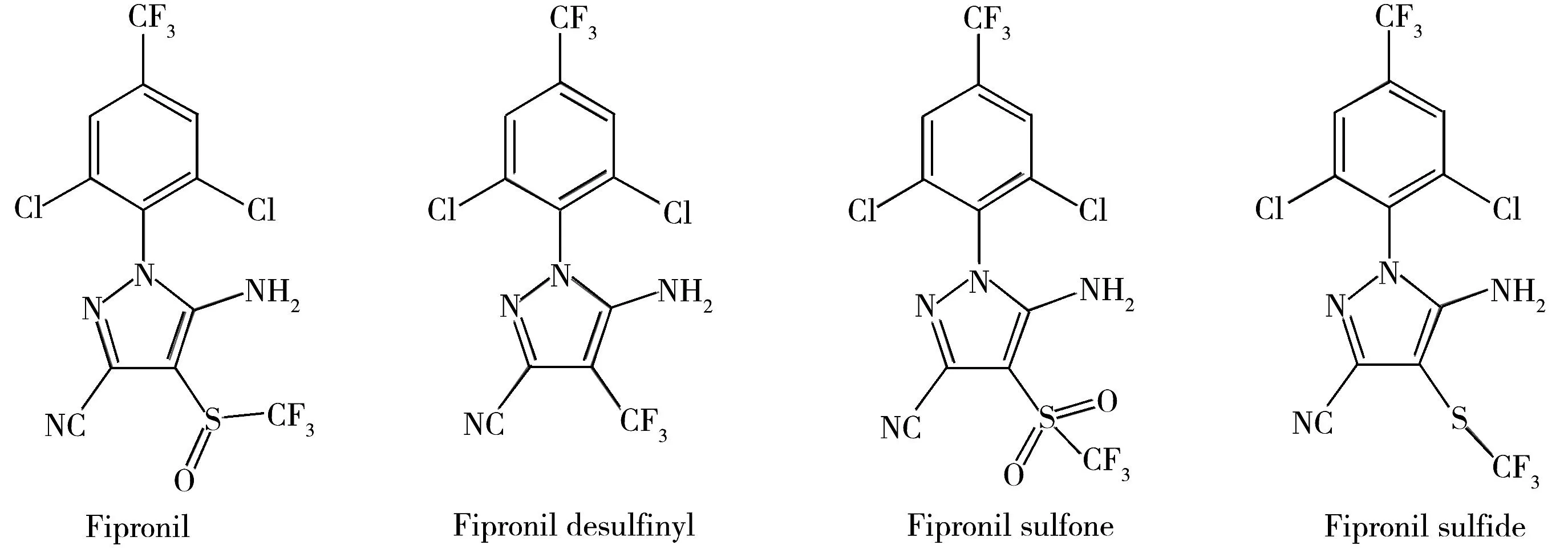
图1 氟虫腈及其代谢物的化学结构
氟虫腈及其代谢物对水生生物的毒性较大,对环境具有一定的污染[3-4],且半衰期较长[5],我国早在2009年10月1日起已禁止使用氟虫腈[6],但目前仍有违法使用的情况发生。我国GB 2763-2014中只规定了氟虫腈及其代谢物在谷物和蔬菜中的最大残留限量,而国际上很少对氟虫腈的最大残留限量进行规定。目前氟虫腈在水果中,特别是鲜枣中的检出率较高,因此建立鲜枣中氟虫腈及其代谢物的快速测定方法意义重大。
目前,氟虫腈及其代谢物的测定方法较多,包括液相色谱[7]、气相色谱[2]、气相色谱-串联质谱法[8]等,这些方法的前处理较复杂,且基质干扰较强,不适于氟虫腈及其代谢物的测定。近年来,超高效液相色谱-串联质谱法因分析速度快、灵敏度高、抗干扰能力强而广泛应用于氟虫腈及其代谢物的测定[9-10]。
样品中氟虫腈及其代谢物的前处理一般采用传统的固相萃取小柱[11]、固相微萃取[2]等方法进行富集纯化,但这些前处理方法步骤较为复杂,且耗费较大;另一方面,低温液液萃取因无需昂贵的前处理材料、简便高效而不断应用于现代农残分析[12-14]。低温液液萃取是利用低温条件下溶于水相的有机物分子会不断扩散到水相而进入有机相中,从而实现液液萃取的目的,常用的有机溶剂为乙腈[15]。本研究将低温液液萃取与超高效液相色谱-串联质谱结合,首次应用于鲜枣中氟虫腈及其代谢物的测定,并对其前处理步骤进行优化,建立了快速测定鲜枣中氟虫腈及其代谢物残留的方法,为鲜枣的质量安全评估提供更为快速灵敏的分析方法。
1实验部分
1.1仪器与试剂
API4000三重四极杆质谱仪(美国AB公司);1290超高效液相色谱仪(美国Agilent公司);ZORBAXRRHD色谱柱(2.1 mm×50 mm,1.8 μm,美国Agilent公司);AE100电子分析天平(瑞士Mettler Toledo公司);涡旋振荡器(美国 Thermo Scientific公司)。
甲醇、乙腈(色谱纯,德国Merck公司);纯净水(杭州娃哈哈公司);氟虫腈、氟甲腈、氟虫腈砜、氟虫腈亚砜标准品(100 μg/mL,百灵威科技)。
1.2实验方法
1.2.1标准溶液配制将液体标准物质用甲醇稀释成10 μg/mL的标准储备液。准确吸取一定体积的各标准储备液,用甲醇定容,得到氟虫腈及其代谢物的混合标准溶液,-20 ℃下避光保存。
1.2.2样品处理鲜枣样品经食品加工机充分粉碎混匀后,称取10 g样品于离心管中,加入20 mL乙腈、1 g氯化钠,涡旋振荡1 min,于-25 ℃下冷冻3 h后,吸取上层提取液1.0 mL过0.22 μm滤膜,待分析。
1.2.3色谱条件流动相:A为水溶液,B为甲醇。梯度洗脱条件:0~5.0 min,55%~10%A;5.0~6.0 min,10%A;6.0~6.1 min,10%~55%A;6.1~7.0 min,55%A。柱温:35 ℃;流速:0.2 mL/min;进样量:1 μL。
1.2.4质谱条件离子源:ESI源;监测模式:MRM;扫描方式:负离子模式,气帘气流量20 L/min;辅助气流量55 L/min;雾化气流量55 L/min;辅助加热气温度550 ℃,喷雾电压-5 500 V,相关参数见表1。
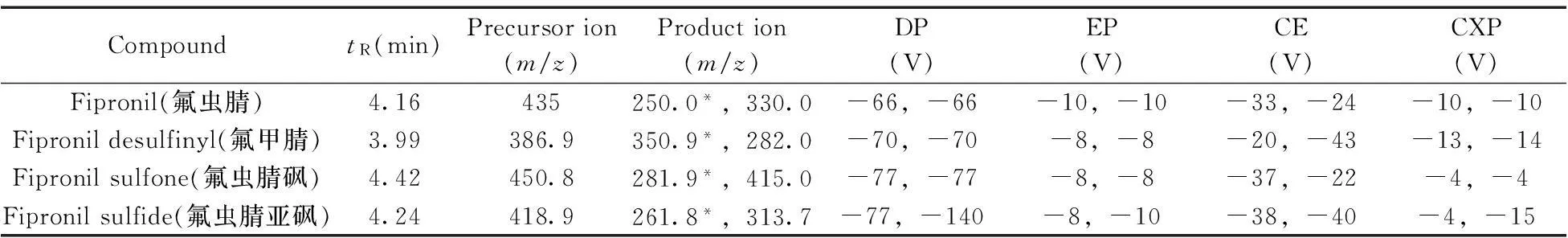
表1 氟虫腈及其代谢物的相关质谱参数
*quantitative ion
2结果与讨论
2.1色谱条件的优化
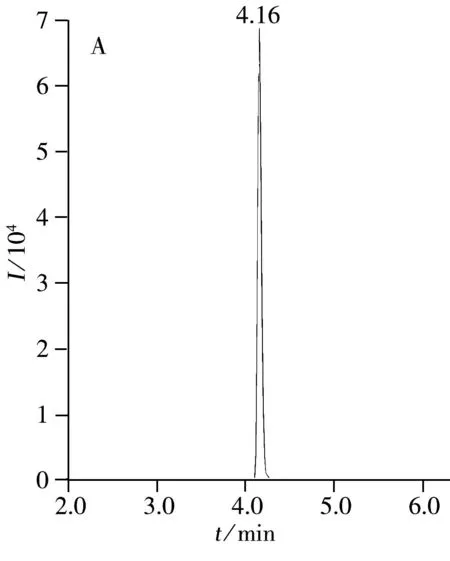
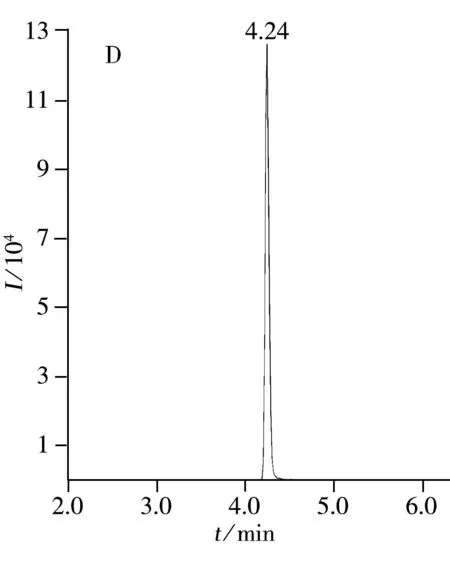
本实验选用Agilent ZORBAX RRHD色谱柱,根据氟虫腈及其代谢物的化学结构可知其pH值适中,故采用常见的甲醇-水流动相体系可得到较好的分析效果,且峰形对称,无拖尾;另一方面,由于采用负离子扫描模式,故无需在流动相中加入乙酸铵或甲酸铵盐。氟虫腈及其代谢物的色谱图如图2A~D所示,空白基质加标的总离子流图如图2E所示。结果表明氟虫腈及其代谢物在甲醇-水流动相体系中的峰形较好,且在出峰处无干扰。
2.2质谱条件的优化选择
2.2.1离子对的优化参照文献[16]确定氟虫腈的离子对条件,并根据本实验所用的仪器对其他相关参数进行优化。由于氟甲腈、氟虫腈砜和氟虫腈亚砜的化学结构与氟虫腈类似,因此,实验采用负离子模式,分别将氟虫腈代谢物的标准溶液稀释至0.1 mg/L,利用流动注射泵进样,进行一级质谱扫描,并确定其准分子离子峰,同时优化其解簇电压(DP)和入口电压(EP),再以准分子离子进行二级质谱扫描,选择丰度较高的2个碎片离子分别作为定量与定性离子,并优化其碰撞能量(CE)和碰撞室出口电压(CXP)等。氟虫腈及其代谢物的相关质谱参数如表1所示。
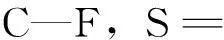
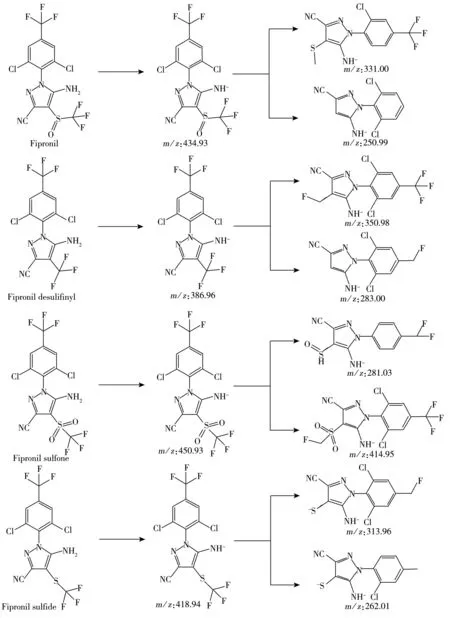
图3 氟虫腈及其代谢物的子离子可能断裂方式
2.3低温液液萃取条件的优化
2.3.1提取溶剂体积的优化乙腈是一种特殊的提取溶剂,在常温下能与水互溶,而在低温下会与水相分层。本实验称取鲜枣样品10 g,以1 μg/g作为加标浓度,-25 ℃低温提取2 h,比较了乙腈体积分别为5,10,15,20,30 mL时的提取效果。结果表明,当提取溶剂为20 mL时,氟虫腈及其代谢物的回收率均接近100%,符合日常检测的要求;当提取溶剂为5,10,15 mL时,在冷冻提取后存在一定的基质增强效应;而当提取溶剂体积为30 mL时,4种目标化合物的回收率小于20 mL时,故选择提取溶剂的体积为20 mL。
2.3.2氯化钠加入量的优化称取鲜枣样品10 g,加入20 mL乙腈,以1 μg/g作为加标浓度,比较了氯化钠的加入量分别为0,1,2,3,4,5 g时的提取效果。结果表明,不加氯化钠时,氟虫腈及其代谢物的回收率范围较宽,为80%~122%;而加入氯化钠后,4种目标化合物的回收率为91%~102%,范围缩小,且接近100%。表明氯化钠的加入可增强体系中的离子强度,从而增大水分子对盐离子的溶解,同时提高目标化合物在有机相中的溶解度。氯化钠加入量为1,2,3,4,5 g时,目标化合物的回收率相差不大,因此,为节约实验成本,选取氯化钠的加入量为1 g。
2.3.3冷冻提取时间的优化以1 μg/g作为加标浓度,-25 ℃为冷冻提取温度,加入1 g氯化钠,考察了冷冻提取时间分别为1,2,3,5,7 h的提取效果。结果显示,在低温条件下,水相中有机化合物的溶解度不断降低而逐步溶于有机相中,这一过程与冷冻的时间及其实验基质有关。当冷冻提取时间小于3 h时,整个提取体系未达到液液分配平衡,如氟虫腈和氟甲腈的回收率随冷冻时间的延长而增大,而当冷冻提取的时间达到3 h后,4种目标化合物的回收率趋于平衡。因此实验选择3 h作为冷冻提取时间。
2.4方法学考察
2.4.1基质效应基质效应是指质谱分析中基质中的干扰物会影响目标化合物的离子化,从而对目标化合物的离子化产生增强或抑制作用[17]。目前,对于基质效应的评价方法较多,本研究参照文献方法[18],即提取后分别定量测定空白基质提取液和纯溶剂中相同浓度分析物的响应强度,基质效应=空白基质标准响应值/纯溶剂标准响应值×100%。当基质效应>1时,为基质增强效应;当基质效应<1时,为基质抑制效应;当基质效应=1时,无基质抑制效应。一般情况下,基质效应在80%~120%内为正常的范围。因此采用上述方法对氟虫腈及其代谢物在鲜枣中的基质效应进行评价,结果表明,氟虫腈及其代谢物在鲜枣中的基质效应为83%~95%,存在一定的基质抑制效应。因此采用空白鲜枣基质添加标准溶液的方法提高定量分析的准确性。
2.4.2线性范围与检出限分别将氟虫腈及其代谢物的标准溶液稀释成不同的浓度,以峰面积对4种农药的浓度(μg/L)进行线性回归。利用鲜枣的空白基质,通过氟虫腈及其代谢物标准物的添加,分别以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)确定方法的检出限(LOD)和定量下限(LOQ)。4种农药的线性范围如表2所示,相关系数(r2)为0.999 0~0.999 5,LOD为0.005~0.02 μg/kg,LOQ为0.02~0.08 μg/kg。本方法的检出限远低于GB 2763-2014标准中所规定氟虫腈在蔬菜中的最大残留限量20 μg/kg。
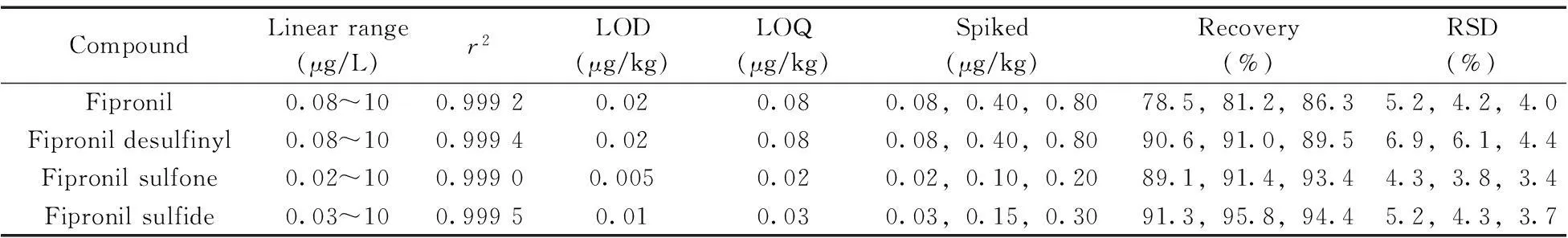
表2 氟虫腈及其代谢物的线性范围、相关系数(r2)、检出限、定量下限、回收率与相对标准偏差
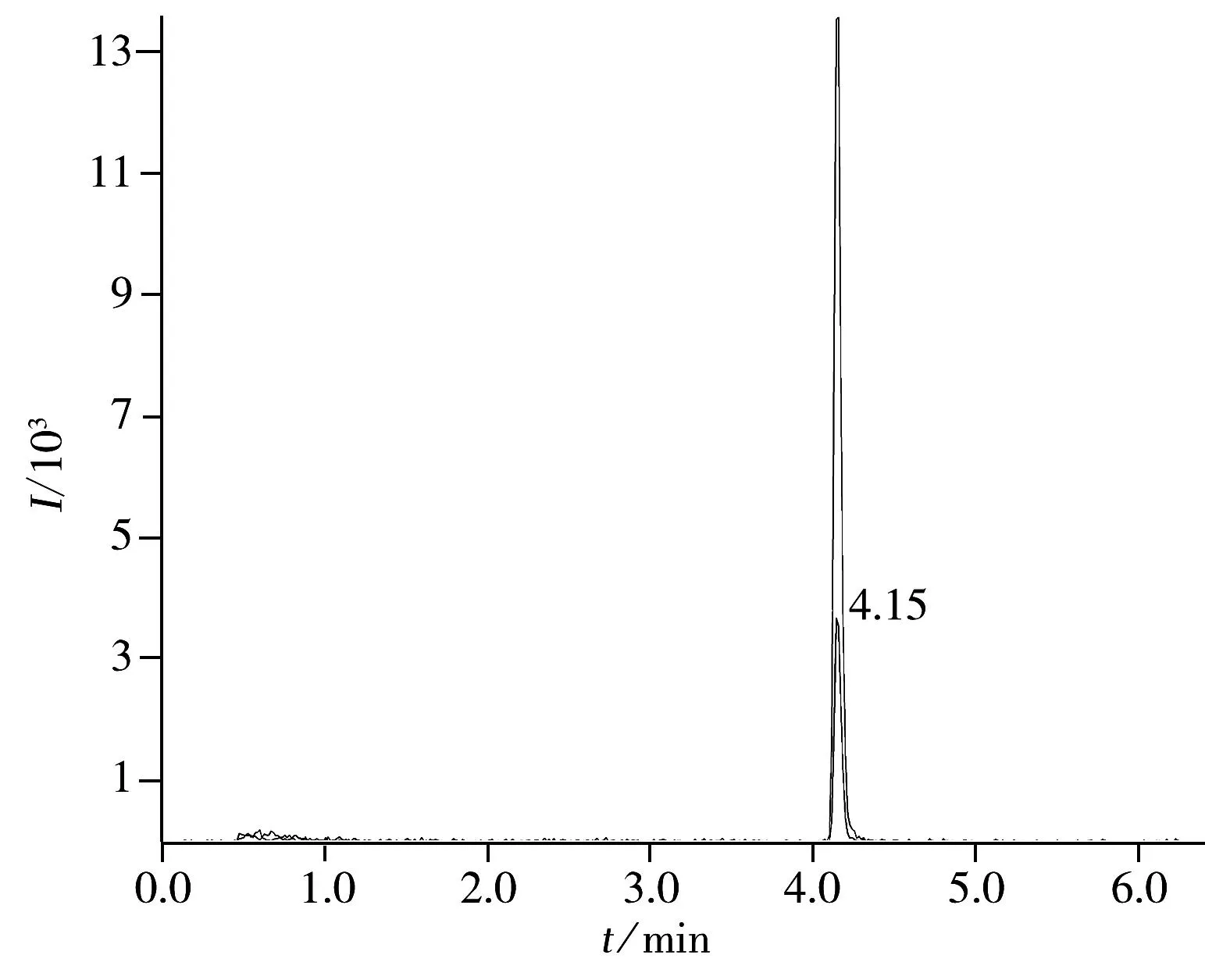
图4 氟虫腈阳性大枣样品的色谱图Fig.4 Chromatogram of fipronil positive jujube sample
2.4.3回收率与精密度以鲜枣为实验对象,分别以1倍、5倍和10倍定量下限作为低、中、高3个加标浓度进行回收实验,每个加标浓度平行测定6次。氟虫腈及其代谢物的平均回收率为78.5%~95.8%,相对标准偏差(RSD)为3.4%~6.9%(表2)。
2.4.4与QuECeERS法的比较参照文献中QuEChERS的操作步骤[19],以0.1 μg/kg为加标浓度,将本方法与QuEChERS法进行比较。实验结果表明,利用QuEChERS法时,氟虫腈、氟甲腈、氟虫腈砜、氟虫腈亚砜的平均回收率分别为81.3%,87.2%,90.5%和89.8%,与本方法所得的回收率相当。但QuEChERS法所用净化填料的价格相对较贵,而本方法只需使用氯化钠等价格低廉的材料;另一方面,利用QuEChERS法需使用离心机等其他仪器,操作步骤相对复杂。因此,利用本方法对鲜枣中的氟虫腈及其代谢物进行测定更简单快捷。
2.5实际样品的测定
利用本方法对产自云南省(10个)和山东省(10个)的鲜枣共计20个样品进行氟虫腈及其代谢物的测定,结果表明,云南省样品中有3个测出氟虫腈,含量分别为0.01,0.006,0.007 mg/kg,山东省样品中有3个测出氟虫腈,含量分别为0.003,0.007,0.005 mg/kg。所有样品均未测出氟甲腈、氟虫腈砜和氟虫腈亚砜,参照国家标准对于蔬菜中氟虫腈最大残留限量的规定,所得结果均小于国家规定的最大残留限量。图4为1个氟虫腈阳性大枣样品的色谱图,氟虫腈含量为0.003 mg/kg。
参考文献:
[1]Chen S S,Ding C,Guo L X,Ma X D,Lin Y.J.Chin.Mass.Spectrom.Soc.(陈珊珊,丁丞,郭立新,马晓东,林燕.质谱学报),2013,34(5):274-281.
[2]Zhou Y,Xu D M,Chen D J,Zhang Z G,Zheng X H,Fang E H.Chin.J.Chromatogr.(周昱,徐敦明,陈达捷,张志刚,郑向华,方恩华.色谱),2011,29(7):656-661.
[3]Konwick B J,Fisk A T,Garrison A W,Avants J K,Black M C.Environ.Toxicol.Chem.,2005,24(9):2350-2355.
[4]Key P B,Chung K W,Opatkiewicz A D,Wirth E F,Fulton M H.Bull.Environ.Toxicol.,2003,70(3):0533-0540.
[5]Zhu G N,Wu H M,Guo J F,Kimaro F M E.Water,Air,SoilPollut.,2004,153(1/4):35-44.
[6]Ministry of Agriculture.No.1157 Bulletin of the Ministry of Agriculture of the People’s Republic of China(农业部.中华人民共和国农业部公告第1157号).[2009-02-08].http://www.moa.gov.cn/zwllm/tzgg/gg/200902/t20090227_1226994.htm.
[7]Bai B Q,Li M P,Zhang W S.FoodSci.(白宝清,李美萍,张生万.食品科学),2014,35(24):254-258.
[8]Rong J F,Wei H,Xu M Z,Weng C W,Li Y J,Huang W J.Chin.J.Anal.Lab.(荣杰峰,韦航,许美珠,翁城武,李亦军,黄炜娟.分析试验室),2014,33(1):69-72.
[9]Yan Z,Nie J Y,Xu G F,Li H F,Li J,Li Z X,Wu Y L,Kuang L X.J.Instrum.Anal.(闫震,聂继云,徐国锋,李海飞,李静,李志霞,毋永龙,匡立学.分析测试学报),2014,33(9):1000-1009.
[10]Kadar A,Faucon J P.J.Agric.FoodChem.,2006,54(26):9741-9746.
[11]Zhou X D,Yu B,Hu J.J.Agro-Environ.Sci.(周晓冬,余兵,胡进.农业环境科学学报),2007,26(B03):211-214.
[12]Saraji M,Tansazan N.J.Sep.Sci.,2009,32(23/24):4186-4192.
[13]Goulart S M,Alves R D,Neves A A,de Queiroz J H,de Assis T C,de Queiroz M E L R.Anal.Chim.Acta,2010,671(1):41-47.
[14]Cho S K,El-Aty A M A,Park K H,Park J H,Assayed M E,Jeong Y M,Park Y S,Shim J H.FoodChem.,2013,136(3):1414-1420.
[15]Bekhterev V N.J.Anal.Chem.,2008,63(10):950-953.
[16]Hu B Z,Cai H J,Song W H.Chin.J.Chromatogr.(胡贝贞,蔡海江,宋伟华.色谱),2012,30(9):889-895.
[17]Guo J,Ding L P,Wu W F,Zhao J H,Chen Z T.J.Instrum.Anal.(郭菁,丁立平,吴文凡,赵建晖,陈志涛.分析测试学报),2015,34(1):28-34.
[18]Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal.Chem.,2003,75(13):3019-3030.
[19]Li R,Chu D K,Zhang P J,Gao Y Q,Huang S Y.J.Instrum.Anal.(李蓉,储大可,张朋杰,高永清,黄思允.分析测试学报),2015,34(5):502-511.

Determination of Fipronil and Its Metabolites in Fresh Jujube by Low Temperature Liquid-Liquid Extraction/Ultra High Liquid Chromatography-Tandem Mass SpectrometryLIN Tao1,2,FAN Jian-lin1,YANG Dong-shun1,LIU Xing-yong1,SHAO Jin-liang1,LI Yan-gang1,LIU Hong-cheng1,2*
(1. Institute of Agriculture Quality Standards & Testing Technique,Yunnan Academy of Agricultural Science,
Kunming650223,China;2. Laboratory of Quality & Safety Risk Assessment for Agro-products
(Kunming),Ministry of Agriculture,Kunming650223,China)
Abstract:An analytical method for the qualitative and quantitative analyses of fipronil and its metabolites residues in fresh jujube was developed by using low temperature liquid-liquid extraction and ultra high liquid chromatography-tandem mass spectrometry(UPLC-MS/MS). The fresh jujube sample was extracted with acetonitrile,followed by liquid-liquid extraction at -25 ℃. The analysis of fipronil and its metabolites was performed under negative ion mode and multiple reaction monitoring(MRM),quantified by the external standard method. Under the optimized conditions,the fipronil and its metabolites showed good linearities in the range of 0.02 - 10 μg/L,with correlation coefficients(r2) higher than 0.999. The limits of detection of the method were in the range of 0.005-0.02 μg/kg. The average recoveries of fipronil and its metabolites in fresh jujube matrices were in the range of 78.5%-95.8% with relative standard deviations of 3.4%-6.9%. The method is simple and highly sensitive,and is suitable for the rapid determination of fipronil and its metabolites in fresh jujube.
Key words:low temperature liquid-liquid extraction;ultra high liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);fresh jujube;fipronil and its metabolites
中图分类号:O657.63;S482.3
文献标识码:A
文章编号:1004-4957(2015)12-1360-06
doi:10.3969/j.issn.1004-4957.2015.12.005
通讯作者:*刘宏程,博士,研究员,研究方向:农产品质量安全与风险评估,Tel:0871-65140403,E-mail:liuorg@163.com
基金项目:2015年国家农产品质量安全风险评估项目(GJFP2015001);云南省科技创新平台建设计划(2014DA001)
收稿日期:2015-06-16;修回日期:2015-07-09

