FOXP3+Treg细胞对浸润性乳腺癌患者新辅助化疗疗效的预测价值分析
窦冬青 张天才 郭广成 张连平
(郑州大学第一附属医院 乳腺外科2病区 河南 郑州 450052)
FOXP3+Treg细胞对浸润性乳腺癌患者新辅助化疗疗效的预测价值分析
窦冬青张天才郭广成张连平
(郑州大学第一附属医院 乳腺外科2病区河南 郑州450052)
【摘要】目的观察新辅助化疗对浸润性乳腺癌患者外周血及组织中CD4+CD25+FOXP3+Treg细胞的影响,探讨FOXP3+Tregs对乳腺癌新辅助化疗疗效的预测价值。方法回顾性分析郑州大学第一附属医院2013年1月至2014年12月期间收治的73例治疗前均经病理活检证实的女性浸润性乳腺癌患者,采用TAC方案(多西他赛+阿霉素+环磷酰胺)新辅助化疗2个周期。采集新辅助化疗前1 d和化疗后第10天的外周静脉血,应用流式细胞仪检测外周血中CD4+、Treg细胞的变化;采用免疫组化法检测乳腺癌组织中FOXP3的表达,评估患者新辅助化疗后的疗效,并分析FOXP3+Tregs的高低与病理完全缓解率(pCR)之间的关系。结果乳腺癌患者新辅助化疗后外周血中Treg细胞明显下降,CD4+细胞及CD4+细胞/Treg细胞显著升高,差异具有统计学意义(P<0.05)。化疗后57例有效组患者Treg细胞较16例无效组患者明显降低,差异有统计学意义(P<0.05)。pCR为17.8%,而FOXP3+Tregs高表达患者较低表达患者病理完全缓解率低(P=0.016)。结论新辅助化疗可降低乳腺癌患者外周血Treg细胞的比例;乳腺癌组织中Treg细胞FOXP3表达水平可预测乳腺癌新辅助化疗的疗效,将作为指导乳腺癌治疗的一个潜在指标。
【关键词】乳腺肿瘤;新辅助化疗;CD4+CD25+FOXP3+调节性T细胞
据文献统计报道,发达国家乳腺癌发病率逐年升高,世界范围内每年新患乳腺癌人数约100万以上。在我国每年城市乳腺癌的女性患者死亡率可达到38.9%,因此,对乳腺癌患者的治疗和预防仍是一项值得长期研究的课题[1]。新辅助化疗作为乳腺癌综合治疗常用的手段之一,可用于局部晚期乳腺癌患者的降阶梯治疗,增加保乳的机会;新辅助化疗还能在个体化疗中检测并筛选新药在体内的敏感性,推动新药的研发。新辅助化疗过程中达到病理完全缓解(pCR)患者的DFS和OS明显延长,而另一部分患者则出现疾病进展甚至远处转移。因此,在新辅助化疗前准确预测个体新辅助化疗的疗效显得至关重要。
研究表明,CD4+CD25+FOXP3+调节性T细胞(regulatory T cells,Treg细胞)能够抑制CD8+T细胞增殖[2],故推测其有助于肿瘤细胞实现免疫逃逸、浸润生长及增殖。在正常人体内存在着少量的Treg细胞,而肿瘤患者体内均有大量的Treg细胞存在[3],Tan等[4]发现肿瘤组织中Treg细胞数明显增加与肿瘤进展程度以及患者预后成负相关。本研究通过观察新辅助化疗对乳腺癌患者机体免疫功能的影响,以及FOXP3+Tregs与乳腺癌患者临床预后之间的关系,探讨FOXP3作为Tregs的一个重要标志性因子,能否作为一个预测乳腺癌新辅助化疗效果的潜在靶点。
1资料和方法
1.1临床资料选取2013年1月至2014年12月期间郑州大学第一附属医院乳腺外二科收治的73例女性乳腺癌住院患者,年龄29~67岁,平均年龄46.5岁。入选患者均经病理活检确诊为浸润性乳腺癌,治疗前1个月内未接受任何抗肿瘤治疗,近3个月内未用过免疫增强剂,无合并影响疗效的其他疾病。乳腺癌病理组织学类型:浸润性导管癌68例,浸润性小叶癌5例。按2009年美国癌症联合委员会JMCC乳腺癌TNM分期标准:Ⅱa期12例,Ⅱb期18例,Ⅲa期20例,Ⅲb期16例,Ⅲc期7例。搜集该73例患者的术前病理活检乳腺癌标本,置于-80 ℃冰箱备用。
1.2新辅助化疗与疗效评价73例患者均于术前给予TAC方案[多西他赛(T)75 mg/m2,d1;阿霉素(A)50 mg/m2,d1;环磷酰胺(C)500 mg/m2,d1]新辅助化疗2个周期。化疗前后及治疗过程中定期复查血常规、肝肾功能、CT等检查。每2周期治疗结束2周后评价疗效,患者接受新辅助化疗2个周期后行手术治疗。根据世界卫生组织(WHO)实体瘤疗效评价标准对目标病灶进行新辅助化疗的疗效评估,分为病理完全缓解(pCR)、临床完全缓解(cCR)、临床部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。
1.3试剂与仪器鼠抗人FITC-CD4单克隆抗体、鼠抗人PE-CD25 单克隆抗体(美国BD公司);CD4的同型对照分别是鼠抗人FITC-IgG1免疫球蛋白和PC-IgG1免疫球蛋白(Beckman Coulter);SP9000试剂盒(北京中杉金桥生物工程公司);鼠抗人FoxP3单克隆抗体(Santa Cruz),DAB显色液、柠檬酸缓冲修复液(福州迈新生物技术公司),荧光显微镜(OLYMPUS IX71),流式细胞仪(Beckman Coulter Epics XL)。
1.4流式细胞仪和免疫组化法分别检测外周血及乳腺癌组织中FOXP3+Treg细胞的变化在化疗前1 d和2个化疗周期后第10天清晨空腹抽取外周静脉血4 ml,每例患者制备3份样品,每个样品管中加入100 μl外周血及不同荧光标记的单克隆抗体各20 μl,暗室孵育、裂解红细胞、固定、制成重悬缓冲液。然后用流式细胞仪检测,并测定淋巴细胞区域CD4+CD25+FOXP3+Treg细胞百分率。搜集乳腺癌患者治疗前穿刺活检标本,切片常规脱蜡水化后,采用SP免疫组化法检测标本中Treg细胞FOXP3+的表达。严格按照SP试剂盒说明书步骤进行操作,用病理已经确诊为阳性的乳腺癌标本作为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。每张标本选取10个高倍镜视野,视野中FOXP3+Treg细胞的均值≥15定义为FOXP3高表达。
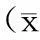
2结果
2.1乳腺癌患者化疗前、后外周血中T细胞亚群的比较乳腺癌患者新辅助化疗前外周血中Treg细胞占T淋巴细胞比例较化疗后明显下降,差异有统计学意义(P<0.05);新辅助化疗前外周血中CD4+细胞、CD4+细胞/Treg细胞较化疗后显著升高,差异有统计学意义(P<0.05)。见表1。
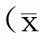
表1 新辅助化疗前、后外周血T淋巴细胞亚群的比较±s)
2.2新辅助化疗前、后不同疗效乳腺癌患者Treg细胞的变化经2个周期的新辅助化疗后对73例乳腺癌患者进行疗效评价,其中pCR 13例,cCR 15例,PR 29例,SD 10例,PD 6例,有效组(pCR+cCR+PR)57例,无效组(SD+PD)16例。对化疗前后有效组与无效组两组患者的Treg细胞进行比较,结果显示化疗前两组Treg细胞的差异无统计学意义(P>0.05);而化疗后有效组的Treg细胞较无效组的Treg细胞明显降低,差异有统计学意义(P<0.05)。 见表2。
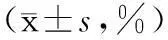
表2 新辅助化疗前、后不同疗效乳腺癌患者Treg细胞的比较
2.3FOXP3表达水平和乳腺癌新辅助化疗疗效的关系所有患者在化疗期间,均无化疗药物的更换以及剂量的下调。73例患者经TAC方案新辅助化疗后,pCR为17.8%,FOXP3表达水平与疗效采用χ2检验进行关联性分析,两变量相互独立,不存在相关性(χ2=8.289,P=0.082)。疗效比较应用χ2检验或Fisher精确概率法,其中FOXP3+Tregs高表达患者pCR率较低表达患者明显降低(P=0.016),见表3。FOXP3在乳腺癌组织中表达情况见图1。
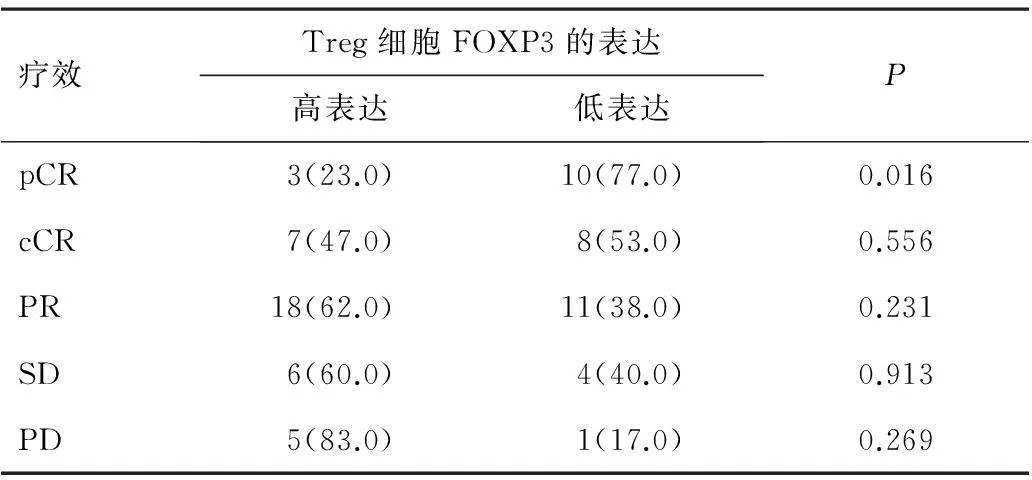
表3 FOXP3高表达和低表达患者经TAC方案治疗的疗效比较[n(%)]
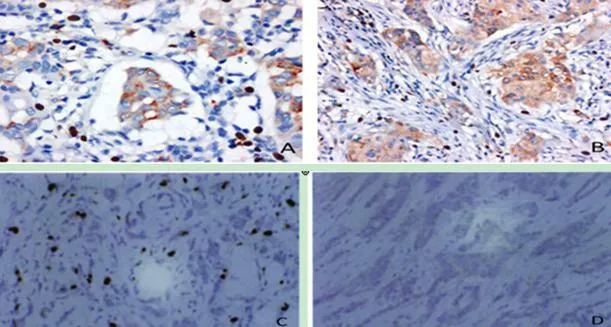
图1 FOXP3+Treg细胞在浸润性乳腺癌患者中的不同表达
注:A为FOXP3+Treg细胞表达变化图(SP×400);B为FOXP3+Treg细胞表达变化图(SP×200);C为FOXP3+Treg细胞在乳腺癌组织中高表达图(SP×200);D为FOXP3+Treg细胞在乳腺癌组织中低表达图(SP ×200)。
3讨论
近年来研究表明,在乳腺癌[5],黑色素瘤[6],卵巢癌,肺癌,胃癌[7],前列腺癌,肝癌,胰腺癌[8]等恶性肿瘤患者的外周血和肿瘤局部微环境中Treg细胞比例均明显增高,其愈来愈受到学者的重视。Treg细胞是一类具有负免疫调节作用的特殊T细胞亚群,对免疫系统功能具有抑制效应,维持机体的免疫稳态。另外,Treg细胞具有参与肿瘤免疫调节的功能,与肿瘤细胞的免疫逃逸及免疫耐受有密切关系。FOXP3是一种叉头状/翼状螺旋转录因子(FOXP3)基因编码的蛋白,作为Treg细胞特异性标志物,已在多种恶性肿瘤中检测到表达升高,且FOXP3+的表达对Treg细胞的成熟和功能形成发挥重要作用[9]。有研究发现,在转基因小鼠体内检测到的FOXP3量越多,同时发现其体内的Treg细胞数越多[10]。Takenaka等[11]检测到乳腺癌组织中FOXP3及其他调节性T细胞相关分子含量较正常乳腺组织含量升高,且与乳腺癌预后有关。一些研究显示,FOXP3+Treg细胞与ER、PR成负相关,与组织分级、淋巴结转移、Her2成正相关[12]。而且,FOXP3甚至可能成为三阴性乳腺癌的一个靶作用点[13]。
新辅助化疗是局部晚期乳腺癌综合治疗的常用方法之一,TAC方案目前作为乳腺癌化疗的常用方案广泛应用于临床。Treg细胞在多种肿瘤的发生发展﹑肿瘤免疫治疗以及抑制自身免疫性疾病发生等方面起着至关重要的作用[14],而乳腺癌的发生、发展、复发和转移与机体免疫功能状态密切相关。因此,本研究通过Treg细胞的高低变化观察新辅助化疗对乳腺癌患者免疫功能及疗效的影响。实验结果显示乳腺癌患者经过2个周期的多西他赛+阿霉素+环磷酰胺新辅助化疗后,外周血CD4+细胞及CD4+细胞/Treg细胞显著升高,Treg细胞水平则明显下降。其可能机制为新辅助化疗通过细胞毒作用杀灭肿瘤细胞或诱导其凋亡等,有效控制肿瘤生长,减轻机体的瘤负荷,从而排除某些免疫抑制因素,使乳腺癌患者的细胞免疫功能得到一定程度的恢复。本研究中对化疗前后有效组与无效组两组患者的外周血Treg细胞进行比较,结果发现化疗前两组Treg细胞的差异无统计学意义,而化疗后有效组的Treg细胞较无效组的Treg细胞明显降低。这可能是由于疗效达到PR的患者对化疗更敏感,多西他赛+阿霉素+环磷酰胺新辅助化疗杀死了大量肿瘤细胞,使肿瘤体积明显缩小,解除了肿瘤细胞通过释放某些免疫抑制因子诱导Treg细胞的增生;另外,多西他赛+阿霉素+环磷酰胺的非选择性杀伤作用对增殖活跃的Treg细胞也有一定的杀伤作用,使化疗后Treg细胞进一步降低,从而减少其对肿瘤免疫的抑制,二者共同作用使新辅助化疗后的细胞免疫功能得到明显改善。
目前尚缺乏公认的新辅助化疗的有效预测因子,主要通过临床及病理有效率判断疗效,而两者往往具有滞后性[15]。因此,在新辅助化疗前准确预测个体新辅助化疗疗效具有重要的临床意义。本研究还通过免疫组化测定瘤体内FOXP3含量对新辅助化疗的疗效进行预测,结果显示73例患者经TAC方案新辅助化疗后,病理完全缓解率(pCR)为17.8%,在浸润性乳腺癌组织中存在大量FOXP3+Tregs细胞,且FOXP3高表达较低表达的乳腺癌患者pCR显著降低(P<0.05),这可能与高表达FOXP3的患者常伴有较高的组织学分级及淋巴结转移有关,提示FOXP3可作为新辅助化疗的一个有效预测因子,对判断和改善乳腺癌患者的预后可能具有积极意义。考虑到样本量有限且化疗方案单一,新辅助化疗预测是一个复杂的过程,临床存在不可避免的偏差。今后将进行大样本的临床实验对其机制进一步研究,更有效地预测疗效进而提高肿瘤综合治疗的效果。
参考文献
[1]徐光炜,胡永昇,阚秀,等.中国10万妇女乳腺癌筛查初探[J].中国肿瘤,2010,19(9):565-568.
[2]Kastenmuller W,Gasteiger G,Subramanian N,et al.Regulatory T cells selectively control CD8+T cell effector pool size via IL-2 restriction[J]. J Immunol,2011,187(6):3186-3197.
[3]Rettig L,Seidenberg S,Parvanova I,et al.Gemcitabine depletes regulatory T-cells in human and mice and enhances triggering of vaccine-specific cytotoxic T-cells[J].Int J Cancer,2011,129(4):832-838.
[4]Tan W,Zhang W,Strasner A,et al.Tumour-infiltrating regulatory T cells stimulate mammary cancer metastasis through RANKL-RANK signalling[J].Nature,2011,470(7335):548-553.
[5]Li C H,Kuo W H,Chang W C,et al.Activation of regulatory T cells instigates functional down-regulation of cytotoxic T lymphocytes in human breast cancer[J].Immunol Res,2011,51(1):71-79.
[6]Jacobs J F,Nierkens S,Figdor C G,et al.Regulatory T cells in melanoma: the final hurdle towards effective immunotherapy?[J].Lancet Oncol,2012,13(1):e32-e42.
[7]Lu X,Liu J,Li H,et al.Conversion of intratumoral regulatory T cells by human gastric cancer cells is dependent on transforming growth factor-beta1[J].J SurgOncol,2011,104(6):571-577.
[8]Yamamoto T,Yanagimoto H,Satoi S,et al.Circulating CD4+CD25+regulatory T cells in patients with pancreatic cancer[J].Pancreas,2012,41(3):409-415.
[9]Lal A,Chan L,Devries S,et al.FOXP3-positive regulatory T lymphocytes and epithelial FOXP3 expression in synchronous normal,ductal carcinoma in situ,and invasive cancer of the breast[J].Breast Cancer Res Treat,2013,139(2):381-390.
[10]Josefowicz S Z,Niec R E,Kim H Y,et al.Extrathymically generated regulatory T cells control mucosal TH2 inflammation[J].Nature,2012,482(7385):395-399.
[11]Takenaka M,Seki N,Toh U,et al.FOXP3 expression in tumor cells and tumor-infiltrating lymphocytes is associated with breast cancer prognosis[J].Mol Clin Oncol,2013,1(4):625-632.
[12]Liu F,Lang R,Zhao J,et al.CD8(+) cytotoxic T cell and FOXP3(+) regulatory T cell infiltration in relation to breast cancer survival and molecular subtypes[J].Breast Cancer Res Treat,2011,130(2):645-655.
[13]Lopes L F,Guembarovski R L,Guembarovski A L,et al.FOXP3 transcription factor: a candidate marker for susceptibility and prognosis in triple negative breast cancer[J].Biomed Res Int,2014,2014:341654.
[14]Byrne W L,Mills K H,Lederer J A,et al.Targeting regulatory T cells in cancer[J].Cancer Res,2011,71(22):6915-6920.
[15]苏静,陈航航,李孟圈,等.FOXP3+调节性T细胞对浸润性乳腺癌患者新辅助化疗效果的预测价值[J].中华医学杂志,2015,95(8):595-597.
The value of FOXP3+Treg cells in predicting the curative effect of
neoadjuvant chemotherapy in patients with invasive breast cancer
Dou Dongqing, Zhang Tiancai, Guo Guangcheng, Zhang Lianping
(DepartmentofBreastSurgery,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
【Abstract】ObjectiveTo observe the effect of the neoadjuvant chemotherapy on CD4+CD25+FOXP3+Treg cells in the peripheral blood and tissues of the patients with invasive breast cancer, and explore the predictive value of the FOXP3+Tregs to the efficacy of neoadjuvant chemotherapy of breast cancer. MethodsA total of 73 female patients with invasive breast cancer confirmed by pathological biopsy before treatment in the First Affiliated Hospital of ZhengZhou University from January of 2013 to December of 2014 were retrospectively analyzed. During two cycles of the TAC regimen as neoadjuvant chemotherapy, peripheral venous blood samples were collected on the first day before neoadjuvant chemotherapy and the tenth day after neoadjuvant chemotherapy, and flow cytometry was used to test the changes of CD4+and Treg cells in peripheral blood. FOXP3 Tregs in tissue were assessed by immunohistochemistry, and the relationship between the high or low expression of FOXP3+Tregs and the pathological complete response (pCR) rate was analyzed. ResultsTreg cells in the peripheral blood of patients with breast cancer were decreased obviously. However, CD4+cells and CD4+cells/Treg cells were increased significantly after neoadjuvant chemotherapy, and the difference was statistically significant(P<0.05). Treg cells in the 57 patients from effective chemotherapy group were significantly lower than 16 patients of invalid group(P<0.05). The pCR was 17.8%. Compared with the patients with low expression of FOXP3+Tregs, pathologic complete response rate was lower in patients with high expression of FOXP3+Tregs(P=0.016). ConclusionNeoadjuvant chemotherapy can reduce the proportion of Treg cells in peripheral blood of breast cancer patients. The expression level of FOXP3 in Treg cells of breast cancer tissue can predict the curative effect of neoadjuvant chemotherapy, and will serve as a potential indicator of breast cancer treatment.
【Key words】breast tumor; neoadjuvant chemotherapy; CD4+CD25+FOXP3+regulatory T cells
收稿日期:(2015-06-26)
【中图分类号】R 737.9doi: 10.3969/j.issn.1004-437X.2015.12.002
通讯作者:张连平,E-mail:zhanglp@163.com。

