左乙拉西坦对癫痫大鼠海马组织中μ-calpain及caspase-3表达的影响①
韩丽萍,王海燕,乔 霜,邹艳红,裴艳莹
(1.佳木斯大学附属第一医院, 黑龙江 佳木斯 154003;2.牡丹江医学院第二附属医院,黑龙江 牡丹江 157009)
左乙拉西坦对癫痫大鼠海马组织中μ-calpain及caspase-3表达的影响①
韩丽萍1, 2,王海燕1,乔霜2,邹艳红1,裴艳莹1
(1.佳木斯大学附属第一医院, 黑龙江 佳木斯 154003;2.牡丹江医学院第二附属医院,黑龙江 牡丹江 157009)
摘要:目的:通过观察LEV对癫痫大鼠认知情况及海马组织中μ-calpain和caspase-3表达的影响,来探讨LEV的抗癫痫作用及其机制。方法:取3周龄Wistar大鼠随机分为4组:NS组、LEV组、Li-pilo组和Li-pilo+LEV组。采用氯化锂-匹罗卡品诱导建立癫痫大鼠模型,建模成功24 h后,LEV组和Li-pilo+LEV组分别给予200 mg/(kgod) LEV。采用Morris水迷宫评价大鼠的学习与记忆的能力,免疫组织化学法检测各组大鼠海马组织中的μ-calpain及caspase-3的表达水平。结果:①与NS组相比,LEV组的逃避潜伏期和穿越平台次数无显著差异 (P>0.05);而与Li-pllo组相比,Li-pllo+LEV组的逃避潜伏期显著缩短,而穿越平台次数则显著增加(P<0.05),但未恢复到正常水平。②与NS组相比,LEV组的μ-calpain和caspase-3的蛋白表达无显著变化(P>0.05);而与Li-pllo组相比,Li-pllo+LEV组的μ-calpain和caspase-3的蛋白表达则显著减少(P<0.05),但未恢复到正常水平。结论:LEV 可以改善癫痫大鼠的学习和记忆的能力,该作用可能是通过调节海马组织中的μ-calpain及caspase-3的表达实现的。
关键词:左乙拉西坦;癫痫;μ-calpain;caspase-3
癫痫(epilepsy)是神经系统最常见的疾病之一,全球约有3500万患者,患病率为5%~7%,而我国也约有650万患者正在遭受该病的困扰。癫痫是一组以脑部功能失常为特征的综合征,具有突然的发作性,重复性,和短暂性为特点。可以说是儿童期最为常见的神经系统疾病之一。而癫痫持续状态(status epilepticus, SE)是癫痫的严重状态,是癫痫反复发作或持续状态,可以造成神经细胞的凋亡和坏死,并引起认知功能的损害。左乙拉西坦(Levetiracetam, LEV)作为国际上公认的一种抗癫痫药物(antiepileptic drugs, AEDs)的新品种,凭借其独特的抗癫痫机制,临床效果的高效和安全性及良好的药物动力学特点,目前已经在国内和欧美广泛应用于对癫痫的治疗。LEV具有抗癫痫和神经保护双重作用[1]。王海燕等[2]在研究中发现左乙拉西坦在治疗癫痫的同时,还会改善癫痫大鼠的认知功能。张岩等[3]在左乙拉西坦对癫痫大鼠认知功能的影响研究中也观察到,左乙拉西坦可改善癫痫大鼠的学习记忆能力。本研究主要采用免疫组织化学染色法检测LEV对癫痫大鼠海马组织中μ-钙蛋白酶(μ-calcium-activated non-lysosomal protease,μ-calpain)及半胱氨酸蛋白酶-3(caspase-3)蛋白表达的影响,并采用Morris水迷宫法检测大鼠空间记忆和学习能力,来探讨LEV抗癫痫作用的机制及其对认知的影响。
1 材料与方法
1. 1实验动物及模型制备
取三周龄健康Wistar大鼠(55±10g)124只(佳木斯大学动物实验中心提供),雌雄不限,随机的分为4组:正常对照组(NS)28只,左乙拉西坦对照组(LEV)28只,癫痫对照组(Li-pilo)34只,左乙拉西坦治疗组(Li-pilo+LEV)34只。
参考文献[4]制备癫痫大鼠模型:Li-pilo组和Li-pilo+LEV组的大鼠首日腹腔注射1.27%氯化锂127mg/kg,24h后再给予M胆碱受体阻滞剂丁溴东莨菪碱1mg/kg,30min后腹腔注射1% 匹罗卡品100mg/kg。观察大鼠行为变化的情况。根据Racine分级标准[5],将达到Ⅲ~Ⅴ级进入癫痫持续状态的大鼠归于致痫成功组;未达到Ⅲ~Ⅴ级的大鼠,继续注射匹罗卡品直至注射次数达到6次,若注射6次后仍未达到标准,则归于致痫不成功组,弃之不要。将造模成功大鼠继续分为Li-pilo组和Li-pilo+LEV组。NS组及LEV 对照组均在相同时间点给予等体积的生理盐水。
1.2方法
1.2.1给药方案
Li-pilo+LEV组和LEV组在成模24h后给予200mg/(kgod) LEV灌胃,Li-pilo组和NS组给予等体积的生理盐水灌胃,每日在相同时间点给予一次灌胃。
1.2.2留取标本及检测指标
(1)癫痫模型制备成功24h后,采用Morris水迷宫法每日测试各组大鼠的行为学指标:①定位航行实验:每天分为2个时间段,每个时间段训练大鼠4次,一共需要4d完成,观察并记录大鼠在60s内找到平台的时间(逃避潜伏期,escapelatency),反应大鼠空间学习和记忆能力;②空间搜索实验(spatial probe test):即在第5d将平台撤掉,观察和记录大鼠90s内穿越平台的次数,用于测量大鼠对空间位置的记忆能力。
(2)LEV给药后的第7、14、28天每组随机选取8只大鼠,给予10%水合氯醛麻醉之后,断头处死,分离出大鼠的海马组织,在 -70℃给予保存,免疫组化染色法检测大鼠海马组织中μ-calpain及caspase-3的表达情况。
1.2.3检测试剂
LEV购于美国Sigma公司;μ-calpain及caspase-3抗体及免疫组化试剂盒均购于武汉博士德生物工程有限公司。
1.3统计学方法
2 结果
2.1Morris水迷宫测试
与NS组相比,LEV组的逃避潜伏期和穿越平台次数无显著差异 (P>0.05);而与Li-pllo组相比,Li-pllo+LEV组的逃避潜伏期显著缩短,而穿越平台次数则显著增加(P<0.05),但未恢复到正常水平。见表1。
表1 各组Morris水迷宫实验数据比较

组别逃避潜伏期时间(秒) 第1d 第2d 第3d 第4d穿越目标次数(次)NS40.30±6.1332.54±5.4027.05±4.1620.66±3.215.31±0.84LEV39.89±5.5733.56±4.6229.55±4.0620.09±2.735.16±0.81Li-pllo50.76±5.52ab48.28±4.41ab46.21±4.33ab37.10±3.38ab2.68±0.35abLi-pllo+LEV45.64±5.96abc40.02±4.39abc37.25±4.27abc28.22±3.48abc4.28±0.41abcF值8.59518.91038.05149.96529.128P<0.05<0.05<0.05<0.05<0.05
注:a与NS组比较,P<0.05;b与LEV组比较,P<0.05;c与Li-pllo组比较,P<0.05。
2.2各组大鼠海马组织中μ-calpain的表达
与NS组相比,LEV组的μ-calpain的表达无显著变化 (P>0.05);而与Li-pllo组相比,Li-pllo+LEV组的μ-calpain的表达则显著下降(P<0.05),但未恢复到正常水平。见表2。
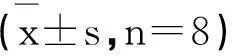
表2 各组大鼠海马组织中μ-calpain的表达(个/高倍视野)
注:a与NS组比较,P<0.05;b与LEV组比较,P<0.05;c与Li-pllo组比较,P<0.05。
2.3各组大鼠海马组织中caspase-3的表达
与NS组相比,LEV组的caspase-3的表达无显著变化 (P>0.05);而与Li-pllo组相比,Li-pllo+LEV组的caspase-3的表达则显著下降(P<0.05),但未恢复到正常水平。见表3。
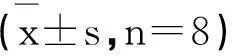
表3 各组大鼠海马组织中caspase-3的表达(个/高倍视野)
注:a与NS组比较,P<0.05;b与LEV组比较,P<0.05;c与Li-pllo组比较,P<0.05。
3 讨论
长期频繁的癫痫发作不仅可导致患者的智力及认知功能严重受损,更会对精神造成严重影响,最后逐渐丧失工作能力甚至生活能力,甚至危及生命。LEV自上市以来在治疗儿童癫痫方面已表现出耐受性好、与其他AEDs药物相互作用少以及对认知功能影响小等优势[6,7]。王树华等[8]在研究中发现,神经元出现变性、死亡和细胞结构瓦解现象。而μ-calpain和caspase-3都参与了癫痫大鼠海马神经元损伤过程。Calpain广泛存在于神经细胞内。而caspases在细胞凋亡的发生发展过程中处于中心地位。有资料显示,在由癫痫引起海马神经元丢失中,caspase-3发挥了重要的作用[9,10]。本研究结果反映了大鼠空间学习及记忆能力和μ-calpain及caspase-3的改变存在密切联系。与NS组相比,LEV 对照组的μ-calpain和caspase-3的表达量和 Morris 水迷宫测试结果全部无明显差异;Li-pilo组的μ-calpain和caspase-3的表达量明显升高,Morris 水迷宫测试也显示其空间学习及记忆能力较差;经 LEV 治疗后,Li-pilo+LEV组μ-calpain和caspase-3的表达量明显降低,逃避潜伏期短,空间搜索能力强。提示LEV 对癫痫大鼠空间学习及记忆能力无损害作用。LEV 可以改善癫痫大鼠的空间学习及记忆,记忆贮存及再现能力。它能使癫痫大鼠的逃避潜伏期缩短,而空间搜索能力增强。并且LEV的这种作用可能是通过减低癫痫大鼠海马组织中μ-calpain和caspase-3蛋白的表达实现的。这将为临床应用LEV治疗癫痫提供更有效的理论依据。
[1]Trojnar MK, Maek R, Chrocińska M, et al. Neuroprotective effects of antiepileptic drugs[J].Pol J Pharmacol,2002,54(6):557-566
[2]王海燕,王影,聂磊,等.左乙拉西坦对癫痫大鼠认知功能及海马组织中NPY和NCAM-mRNA表达的影响[J].黑龙江医药科学,2013,36(3):3-5
[3]张岩,王海燕,王影,等.左乙拉西坦对癫痫大鼠认知功能的影响研究 [J].黑龙江医药科学,2013,36(2):6-8
[4]陈子怡, 陈树达, 周珏倩, 等. 匹罗卡品诱发癫痫持续状态大鼠模型的改良和鉴定[J]. 解剖学研究, 2011,33(2):131-149
[5]Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972,32(3):281-294
[6]Briggs DE1, French JA. Levetiracetam safety profiles and tolerability in epilepsy patients[J]. Expert Opin Drug Saf,2004,3(5):415-424
[7]Grosso S, Franzoni E, Coppola G, et al. Efficacy and safety of levetiracetam: an add-on trial in children with refractoryepilepsy[J].Seizure, 2005,14(4):248-253
[8]王树华. 癫痫持续状态大鼠海马神经元程序性死亡与μ-calpain相关机制的实验研究[D]. 山东:山东大学,2008
[9]Henshall DC, Chen J, Simon RP. Involvement of caspase-3-like protease in the mechanism of cell death following focally evokedlimbic seizures[J].J Neurochem,2000,74(3):1215-1223
[10]Kondratyev A, Gale K. Intracerebral injection of caspase-3 inhibitor prevents neuronal apoptosis after kainic acid-evoked status epilepticus[J].Brain Res Mol Brain Res,2000,75(2):216-224
中图分类号:R742.1
文献标识码:A
文章编号:1008-0104(2015)06-0061-03
作者简介:①韩丽萍(1979~) 女,黑龙江牡丹江人,学士,主治医师。
通讯作者:邹艳红(1978~)女,黑龙江佳木斯人,硕士, 主治医师。E-mail:25582393@qq.com。
(收稿日期:2015-03-17)

