小鼠肝癌原位移植模型的建立及其意义的研究①
项亮亮,侯 杰,王 婕,焦成斌
(佳木斯大学附属第一医院普外二科,黑龙江 佳木斯 154003)
小鼠肝癌原位移植模型的建立及其意义的研究①
项亮亮,侯杰,王婕,焦成斌
(佳木斯大学附属第一医院普外二科,黑龙江 佳木斯 154003)
摘要:目的:探讨用肝癌H22细胞建立小鼠肝癌原位移植模型。方法:将肝癌H22细胞注入小鼠腹腔内,建立异位移植模型;抽取腹水中癌细胞接种于小鼠肝实质内,建立原位移植模型。结果:移植后10d可扪及肿瘤生长,模型成功率94.4%;晚期自发转移率79.4%,腹水产生率35.3%,无自发消退;移植瘤保持甲胎蛋白(AFP)、异常凝血酶原(DCP)高分泌及γ-氨基酰转氨酶(γ-GT)同工酶阳性的特点;模型平均自然生存期28d。结论:小鼠肝癌原位模型成功率高,易于制作,生物学特征符合模拟人类肝癌在体内发生发展的全过程,可成为今后人类研究肝癌的重要动物模型。
关键词:肝癌;H22细胞;原位移植模型;小鼠
肝癌是世界范围内常见的恶性肿瘤之一,因其发病率高、恶性程度高、死亡率高,素有“癌中之王”的称号[1]。目前已有大量研究为肝癌临床的治疗提供基础依据,而肝癌动物模型一直是肝癌临床与基础研究工作的重要工具。目前有关人肿瘤转移模型大多是用裸大鼠、裸小鼠,动物肿瘤则多数是用Wistar或SD大鼠建立的,而用小鼠建立原位肿瘤移植模型国内外报道较少。小鼠作为一种更经济,易饲养,易获得的实验研究载体,在发挥其普遍应用性方面有着重大的作用。小鼠肝癌原位移植模型作为一种新型的动物模型是否能更好地模拟人肝癌在体内发生、发展、侵袭及转移的过程,本实验将研究报道如下。
1 材料与方法
1.1实验动物及瘤株
SPF级昆明小鼠40只,雄性,鼠龄5周龄,体重约18~22g;腹水型肝癌H22细胞株,由佳木斯大学中心实验室代为冻存。
1.2实验仪器及材料
台式低温高速离心机、切片机、光学显微镜、游标卡尺、电子精密天平、无菌操作台、10%福尔马林固定液、水合氯醛、伊红、苏木素、琼脂糖等。
1.3模型制作
1.3.1异位模型制作:将冻存的肝癌H22细胞株复苏,体外培养至对数期后,以生理盐水调整细胞浓度至1×107个/mL,每只小鼠腹腔内注射0.5mL,共4只。注射7d后在无菌条件下抽出腹水,离心,去除杂质细胞,调整癌细胞浓度至1×107个/mL备用,进行原位移植[2]。
1.3.2原位模型制作:采取开腹手术直接注入肝脏法。昆明小鼠共36只。(1)取5周龄小鼠,抓取固定,腹部剃毛,75%医用酒精消毒,按小鼠体重的0.3%比例行水合氯醛腹腔注射麻醉,麻醉起效后,将小鼠四肢固定小手术台上,腹部再次消毒,取剑突下上腹部正中切口,长约1.2cm,剪开皮肤、腹白线及腹膜,压迫止血,轻轻挤压小鼠双侧腹壁,将小鼠肝左叶挤压出腹腔。(2)取无菌注射器将0.1mLH22肿瘤细胞注入左肝实质内,退出针头,轻压针眼,取烧红的铁丝轻灼针眼,防止肿瘤细胞逃逸,发生腹腔种植,将肝左叶轻轻送回腹腔。(3)查无活动性出血,取1号丝线缝合腹壁各层,消毒,小创口贴切口黏贴,结束造模。
1.4观察指标及方法
1.4.1模型观察:定期观察荷瘤小鼠生存、活动状况及腹部体征。扪查腹部了解移植瘤形成时间、质地及大小,以小鼠腹部可触及实体性包块为成瘤标志。留取10只荷瘤小鼠观察其带瘤的自然生存期。
1.4.2解剖学及病理学观察:当小鼠出现消瘦、精神萎靡等体征时处死小鼠。开腹肉眼观察肿瘤生长部位、质地、活动度、浸润、腹水及腹腔转移情况。游标卡尺测量瘤体的长(l)、宽(w)、高(h),体积(v)= π(l×w×h)/6计算[3,4]。10%福尔马林液固定瘤体,石蜡包埋,切片,经HE染色作常规病理检查。
1.4.3血清学检测:小鼠处死前,采用眼球摘除法取血,及时分离血清。ELISA法检测AFP[5]、DCP[6],γ-GTⅡ检测用聚丙烯酰胺凝胶梯度电泳法分离,凡出现Ⅰ、Ⅱ、Ⅲ带任一条即可判定结果阳性[7]。
1.5统计学方法
采用SPSS17.0统计软件包,计量资料采用均数加减标准差表示。
2 结果
2.1造模情况
模型成功率达94.4%(34/36)。移植5d左右小鼠皮肤伤口愈合。10d左右中上腹可扪及直径约0.4~0.6cm,位置固定、质地稍软的实体肿块。14d可扪及较明显的肿块,随后肿瘤生长速度增快,肿瘤大小略有差异。21d瘤径达2.0cm左右,可见腹部膨隆,部分小鼠出现消瘦、精神萎靡、行动迟缓等现象。模型平均自然生存期28d。
2.2大体解剖观察
移植瘤形态相对规则,成圆形或椭圆形,大部分暗红色,局部为白色,实质性,质较硬,与周围肝组织间完全或部分包膜包绕,表面有大小不等的结节,以浸润性生长为主,见图1。21d原位模型移植瘤平均体积(664.28±72.63)mm3,平均重量(1.54±0.23)g,晚期出现肝内、皮下及肠系膜腹腔淋巴结转移率79.4%(27/34),大量腹水占35.3%(12/34)。

图1 移植21d后肿瘤大小(构2.0cm)
2.3病理组织观察
HE染色光镜下观察癌细胞表面不规则,分化程度差,核大成圆形,深染,核质比大,游离核糖体增多等;肿瘤边缘浸润肝组织,转移淋巴结内可见大量癌细胞,排列紧密,见图2。
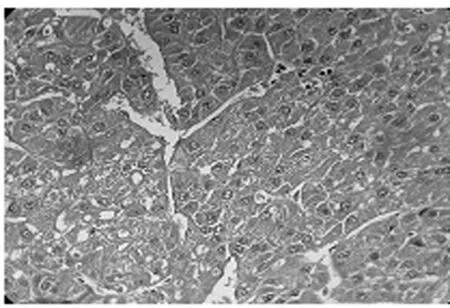
图2 肿瘤组织病理切片(HE×400)
2.4血清AFP、DCP及γ-GTⅡ检测
移植瘤保持了癌细胞分泌AFP、DCP,γ-GT的特点,且γ-GTⅡ检测均为阳性。
3 讨论
肝癌动物模型的建立包括诱发性、转基因及移植型,移植型又包括异位移植型及原位移植型。前两种动物模型由于自发性肝癌发病率低且模型稳定率差、病变的发生时间较难预测,且成本高、模型成功率低、癌细胞的形态学及免疫学特征常多样,所以具有一定的研究局限性[8]。异位移植模型虽能维持来源肿瘤的组织结构及生物特性,但很少发生转移,从而影响了在研究人类肿瘤转移特性方面的价值。原位移植是二十世纪八十年代逐渐发展起来的一种移植方式,与异位移植相比可以更好地再现临床肿瘤在人体内发生、发展及转移的全过程[9]。我们利用移植经腹水传代的H22肿瘤细胞成功的建立了小鼠肝癌原位移植模型,制模周期短、成本低,成功率高达94.4%,转移率为79.4%,且降低了早期腹水的发生率,晚期大量腹水占35.3%,未发现自发性消退,还保持了绝大多数的生物学特性,包括肿瘤的组织结构,AFP、DCP高分泌与γ-GTⅡ阳性的特点,基本模拟了人类肝癌的生长、浸润和转移的自然过程,适用于对肝癌的药物治疗及侵袭、转移机制方面的研究。本实验表明,小鼠肝癌原位移植模型可成为今后人类研究肝癌的重要动物模型。
本实验能够成功建立小鼠肝癌原位移植模型并发淋巴结转移的主要原因归结于以下几方面:(1)精确的麻醉技术和熟练的手术技巧是减少小鼠因过麻死或手术出血过多而死亡的关键,更是模型成功的重中之重;(2)严格无菌操作,防止因感染造成小鼠死亡影响实验结果;(3)利用自身的腹水提取癌细胞,其性质稳定,异质性小,直接接种于原位环境更有利于在体内生长;(4)接种鼠在性别选择上,尽量为雄性小鼠,以防激素依赖性影响实验结果;(5)在小鼠体重选择上,以18~22g为宜,体重过轻则因肝脏过小增加手术难度,反之增加肝脏的排斥反应影响移植瘤的生长;(6)癌细胞本身具有较强的恶性行为表达能力;(7)开腹直接接种肿瘤细胞,用烧红的铁丝轻灼针眼,减少术中出血,防止肿瘤细胞逃逸等造成腹腔种植及早期腹水的形成。
参考文献:
[1]王伟丽,高英堂.肝癌相关基因及相互作用的研究进展[J].世界华人消化杂志,2008,29:3289-3294
[2]侯杰,罗兰,刘伟新. H22昆明鼠肝癌原位模型的建立[J]. 黑龙江医药科学,2015,38(1):78-79
[3]Iwanuma Y ,Chen F, Egilmez N ,at al.Antitumor immune response of human periperal blood lymphocytes coengrafted with tumor into severe combined immmunodeficient mice[J]. Cancer Research,1997,57(14):2937-2942
[4]何志军,陈先祥,蔡庆和,等.移植瘤体积不同计测方法的比较[J].中国比较医学杂志,2009,09:47-50
[5]马丽艳.血清AFP、CEA和CA199联合对原发性肝癌的诊断价值[J].黑龙江医药科学,2011,34(1):80
[6]Yamamoto K, Imamura H, Matsuyama Y, et al. AFP, AFP-L3, DCP, and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathological variables of HCC[J]. Journal of Gastroenterology,2010 ,45(12):1272-1282
[7]Sawabu N.Clinical evaluation of specific γ-GT isoenjyme in patients with hepatocelluar carcinoma [J].Cancer,1983,51:327-332
[8]陈谦,孙慧,李强. 医学实验肝癌动物模型的研究进展[J].中华实验外科杂志,2006,03:377-378
[9]Furukawa T, Fu X ,Kubota T, et al.Nude mouse metastatic models of human stomach cancer constructed using orthotopic implantation of histologically intact tissue[J]. Cancer Research,1993,53(5):1204-1208
中图分类号:R735.7
文献标识码:B
文章编号:1008-0104(2015)06-0048-02
基金项目:①佳木斯大学研究生科技创新项目,编号:LM2014-018。
作者简介:项亮亮(1989~)男,安徽安庆人,在读硕士研究生。
通讯作者:焦成斌(1965~)男,黑龙江佳木斯人,硕士,主任医师,硕士研究生导师。E-mail:JiaoChengBin2009@sina.com。
(收稿日期:2015-06-06)

