臭氧水对口腔溃疡的实验研究①
尹燕超,苏 涛,赵 刚,于 静,王艳艳,王佳琦
(佳木斯大学,黑龙江 佳木斯 154007)
臭氧水对口腔溃疡的实验研究①
尹燕超,苏涛,赵刚,于静,王艳艳,王佳琦
(佳木斯大学,黑龙江 佳木斯 154007)
摘要:目的:探讨大鼠口腔溃疡模型在臭氧水溶液的影响下,颊黏膜上皮中β-防御素-2(BD-2)的表达及变化。方法:利用冰醋酸烧灼黏膜的方法建立大鼠的口腔溃疡模型,并设立空白组、自愈组及实验组,分别于第3天、第6天、第9天时,取各组大鼠的口腔溃疡处的黏膜组织,制备组织切片,并采用免疫组化的方法检测β-防御素-2在上皮中的表达,记录愈合时间。结果:BD-2在各组中均发生表达,臭氧水组BD-2的表达率高于自愈组,对照组BD-2的表达率最低;臭氧水组愈合时间短于自愈组。结论:臭氧水可以促进溃疡的愈合,缩短其愈合时间,增强BD-2的表达。
关键词:口腔溃疡;β-防御素-2;口腔黏膜;臭氧水溶液
复发性口腔溃疡(recurrent oral ulceration,ROU)目前发病机制尚不清楚,认为与免疫、遗传、环境等因素有关,口腔黏膜免疫系统可能起重要作用。口腔黏膜可以直接产生免疫效应分子对抗病原微生物,或通过信号转导方式引发黏膜获得性免疫反应, 直接或间接介导黏膜的保护。而β-防御素(bate-defensins,BDs)是上皮分泌的小分子抗微生物多肽,对口腔上皮系统形成天然免疫防御作用,对病原体特别是 G-菌和真菌,有直接杀伤作用,还和其他蛋白酶有协同作用,是口腔黏膜上皮化学屏障的重要组成部分。BD-2是β-防御素家族中具有代表性的多肽,而据文献记载其表达随炎症程度或外来刺激的变化而改变,但在口腔黏膜中的表达方式及其与外来因素的关系尚不明确,本研究传统冰醋酸烧灼的方法建立ROU模型,检测在臭氧说溶液的影响下BD-2的表达变化,从分子水平探讨其在口腔溃疡发展过程中的作用。
1 材料和方法
1.1实验动物、主要试剂与仪器
纯种雄性Wistar 大鼠(长春市亿斯实验动物技术有限责任公司)57只,体重为(280±10)g;臭氧水溶液、防御素β2抗体(上海江莱生物科技有限公司)、SP二抗试剂盒(上海鲁汶生物科技有限公司)、DAB显色试剂盒(北京中杉金桥有限公司)、多聚防脱载玻片、多聚赖氨酸、PBS磷酸盐缓冲液、枸缘酸缓冲液、水合氯醛、冰醋酸、 甲醛溶液 ;光学显微镜和多功能照相显微镜(奥林巴斯,日本)、超薄石蜡切片机、电热恒温水箱(上海医疗器械七厂)。
1.2实验方法
Wistar 大鼠57只,利用SPSS软件随机分为3组:正常对照组15只;自愈组20只;臭氧水组20只,另有2只用于口腔溃疡模型鉴定(提供溃疡组织标本和正常组织)。动物分笼饲养,自由摄食饮水。适应性喂养一周后,用100mL/L水合氯醛(350mg/kg)腹腔麻醉,正常对照组不作处理,自愈组和臭氧水组用蘸有体积分数为40%冰醋酸的(直径5mm,厚1mm,圆形)滤纸片贴在大鼠两侧口角偏下唇处,放置60s,生理盐水冲洗1min。24h后观察口角黏膜约形成5mm 直径的溃疡,表面覆盖黄白色假膜,其边缘充血水肿。臭氧水组每日局部擦拭给药,早中晚各一次,每次用量2mL(棉签蘸取10次左右),空白组及自愈组每日给等容量生理盐水。各实验组分别于给药的第3天,第6天,第9天随机抽取5只大鼠观察溃疡愈合情况并处死迅速切取6mm×6mm×5mm溃疡的口腔黏膜组织,置于4%多聚甲醛溶液中固定,行HE染色组织病理学检查和免疫组织化学分析,其它大鼠记录愈合日期。
1.3统计学方法
采用 SPSS13.0 统计软件进行分析,以均数±标准差表示。计量资料用单因素方差分析进行组间比较,检验水准为α=0.05,P<0.05表示有统计学差异。
2 结果
2.1口腔溃疡动物模型的建立鉴定
肉眼观察:24h 后冰醋酸处理的大鼠相应黏膜处形成直径5mm的圆形缺损,表面覆盖黄白色假膜,略凹陷,边缘较整齐,周边红肿充血。(图1-A) 组织形态学观察 :(1)正常黏膜组织:上皮完整连续,角化层、颗粒层、棘层、基底层细胞排列有序,胞浆胞核清晰未见异型性表现,上皮下固少有层炎性细胞,上皮钉突短并且整齐(图1-B);(2)溃疡黏膜组织:上皮层连续性被破坏,破溃溶解脱落,表面有坏死组织覆盖,黏膜下方有大量的炎细胞浸润,多数为中性粒细胞和淋巴细胞(图1-C)。
2.2HE镜下观察
第3天时,自愈组:黏膜上皮完整性破坏,形成溃疡,表层覆有由坏死的上皮细胞、纤维性渗出物和炎性细胞构成的假膜,上皮层及黏膜下层可见大量炎细胞浸润,主要为中性粒细胞和淋巴细胞(图2-A);臭氧水组:黏膜尚且完整,黏膜下充血水肿,可见密集的炎症细胞浸润,其程度轻于自愈组(图2-B)。
第6天时,自愈组组:黏膜已经形成典型溃疡,表面覆有大量坏死细胞、炎性细胞及纤维性渗出物,周围组织有少量成纤维细胞, 充血不明显(图2-D);臭氧水组:病灶下方及周围可见较多的成纤维细胞长入,上皮出现修复反应,但其下方仍有炎症细胞浸润,溃疡缺损表面未见纤维性渗出物(图2-E)。
第9天时,自愈组:黏膜溃疡面未愈合,表面可见炎症细胞浸润,纤维性渗出物,周围见有成纤维细胞长入(图2-G);臭氧水组:上皮愈合,但层次紊乱,厚度不一(图2-H)。 对照组各时间点均可见上皮连续,层次清晰,未见炎症细胞浸润(图2-C,F,I)。
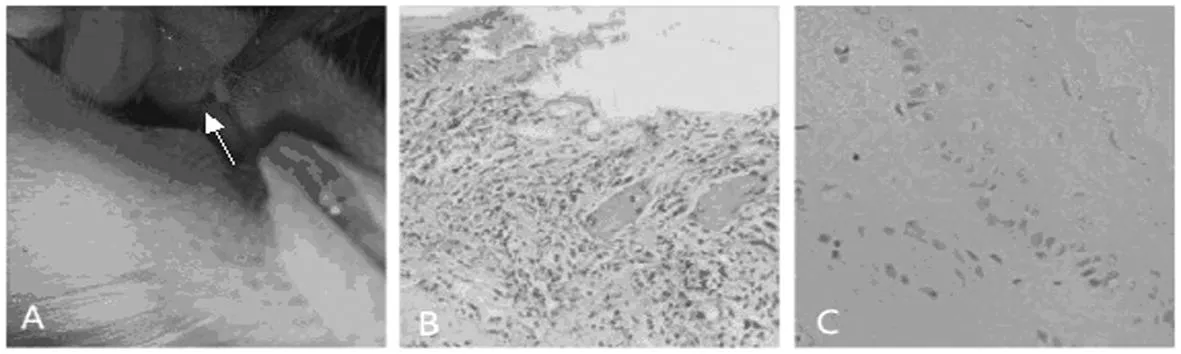
图1 大鼠口腔溃疡模型鉴定肉眼观察及组织学鉴定

图2 大鼠口腔溃疡愈合不同时间颊黏膜上皮HE染色(×100)
( A.第3天自愈组,B.第3天臭氧水组,C.第3天对照组,D.第6天自愈组,E.第6天臭氧水组,F第6天对照组,G.第9天自愈组,H.第9天臭氧水组,I第9天对照组)
2.3BD-2免疫组化染色
BD-2在口腔黏膜中的表达情况:BD-2阳性染色呈黄色或棕黄色,位于细胞胞浆和胞膜,胞核无染色,强染色区域呈片状或带状散在分布,在棘层细胞染色最强,主要表达于口腔黏膜上皮棘层和颗粒层,基底层细胞未见明显染色。
第3、6、10天时,BD-2阳性表达率臭氧水组高于对照组(P<0.01),自愈组高于对照组(P<0.01),臭氧水组高于自愈组(P<0.05);在各时间点,对照组BD-2成极其微弱的表达,阳性表达率无明显变化(P>0.05),自愈组同臭氧水组阳性表达率逐渐增加后趋于稳定。
2.4自愈组和臭氧水组大鼠口腔溃疡愈合时间比较
臭氧水组平均愈合时间为(9.0±0.7)d,短于自愈组平均愈合时间(10.4±1.14)d,组间差异具有统计学意义(P<0.05),可以认臭氧水先于自愈组愈合。

图3 大鼠口腔溃疡愈合不同时间颊黏膜上皮BD-2免疫组化染色(×400)
3 讨论
以往研究多采用体外上皮细胞培养,该方法不能模拟口腔溃疡时口腔环境的复杂变化。对口腔溃疡发展过程中BD-2在组织的表达至今尚不清楚,动物模型取材不受部位或时间点的限制,且大鼠口腔溃疡模型建立方法成熟。本实验通过40%冰醋酸建立大鼠口腔溃疡模型[1],可诱发口腔黏膜炎症和充血,导致口腔溃疡的发生,成功建立口腔溃疡的动物模型。BD是口腔黏膜中化学屏障的抗菌肽,由上皮组织分泌可以直接杀伤病原体,或者通过化学途径同溶菌酶等的协同作用杀菌。有学利用原位杂交技术检测,发现在口腔,呼吸道,胃肠道,包皮等上皮组织中 BD-2呈少量表达,而当这些部位受到炎性刺激时,BD-2 则会大量表达,认为BD-2是诱导型防御素[2,3]。本研究结果显示: BD-2在正常组、自愈组和臭氧水炎组的口腔龈上皮组织中均有表达,在自愈组和臭氧水组呈高表达,这与其他学者研究结果(诱导性表达)一致。在对照组中呈微弱表达Fn为常见的口腔共生菌,在正常状态下口腔内也可大量存在,细胞实验也证明:培养的上皮细胞中加入一定量的Fn细胞壁提取物,能够上调BD-2的表达,因此,在存在大量口腔共生菌时,健康组织也可有BD-2的表达。本研究结果提示BD-2在牙龈口腔上皮中的表达具有组成性和诱导性表达两种方式[4,5]。
在同一时间点,正常组BD-2有较弱表达,提示BD-2在正常口腔黏膜中有一定的天然防御作用;在自愈组BD-2表达强度中等,说明在上皮病损时分泌炎性因子可以激发其表达;臭氧水组表达强度最强,愈合最快,表示臭氧水本身可能作为一种外界干扰,调控BD-2的表达,使上皮的防御能力增强,同时,加快了溃疡的愈合。
机体溃疡面愈合是一个精准的调控过程,在该过程中有极多免疫细胞和免疫因子参与,参与机体整体和局部的细胞再生、组织重建过程[6]。内源性因子BD-2 ,在溃疡面愈合过程中起到非常重要的作用,实验证明臭氧水对BD-2因子的影响有利于溃疡面的抗炎以及再生修复。
臭氧水有强氧化性,可以短时间内杀灭和抑制口腔内原有以及外来菌群,降低局部感染率和局部坏死的发生。此外,臭氧水可增强局部氧供,使口腔环境保持平衡,促进口腔黏膜上皮修复[10~11]。口腔黏膜内有密集的神经末梢,发生溃疡时,末梢会释放P物质及磷脂酶A等致痛物质从而产生疼痛感觉,臭氧水可直接作用在神经末梢,刺激抑制性中间神经元释放脑啡肽等物质,起到镇痛作用[7~9]。
本试验表明5%臭氧水可以有效减轻口腔溃疡,缩短口腔溃疡持续时间。目前有关臭氧水漱口治疗口腔溃疡的研究很少,本研究结果还有待更多的临床试验进一步证实。①BD-2在正常口腔黏膜中有一定的天然防御作用,炎性因子可以激发其表达,臭氧水本身可能作为一种外界干扰,调控BD-2的表达。②臭氧水可以促进溃疡的愈合,缩短其愈合时间。③在臭氧水的干扰下,BD-2的表达成都增强,且在上皮愈合后仍有一定的表达。
参考文献:
[1]彭玉梅.口腔溃疡动物实验模型的建立[J].北京口腔医学,2008,16(2):85-86
[2]Abiko Y,Mitmura J,Nishimura M,et al.Pattern of expression of beta-defensins in oral squamous cell carcionima [J].Cancer Lett,1999,143(1):37-43
[3]Bissll J,Joly S,Johnson GK, et al.Pattern of expression of beta-defensins ingingival health and in Periodontal disease [J].J Oral Pathol Med,2004,33(5):278-285
[4]Krisanaprakonkit S,Kimball JR,Weinberg A,et al.Inducible expression of human beta-defensin 2 by Fusobacterium nucleatum in oral epithelial cell:multiple singnaling pathways and role commensal bacteria in innate immunity and the epithelial barrier[J].Infect Immun,2000,68(5):2907-2915
[5]李雅灵.龈沟液HBD-2及IL-1β水平与慢性牙周炎关系初步研究[D].优秀硕士学位论文全文数据库,2007
[6]余斌,黄华军,林庆荣,等. 臭氧水对感染性创面内源性细胞因子含量的影响[J].实用医学杂志,2010,26(10):1719-1722
[7]易晓彤.臭氧水对感染性创面抗炎修复的作用[J].亚太传统医药,2012,8(4):331-350
[8]张维,傅志俭,王梅英,等.医用臭氧与疼痛临床 [J].国际麻醉学与复苏杂志,2007,28(4):331-334
[9]Wainstein J,Feldbrin Z,Boaz M,et al.efficacy of ozone-oxygen therapy for the treatment of diabetic foot ulcers[J].Diabetes Technol Ther,2011,13(12):1255-1260
[10]姜威,颜玉,郑强,等. 溃疡性结肠炎Toll样受体表达和NF-κB变化及益生菌的作用研究[J]. 黑龙江医药科学, 2013,36(5):34-35
[11]李维善,朱建华,姜景红.防御素HBD-2在口腔白斑病损中表达的研究[J].黑龙江医药科学, 2013,36(1):24-25
中图分类号:R781.5
文献标识码:B
文章编号:1008-0104(2015)06-0134-03
作者简介:①尹燕超(1988~)女,黑龙江佳木斯人,在读硕士研究生。
通讯作者:赵刚(1975~)男,黑龙江佳木斯人,硕士,副教授,硕士研究生导师。E-mail:yyc612448@163.com。
(收稿日期:2014-11-12)

