10株益生菌益生特性的比较研究
吕嘉枥, 闫亚梅, 王霄鹏, 李文娟, 杜 冰
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
10株益生菌益生特性的比较研究
吕嘉枥, 闫亚梅, 王霄鹏, 李文娟, 杜冰
(陕西科技大学 食品与生物工程学院, 陕西 西安710021)
摘要:选用10株益生菌对其耐胆盐、降胆固醇和降甘油三酯的益生特性进行了比较研究,并选用蔬菜培养基测定发酵过程中10株益生菌的活菌数变化,筛选出增菌效果明显的7株益生菌,研究发酵过程中的总酸、SOD酶和亚硝酸盐含量变化.结果表明:在胆盐浓度为0.3%时,LC、LP和LGG的存活率均大于30%,LB、LC、LGG、LP、LCP和EF对胆固醇的降解能力依次为45.63%、48.13%、30.63%、23.16%、20.63%、16.88%,LB、LC、LR、Bb-12和EF对甘油三酯的降解能力依次为23.06%、16.72%、44.60%、31.08%、22.90%;ST、Bb-12和EF的活菌数在107cfu/mL以下,其余7株的活菌数都达到108cfu/mL;分别接入7株益生菌发酵24 h时酸度在0.4%~0.8%之间,LCP和LA在发酵过程中产生SOD酶,活力达到189.09 U/mL,添加LB、LP、LC、LA和LGG亚硝峰消失,发酵48 h后亚硝酸盐的含量低于0.2 mg/kg.
关键词:益生菌; 益生特性; 蔬菜; SOD酶
0引言
益生菌是指当摄入一定数量后,能以活菌状态到达胃肠道的单一或特定微生物的混合物,它作为促进机体健康的有益菌[1-3],具有促进营养物质的消化吸收、降低胆固醇、抑制癌细胞生长等功能[4-6].
目前国内外学者对益生菌益生特性的研究显得非常活跃.陈路清、李青青等[7]测定了实验室保藏9株食品级双歧杆菌体外降胆固醇的能力以及耐酸、耐胆盐和细胞粘附的益生特性[8];郭志华、杨洪[9]选取从藏灵菇中分离的2株乳酸菌研究了其耐热、耐胆盐等益生特性.
林晓姿、梁璋成等[10]以自选植物乳杆菌R23和干酪乳杆菌R35为目标菌,以德氏乳杆菌保加利亚亚种6045为对照菌,考察各菌对模拟胃液酸度和肠道胆盐的抗逆性以及凝集能力、表面疏水性等黏附性能,评价其发酵液对超氧阴离子和羟基自由基的清除能力等体外抗氧化功能.然而,关于益生菌降解甘油三酯的能力以及产SOD酶的能力的研究比较少,同时益生菌的益生特性研究不是很全面.
本论文选用10株益生菌对其耐胆盐、降胆固醇和降甘油三酯的益生特性进行了比较研究,并选用蔬菜培养基研究了发酵过程中10株益生菌的活菌数变化,筛选出增菌效果明显的7株益生菌,研究了它们在发酵过程中蔬菜培养基的总酸、SOD酶和亚硝酸盐含量变化.为益生菌益生特性的研究以及功能性食品的开发提供理论依据.
1材料与方法
1.1 原材料与试剂
1.1.1原材料
黄瓜,胡萝卜,山药,白萝卜,莲花白,小白菜,小青菜,油麦菜,芹菜,湖北庄农贸市场提供.
1.1.2菌种
保加利亚乳杆菌(Lactobacillusbulgaricus简称LB),嗜酸乳杆菌(Lactobacillusacidophilus简称LA),植物乳杆菌(LactobacillusPlantarum简称LP),乳双歧杆菌(Bifidobacteriumanimalissubsp.lactisBb-12简称Bb-12),鼠李糖乳杆菌(Lactobacillusrhamnosus简称LGG),副干酪乳杆菌(Lactobacillusparacasei简称LCP),粪链球菌(Enterococcusfaecalis简称EF),嗜热链球菌(Streptococcusthermophilus简称ST),干酪乳杆菌(Lactobacilluscasei简称LC),罗伊氏乳杆菌(Lactobacillusreuteri简称LR),由陕西科技大学食品与生物工程学院微生物研究室提供.
1.1.3试剂
N-1-萘乙二胺盐酸盐(分析纯) 天津市科密欧化学试剂有限公司;亚硝酸钠(分析纯) 天津市红岩化学试剂厂;冰醋酸(分析纯) 西安三浦精细化工厂;胆固醇(分析纯),蔗糖酯(分析纯),胆固醇试剂盒和甘油三酯试剂盒 长春汇力生物技术有限公司;猪胆盐 北京奥博星生物技术有限公司;超氧化物歧化酶(SOD酶)试剂盒 南京建成科技有限公司.
1.2 仪器与设备
B203LEDR型生物显微镜:重庆奥特光学仪器有限公司;AC-0629型普通光学显微镜:重庆光学仪器有限公司;DS-1型高速组织捣碎机:上海标本模型厂; DHP9080型电热恒温培养箱:上海佳胜实验设备有限公司;LS-C50L型立式压力蒸汽灭菌锅:江阴滨江医疗设备厂;UV-2600型紫外可见分光光度计:尤尼柯仪器有限公司;冷冻离心机:安徽中科中佳科学仪器有限公司;上海仪电科学仪器股份有限公司.
1.3 培养基
(1)MRS培养基:蛋白胨10 g,牛肉膏5 g,柠檬酸二胺2 g,牛肉膏10 g,葡萄糖20 g,Tween-80 1 mL,乙酸钠5 g,磷酸氢二钾2 g,硫酸镁0.58 g,硫酸锰0.25 g,蒸馏水1 000 mL,pH值6.0,在121 ℃灭菌20 min.
(2)胆固醇(TC)培养基:准确称量0.1 g胆固醇于小烧杯,加入1 mL Tween-80,0.1 g蔗糖酯,搅拌均匀后加入5.0 mL冰乙酸,边加热边搅拌至充分溶解,超声处理15 min后再加入MRS培养基中,边加边搅拌,使胆固醇浓度为0.1 mg/mL,然后加入0.2%巯基乙酸钠,调pH值为6.0,121 ℃灭菌15 min.
(3)甘油三酯(TG)培养基:将Tween-80与猪油按1∶5比例混合,边加热边搅拌至充分溶解,保温5 min后乳化,得到甘油三酯胶束.按6%的比例将甘油三酯胶束加入MRS培养基中,边加边搅拌,然后加入0.2%巯基乙酸钠,调pH值为6.0,121 ℃灭菌15 min.
(4)蔬菜培养基:小白菜30 g,小青菜30 g,油麦菜30 g,清洗、切段后,使蔬菜和水的比例为1∶1,用高速组织捣碎机打浆,过40目筛,添加10 g玉米淀粉,105 ℃条件下灭菌15 min,冷却后备用.
1.4 实验方法
1.4.110株益生菌对胆盐的耐受能力[11]
将不同浓度的猪胆盐加入到MRS培养基中,按1%的量接种后在最适温度下培养48 h,以未加入胆盐的培养基作为对照,用分光光度计在600 nm处测量OD值.
1.4.210株益生菌对胆固醇的降解能力[12]
将10株益生菌接种到胆固醇培养基后在最适温度下培养48 h,每隔6个小时测定TC降解量,以不含TC为对照,将培养基5 000 r/min离心10 min,用胆固醇试剂盒测定TC的量.
1.4.310株益生菌对甘油三酯的降解能力[13]
将10株益生菌接种到甘油三酯培养基后在最适温度下培养48 h,每隔6个小时测定TG降解量,以不含TG为对照,将培养基5 000 r/min离心10 min,用甘油三酯试剂盒测定TG的量.
1.4.410株益生菌发酵过程中的活菌数变化[14]
将10株益生菌(保加利亚乳杆菌、嗜酸乳杆菌、植物乳杆菌、乳双歧杆菌、鼠李糖乳杆菌、副干酪乳杆菌、粪链球菌、嗜热链球菌、干酪乳杆菌、罗伊氏乳杆菌)分别接种在蔬菜培养基中,测定发酵过程中的活菌数变化,优选出生长较好的益生菌.
1.4.57株益生菌发酵过程中总酸变化
将7株生长较好的益生菌(保加利亚乳杆菌、嗜酸乳杆菌、植物乳杆菌、鼠李糖乳杆菌、副干酪乳杆菌、干酪乳杆菌、罗伊氏乳杆菌)分别接种在蔬菜培养基中,在0 h、8 h、16 h、24 h、32 h、40 h、48 h发酵过程中测定总酸变化.
1.4.67株益生菌发酵过程中SOD酶的活性变化[15]
将7株生长较好的益生菌(保加利亚乳杆菌、嗜酸乳杆菌、植物乳杆菌、鼠李糖乳杆菌、副干酪乳杆菌、干酪乳杆菌、罗伊氏乳杆菌)分别接种在蔬菜培养基中,在0 h、8 h、16 h、24 h、32 h、40 h、48 h发酵过程中测定SOD酶的活性变化.
1.4.77株益生菌发酵过程中亚硝酸盐含量变化
将7株生长较好的益生菌(保加利亚乳杆菌、嗜酸乳杆菌、植物乳杆菌、鼠李糖乳杆菌、副干酪乳杆菌、干酪乳杆菌、罗伊氏乳杆菌)分别接种在蔬菜培养基中,在0 h、8 h、16 h、24 h、32 h、40 h、48 h发酵过程中测定亚硝酸盐含量变化.
1.5 测定方法
(1)胆固醇含量测定方法:胆固醇试剂盒.
(2)甘油三酯含量测定方法:甘油三酯试剂盒.
(3)活菌数测定方法:高层琼脂柱计数.
(4)总酸测定方法:酸碱滴定法.
(5)SOD酶活力的测定方法:试剂盒(羟胺法).
(6)亚硝酸盐含量测定方法[16,17]:盐酸萘乙二胺法GB/T 5009.33-2010.
2结果与讨论
2.1 10株益生菌对胆盐的耐受能力
胆汁盐具有抗菌性,乳杆菌被食入后菌体要能够抵抗胆汁盐,菌种对胆盐的耐受性是衡量益生菌的重要指标[18].对10株益生菌进行了胆盐耐受性测试,由图1可知,当胆盐浓度为0.1%时,LB、LC、LP、LCP和LGG的菌种存活率范围在37%~88%之间,在胆盐浓度为0.3%时,LC、LP和LGG的菌种存活率均大于30%;随着胆盐浓度的增加,菌的存活率逐渐下降,胆盐浓度为0.4%时,LC、LP和LGG的菌种存活率在30%左右,其它7种菌的存活率低于5%.

图1 10株益生菌对胆盐的耐受能力
2.2 10株益生菌对胆固醇的降解能力
对10株益生菌进行体外胆固醇降解实验.由图2可知,随着时间的增加,菌株对胆固醇的降解量逐渐增加.LB、LC、LGG、LP、LCP和EF 5种益生菌降解胆固醇效果较好,分别为45.63%、48.13%、30.63%、20.80%、20.63%,16.88%;其中,LC对胆固醇的降解能力显著高于其他菌株,达到45.60μg/mL,LA、LR和Bb-12对胆固醇的降解能力在5%左右,降解能力比较差.
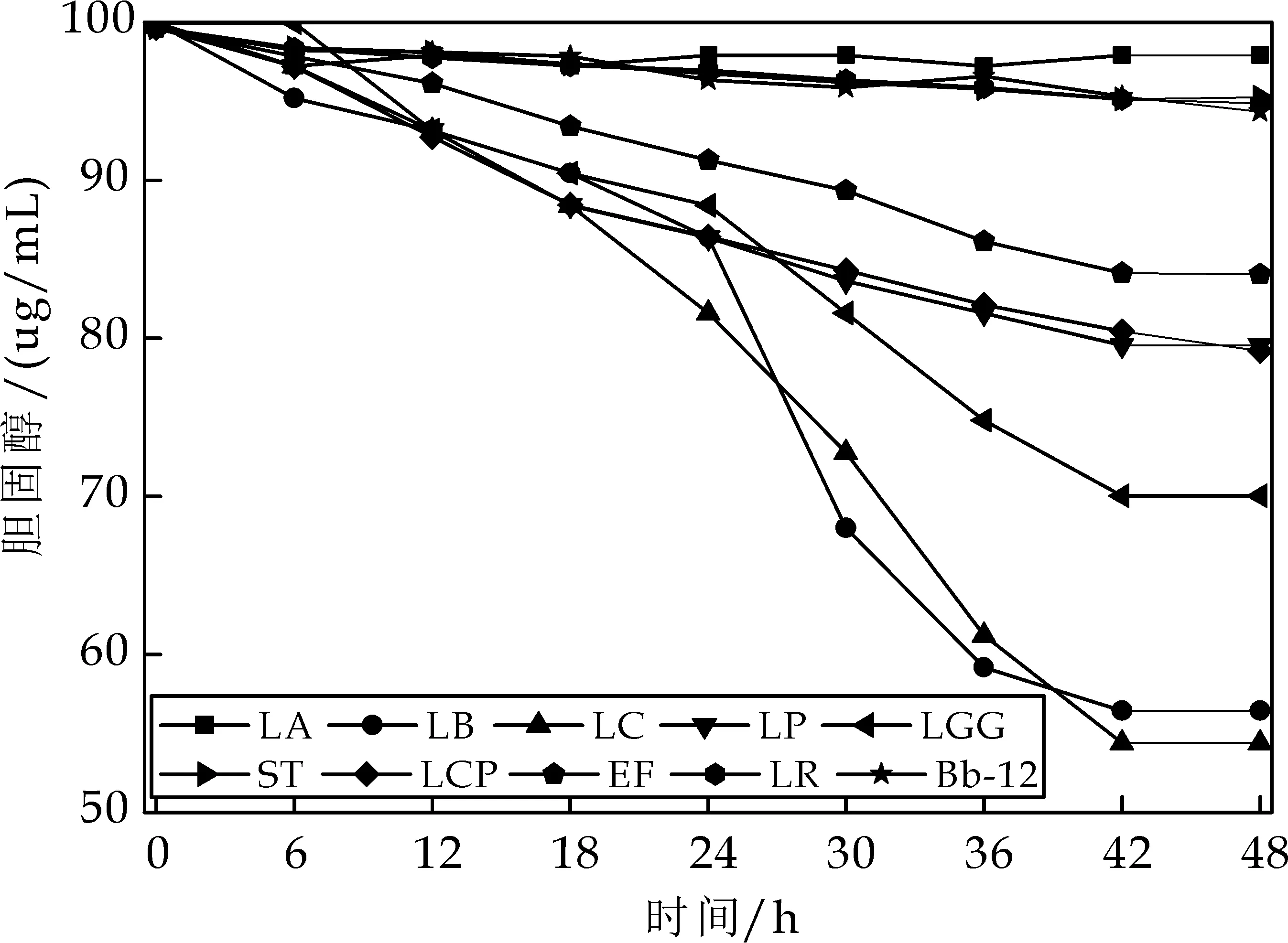
图2 10株益生菌对胆固醇的降解能力
2.3 10株益生菌对甘油三酯的降解能力
对10株益生菌进行体外甘油三酯的降解实验.由图3可知,随着时间的增加,菌株对甘油三酯的降解量逐渐增加,LB、LC、Bb-12、LR和EF降解甘油三酯效果较好,分别为23.06%、16.72%、31.08%、 44.6%、22.9%,其中,LR对甘油三酯的降解能力显著高于其他菌株,达到1.66 mg/mL,LA、LP、LGG、ST和LCP降解甘油三酯的能力比较差,降解能力在5%~10%之间.
2.4 10株益生菌发酵过程中的活菌数变化
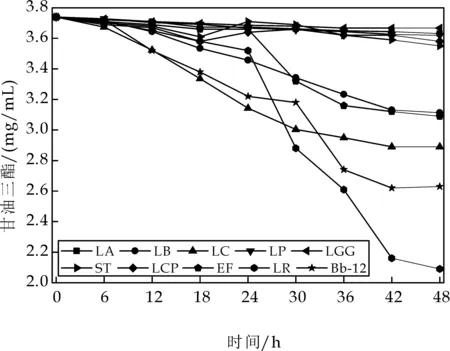
图3 10株益生菌对甘油三酯的降解能力
由图4可知,10种益生菌在蔬菜培养基中均能生长,嗜酸乳杆菌、植物乳杆菌和罗伊氏乳杆菌在稳定期生长最好,活菌数达到109cfu/mL,嗜酸乳杆菌在24 h达到稳定期,植物乳杆菌和罗伊氏乳杆菌在48 h达到稳定期,保加利亚乳杆菌、干酪乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌在稳定期时生长情况较好,活菌数均在5×108~9.9×108cfu/mL,4种菌均在48 h达到稳定期;嗜热链球菌和粪链球菌生长情况较差,活菌数为107cfu/mL,乳双歧杆菌在稳定期时生长情况最差,活菌数在1×106~9×106cfu/mL之间,选取保加利亚乳杆菌、植物乳杆菌、干酪乳杆菌、副干酪乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌和罗伊氏乳杆菌进行下一步实验.
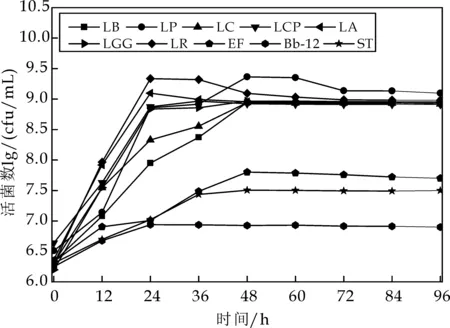
图4 10株益生菌发酵过程中的活菌数变化
2.5 7株益生菌基发酵过程中总酸变化
由图5可知,以不添加益生菌作为空白,分别向蔬菜培养基中添加7株益生菌,测定发酵过程中的总酸变化.发酵过程中接菌比不接菌的总酸含量要高,发酵48 h时空白组蔬菜培养基的总酸含量为0.1%,添加嗜酸乳杆菌的总酸含量达到0.92%,添加干酪乳杆菌的蔬菜培养基总酸含量达到0.78%,添加其它几株菌的蔬菜培养基总酸含量在0.4%~0.6%之间.

图5 7株益生菌发酵过程中的总酸变化
2.6 7株益生菌发酵过程中SOD酶的活性变化
由图6可知,以不添加益生菌作为空白,分别向蔬菜培养基中添加7株益生菌,测定发酵过程中的SOD酶变化.发酵0 h时SOD酶的活力为127.87 U/mL,发酵24 h时SOD酶的活力达到153.27 U/mL,在继续发酵过程中SOD酶的活力开始下降,发酵48 h时为128.29U/mL,而添加副干酪乳杆菌和嗜酸乳杆菌的蔬菜培养基中SOD酶的活力最终达到189.09 U/mL,而且这2种菌在发酵过程中会产生较多的SOD酶,罗伊氏乳杆菌发酵过程中几乎不产SOD酶,添加其它几株益生菌的蔬菜培养基中SOD酶的变化与空白组相比差别不大.
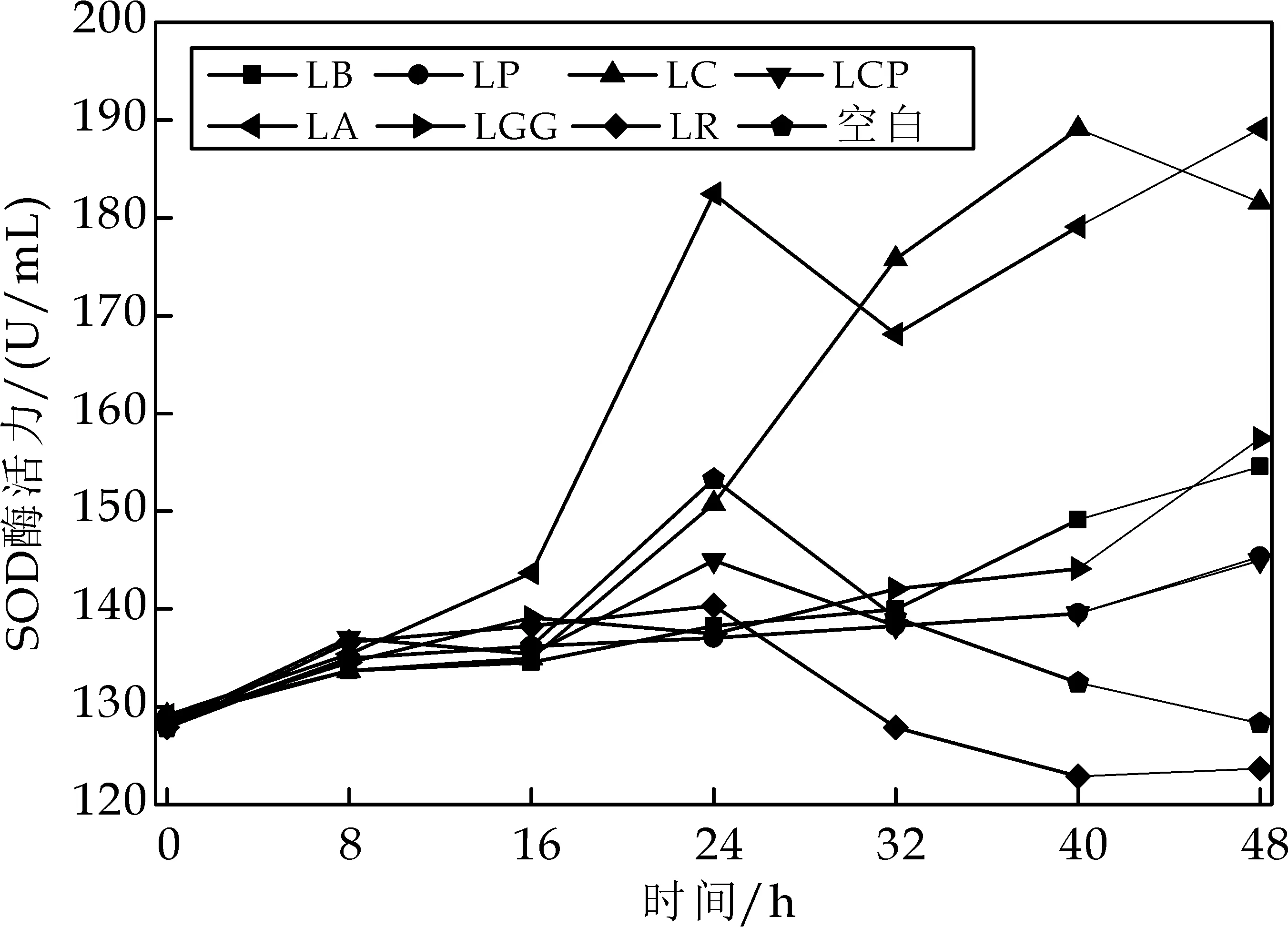
图6 7株益生菌发酵过程中的SOD酶变化
2.7 7株益生菌发酵过程中亚硫酸盐含量变化
由图7可知,以不添加益生菌作为空白,分别向蔬菜培养基中添加7株益生菌,测定发酵过程中的亚硝酸盐含量变化.不接菌时发酵40 h出现亚硝酸峰,亚硝酸盐含量达到19.40 mg/kg,接入不同益生菌亚硝峰提前至16~24 h之间,罗伊氏乳杆菌降解亚硝酸的能力相对较差,亚硝峰为11.24 mg/kg,保加利亚乳杆菌、植物乳杆菌、干酪乳杆菌、嗜酸乳杆菌和鼠李糖乳杆菌降解亚硝酸盐的能力较强,亚硝峰消失,整个发酵过程中亚硝酸盐含量低于10 mg/kg,随着发酵时间的延长,亚硝酸盐的含量逐渐降低,最终低于0.2 mg/kg.

图7 7株益生菌发酵过程中的亚硝酸盐含量变化
3结论
本论文选用10株益生菌对其耐胆盐、降胆固醇和降甘油三酯的益生特性进行了比较研究,然后选用蔬菜培养基研究了发酵过程中10株益生菌的活菌数变化,筛选出增菌效果明显的7株益生菌,研究了它们在发酵过程中蔬菜培养基的总酸、SOD酶和亚硝酸盐含量变化.结果表明:10株益生菌都具有一定的益生功能,在胆盐浓度为0.3%时,LC、LP和LGG的菌种存活率均大于30%;LC对胆固醇的降解能力显著高于其他菌株,达到45.60μg/mL;LR对甘油三酯的降解能力显著高于其他菌株,达到1.66 mg/mL;LB、LP、LC、LCP、LA、LGG和LR的活菌数都达到108cfu/mL;接入不同益生菌发酵24 h时酸度在0.4%~0.8%之间,LCP和LA在发酵过程中产生SOD酶,活力最终达到189.09 U/mL,添加LB、LP、LC、LA和LGG亚硝峰消失,发酵48 h后,亚硝酸盐的含量低于0.2 mg/kg,本实验为益生菌益生特性的机理研究奠定了一定的理论基础.
参考文献
[1] 谢明勇,熊涛,关倩倩.益生菌发酵果蔬关键技术研究进展[J].中国食品学报,2014,14(10):1-9.
[2] Eric Banan Mwine Daliri,Byong H.Lee.New perspectives on probiotics in health and disease[J].Food Science and Human Wellness,2015,449(2):56-65.
[3] 王笋,吕嘉枥,辛博,等.西北地区泡菜中乳酸杆菌的生物学特性[J].中国调味品,2014,39(3):15-18.
[4] Xin Wang,Qinglong Wu,Kan Deng,et al.A novel method for screening of potential probiotics for high adhesion capability[J].Journal of Dairy Science,2015,98(7):4 310-4 317.
[5] Charles M.A.P.Franza,Melanie Hucha,Julius Maina Mathara,et al.African fermented foods and probiotics[J].International Journal of Food Microbiology,2014,190(3):84-96.
[6] Y.K.Lee.Effects of diet on gut microbiota profile and the implications forhealth and disease[J].Biosci. Microbiota Food Health,2013,32(1):1-12.
[7] 陈路清,李青青,马鎏镠,等.体外筛选降胆固醇双歧杆菌实验[J].食品工业科技,2010,31(7):333-335,338.
[8] H.S.Lye,G.R.Rahmat Ali,M.T.Liong.Mechanisms of cholesterolremoval by lactobacilli under conditions that mimic the human gastroin-testinal tract[J].International Dairy Journal,2010,20(3):169-175.
[9] 郭志华,杨洪.分离自藏灵菇的乳酸菌的益生特性[J].食品与发酵工业,2013,39(1):151-154.
[10] 林晓姿,梁璋成,何志刚,等.两株自选乳酸菌的益生特性[J].北京工商大学学报(自然科学版),2012,30(1):30-35.
[11] 王锦祥,章刚,黄克和.四株益生菌耐脂及降脂性能的体外研究[J].食品工业科技,2009,30(10):305-307,311.
[12] 陈大卫,郭飞翔,顾瑞霞,等.具有降胆固醇能力的人源乳酸菌筛选[J].现代食品科技,2014,30(3):114-120.
[13] 叶明,刘宁,沈君子,等.降解甘油三酯益生菌选育及其发酵条件优化[J].食品科学,2008,29(10):369-371.
[14] 吕嘉枥,张淑娟,陈锐,等.酸乳中乳酸菌计数方法的研究[J].西北轻工业学院学报,2001,19(2):26-28.
[15] 严万里,陈晓明,郭丽燕,等.超氧化物歧化酶活性测定的影响因素研究[J].生物学通报,2011,46(3):50-53.
[16] 张雪梅,曾顺德,唐偲雨,等.不同乳酸菌株对萝卜泡菜中亚硝酸盐降解能力的研究[J].西南农业学报,2014,27(1):450-452
[17] 杜晓华,刘书亮,蒲彪,等.四川泡菜中降解亚硝酸盐乳酸菌的筛选鉴定及其应用[J].食品与发酵工业,2013,39(4):49-52.
[18] 彭灯水,颜正财,汤春梅,等.泡菜优良发酵乳酸菌耐受特性研究[J].食品与发酵科技,2010,46(4):50-55.
【责任编辑:陈佳】
Comparative study on probiotic properties of 10 strains probiotics
LV Jia-li, YAN Ya-mei, WANG Xiao-peng, LI Wen-juan, DU Bing
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:10 strains of selected probiotics are studied with their probiotic properties such as bile salt tolerance, degradation of cholesterol and triglyceride.Then the viable number of probiotics are detected when they are fermented in vegetable cultivation.On the basis of this,7 strains of probiotics which have significant growth-promoting effect are pick up and used for investigating the change of total acid,SOD enzyme and nitrite content.The result shows that the survival rate of LC,LP and LGG are more than 30%,when bile salt concentration was 0.3%,the degrading ability of cholesterol in LB,LC,LGG,LP,LCP,and EF bacteria are 45.63%,48.13%,30.63%,23.16%,20.63% and 16.88%,the degradation ability of triglyceride for 5 strains probiotics containing LB,LC,LR,Bb-12 and EF are followed by 23.06%,16.72%,44.6%,31.08%,22.9%;the viable counts of St,Bb-12 and EF is less than 107cfu/mL,on the contrary,the viable number of other 7 strains reach to 108cfu/mL;the total acid content of 7 strains bacteria are between 0.4% and 0.8% after fermenting for 24 hours;LCP and LA produce SOD enzyme in the fermentation process,the activity of SOD enzyme finally achieves 189.09 U/mL,the nitrite peak will disappear when adding LB,LP,LC,LA and LGG,the nitrite content is lower than 0.2 mg/kg after 48 hours.
Key words:probiotics; probiotic properties; vegetables; SOD enzyme
中图分类号:TS201.3
文献标志码:A
文章编号:1000-5811(2016)01-0118-05
作者简介:吕嘉枥(1964-),女,陕西三原人,教授,研究方向:应用微生物学
基金项目:陕西省科技厅科技统筹创新工程计划项目(2011KTCQ03-08)
收稿日期:*2015-11-28

