IFCC参考方法对两种常规检测系统ALP结果正确度的验证
吴立山, 陈淑芬, 胡治宝, 沈 敏, 周 俊
(宁波美康生物科技参考实验室,浙江 宁波 315104)
IFCC参考方法对两种常规检测系统ALP结果正确度的验证
吴立山,陈淑芬,胡治宝,沈敏,周俊
(宁波美康生物科技参考实验室,浙江 宁波 315104)
摘要:目的评价常规检测系统测定血清碱性磷酸酶(ALP)的正确度。方法以国际临床化学联合会(IFCC)参考方法和两种常规检测系统(简称A法、B法)同时测定20份新鲜单人份血清样品。按美国临床实验室标准化协会(CLSI)EP9-A2文件评价两种常规检测系统测定结果的正确度,并用改良Bland-Altman图形分析法进行验证,评价常规检测系统与参考方法测定结果的一致性,综合判断常规检测系统的测定结果。按CLSI EP14-A2文件评价A、B两种方法校准品的基质效应。结果A法、B法与IFCC参考方法测定结果的直线回归方程分别为YA=0.982 9XIFCC+0.010 8,YB=0.938 3XIFCC+0.012 9,平均偏倚分别为-1.1%、-5.5%。A法和B法检测结果的相关方程为YB=0.955 2XA+0.001 36,R2=0.997 6。A法和B法的校准品均存在基质效应,其中A法校准品的基质效应更明显。结论A法与IFCC参考方法正确度性能一致,B法与IFCC参考方法正确度性能不一致。
关键词:碱性磷酸酶;检测系统;参考方法;基质效应
中图分类号:
文章编号:1673-8640(2015)01-0044-05Q555
文献标志码:码:A
DOI:10.3969/j.issn.1673-8640.2015.01.011
Abstract:ObjectiveTo evaluate the accuracy of serum alkaline phosphatase (ALP) determination by routine measurement systems. MethodsThe fresh serum samples were determined simultaneously by the International Federation and Clinical Chemistry(IFCC) reference method and 2 routine measurement systems (A method and B method). The accuracies were evaluated according to the guideline of EP9-A2, the Clinical and Laboratory Standards Institute(CLSI). Meanwhile, the consistency of results between routine measurement systems and IFCC reference method was evaluated by improved Bland-Altman graphical analysis. The accuracies were evaluated comprehensively. The matrix effects of A and B methods were evaluated according to CLSI EP14-A2. ResultsThe regression equation of A method with IFCC reference method was YA= 0.982 9XIFCC+0.010 8, and the average bias was -1.1%. The regression equation of B method with IFCC reference method was YB=0.938 3XIFCC+ 0.012 9, and the average bias was -5.5%. The correlation equation between A method and B method was YB=0.955 2XA+0.001 36, R2=0.997 6. The calibrator matrix effects of both A method and B method were found, and the calibrator matrix effect of A method was more significant. ConclusionsThe accuracy of A method is consistent with that of IFCC reference method, and the accuracy of B method is inconsistent with that of IFCC reference method.
作者简介:吴立山,男,1982年生,硕士,工程师,主要从事临床生物化学量值溯源及质量管理。
收稿日期:(2014-03-23)
Verification on the result accuracy of ALP by two routine measurement systems according to IFCC reference methodWULishan,CHENShufen,HUZhibao,SHENMin,ZHOUJun.(NingboMedicalSystemBiotechnologyReferenceLaboratory,ZhejiangNingbo315104,China)
Key words: Alkaline phosphatase;Measurement system;Reference method;Matrix effect

量值溯源是近年来临床检验领域的研究热点之一,是实现临床检验结果标准化的唯一有效的途径。而“方法学比较”法是一种评价临床检验定量测量方法正确度的可靠方法[1]。目前,国内实验室有采用美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)EP9-A2文件所述的“方法学比较”法评价测量结果的正确度[2-3],也有采用CLSI EP15-A2文件提出的“方法学比较”法,即采用新方法和被替代的方法同时检测样品来确认新方法的性能[4]。但有研究发现,不同的实验方案、不同的数据处理方式在处理相同的测定数据时可得出不一致的结论[1]。采用“方法学比较”法进行正确度评价时,需用已知测量性能达到参考方法性能要求的参考方法测量程序作为“比较”方法。
陈宝荣等在采用“方法学比较”法评价常规检测系统的正确度方面做了很多的研究工作。他们运用检验医学溯源联合委员会(Joint Committee for Traceability in Laboratory Medicine,JCTLM)公布的参考方法,依据CKSI EP9-A2文件评价了淀粉酶、γ-谷氨酰基转移酶、总胆红素、葡萄糖等常规检测系统的正确度[5-8]。在评价常规系统正确度时,需应用稳定的参考方法、严谨的实验方案、正确的数据处理方案及评价标准等。我们采用(International Federation of Clinical Chemists,IFCC)参考方法和两种常规检测系统同时测定20份不同浓度的新鲜血清和校准品,按CLSI EP9-A2文件对常规检测系统的正确度进行评价,按CLSI EP14-A2文件评价校准品的基质效应,以期实现常规检测系统的溯源性,符合ISO 18153、ISO 15189文件对测量结果正确度的评价要求[9-10]。
材料和方法
一、材料
1.仪器(1)参考方法仪器:UV-2450 紫外可见分光光度计(日本SHIMADZU公司)、1523型点温度计(美国FLUKE公司)、XS205DU型分析天平(瑞士METTLER TOLEDO公司)、SevenMulti型pH计(瑞士METTLER TOLEDO公司)、移液器(德国Eppendorf AG公司)。所用仪器均通过相关部门鉴定或参考实验室内部文件校准;(2)常规检测方法的仪器:HITACHI 7180全自动生化分析仪(日本日立公司)。
2.试剂(1)参考方法试剂:无水HEDTA(99%)、七水硫酸锌(99%)、四水醋酸镁(99%)、2-氨基-2-甲基-1-丙醇(95%)、六水磷酸对硝基苯二钠盐(99%)、氯化钠(99.5%),以上试剂均购自美国Sigma公司;(2)常规方法试剂:A公司(批号:20130116)、B公司(批号:20130301)生产的ALP试剂盒。
3.标准物质、校准品、质控品和血清样品(1)标准物质:有证参考物质(JC-ERM Lot.006 ALP),认定值为(154±5)U/L;(2)校准品:A、B两家公司的校准品(批号分别为20130724、167254,认定值分别为5.568、4.3 μkat/L);(3)质控品:2012年IFCC组织的国际室间质评样品(RELA样品,批号分别为RELA-A和RELA-B,参考值分别为10.010和6.289 μkat/L),2012年卫生部临床检验中心样品(批号分别为2012E07和2012E08,参考值分别为1.434和4.335 μkat/L);(4)血清样品:20种不同浓度新鲜单人份血清,ALP正常血清的参考区间为女性0.55~1.64 μkat/L,男性0.72~1.92 μkat/L。
二、标准物质、校准品、质控品和血清样品的制备
临用前30 min从冷冻柜取出标准物质,室温复溶,使用无CO2水、称重法复溶,复溶后当天内使用。以称重法复溶校准品和质控品,复溶后按说明书规定使用。取20份实验当天不同浓度的新鲜患者血清制备血清样品。
三、实验方案
1.参考方法检测方案按照IFCC参考方法准备实验条件,用标准物质JC-ERM Lot.006验证参考方法测量结果的正确度,3次测量结果在“认定值±不确定度”范围内。用2012年RELA样品验证参考方法测量结果的精密度,要求样品每天测定5次,连续测定2 d,10次测定结果变异系数(CV)≤1%。在参考方法测量的正确度和精密度达到要求后进行20份血清样品测定。测定顺序为质控→样品→质控,每个样品重复测定2次,每10份血清加测一个质控。
2.常规方法检测方案两种检测系统分别由A、B厂家试剂、各自的校准品以及试剂配套的参数、HITACHI 7180全自动生化分析仪组成(简称A法、B法)。两种方法同时在同一仪器的不同通道上进行测定。按相关操作校准系统后,测定RELA样品和20份新鲜血清样品。每个样品重复测定2次,取均值作为评价数据。
四、统计学方法
采用Origin 8.0软件进行统计分析。按CLSI EP9-A2文件评价两种常规检测系统测量结果的正确度,并用改良Bland-Altman图形分析法进行验证。根据CLSI EP14-A2文件[11]评价A、B两种方法校准品的基质效应。
结果
一、测量数据的有效性检验
所有数据经检验无离群值。
二、IFCC参考方法的检测性能
JC-ERM Lot.006的检测结果在“认定值±不确定度”范围内。用2012年RELA样品验证参考方法的精密度,CV<1%,见表1。符合IFCC参考方法检测的性能要求。
三、IFCC参考方法和A、B两种常规方法检测质控(2012年RELA)样品的结果
采用IFCC参考方法和A、B两种常规方法测定质控(2012年RELA)样品,结果见表2。IFCC参考方法和B法2个样品测定结果在要求范围内(等效限±5.25%),A法2个样品测定结果在要求范围外,且均明显偏高。
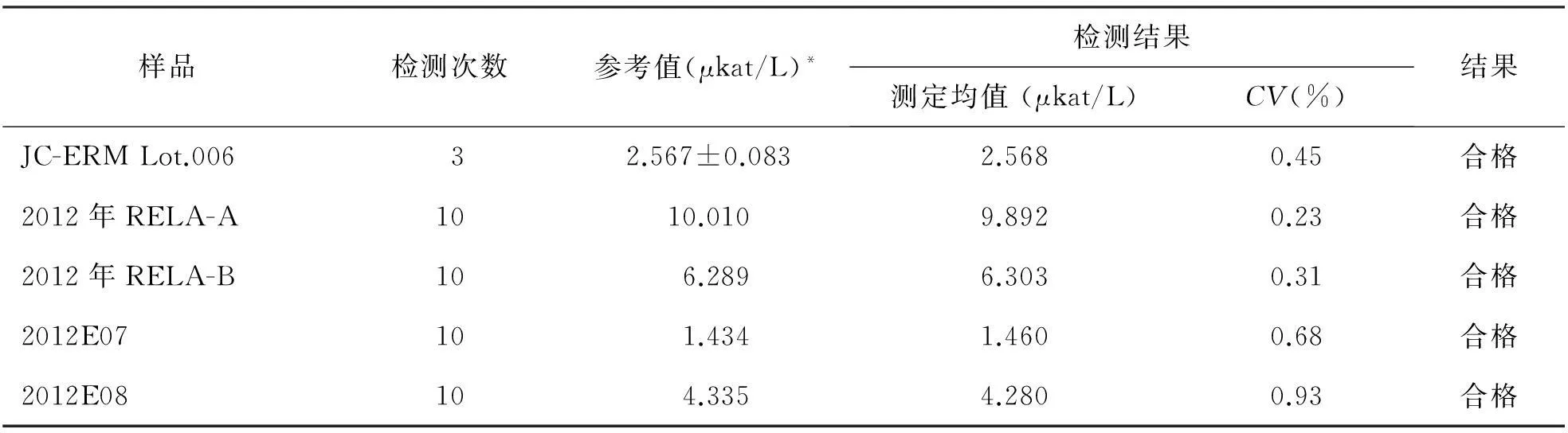
表1 本实验室IFCC参考方法检测性能
注:*表示2012年RELA参考结果[国际参考实验室均值(剔除离群值)等效限±5.25%]

表2 质控(2012年RELA)测定结果
注:*为国际参考实验室均值(剔除离群值)等效限±5.25%;#为与参考值之间的偏倚程度
四、A法和B法测定结果的比较
采用A法和B法在HITACHI 7180全自动生化分析仪不同通道上同时测定20份不同浓度新鲜单人份血清样品,以A法测定结果为X轴,B法测定结果为Y轴作图。两种检测方法所得的检测结果存在明显的差异,A法结果明显高于B法结果。见图1。
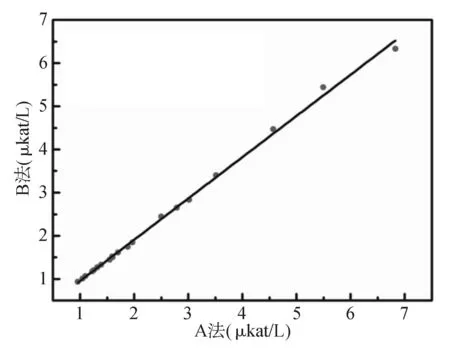
注:Y=0.955 2X+0.001 36,R2=0.997 6
图1A法与B法测定结果的比较
五、A法、B法与IFCC参考方法测定结果比较
采用A法和B法在HITACHI 7180全自动生化分析仪不同通道上同时测量20份不同浓度新鲜患者血清样品。以IFCC参考方法作为比较方法,两种检测系统作为待评价方法,按CLSI EP9-A2文件和改良Bland-Altman图形分析法进行评价。A法、B法与IFCC参考方法相比,A法测定结果略低,而B法测定结果则明显偏低。见图2、图3。改良Bland-Altman图形分析法显示,与IFCC参考方法比较,A法所测值整体偏低1.1%,其平均偏倚在IFCC参考方法允许范围内,满足可接受变异范围的要求;而B法所测值整体偏低5.5%,已超出IFCC参考方法的允许范围。见图4、图5。
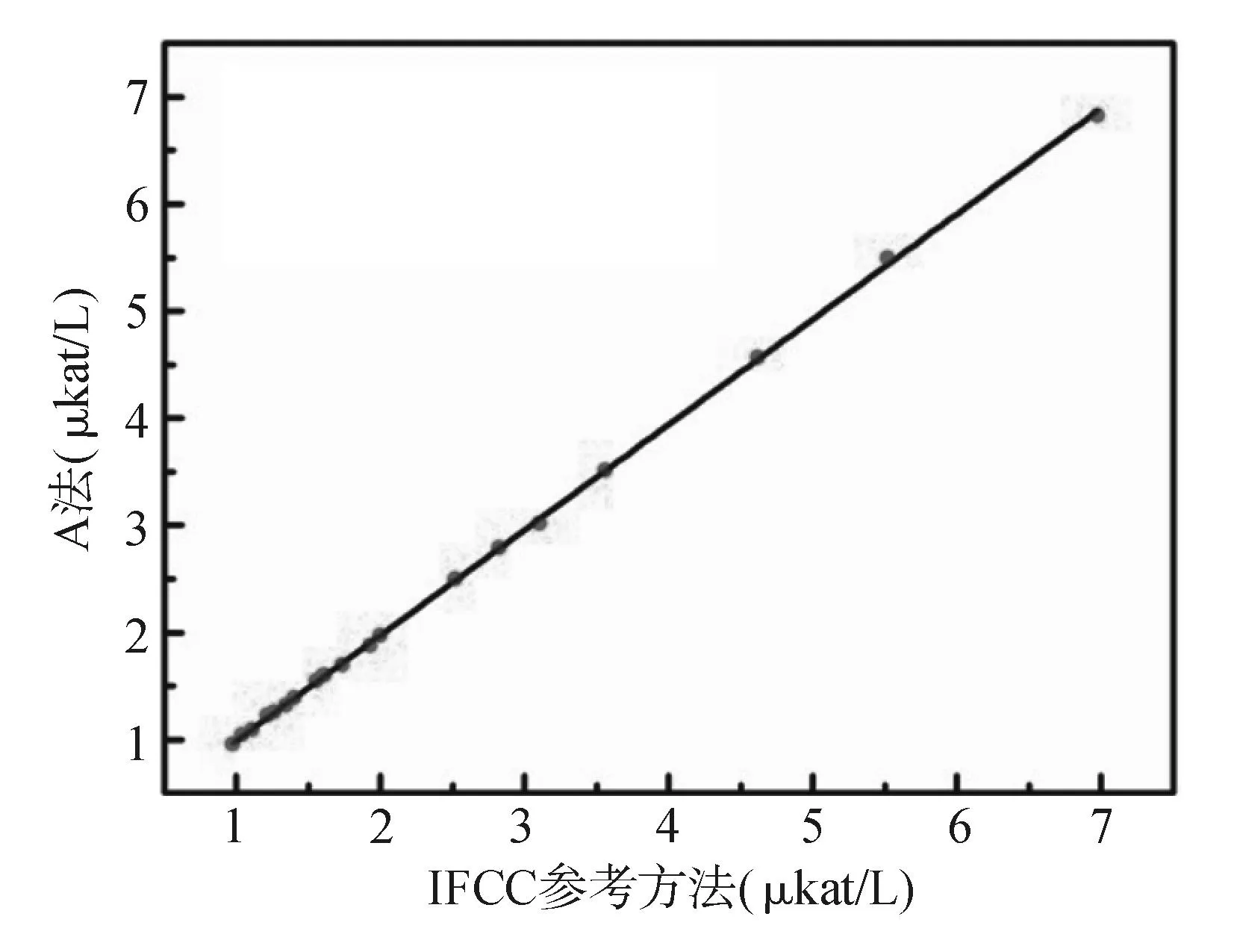
注:Y= 0.982 9X+0.010 8,R2 = 0.999 8图2 A法与IFCC参考方法测定结果比较
六、A法和B法校准品的基质效应评价
按CLSI EP14-A2文件评价A法和B法校准品的基质效应。采用IFCC参考方法和A、B法同时在HITACHI 7180全自动生化分析仪不同通道上检测20份新鲜患者血清样品和A、B两法的校准品(以下分别称为A校准品、B校准品),以IFCC参考方法作为比较方法(X轴),A、B法作为评价方法(Y轴),用Origin 8软件作图评价A、B校准品的基质效应。A、B校准品均落在IFCC参考方法和两种常规方法的直线回归方程的±95%可信区间外,表明A、B校准品均存在基质效应,其中A校准品的基质效应更为明显。见图6、图7。

注:Y= 0.938 3X+0.0129,R2= 0.996 3
图3B法与IFCC参考方法测定结果比较

注:平均偏倚=-1.10%;绝对平均偏倚=1.26%
图4A法与IFCC参考方法测定结果比较的
Bland-Altman图
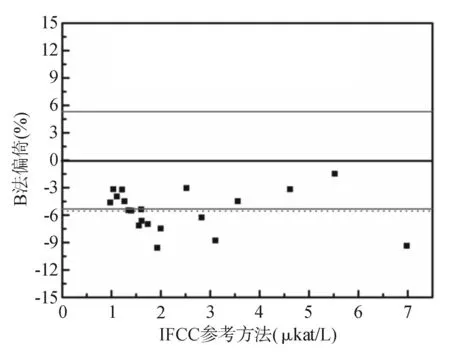
注:平均偏倚=-5.50%;绝对平均偏倚=5.50%
图5B法与IFCC参考方法测定结果比较的
Bland-Altman图
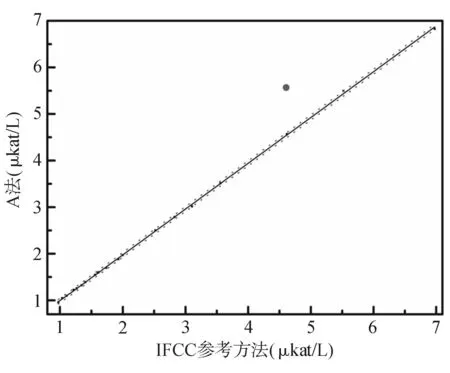
图6 A校准品的基质效应
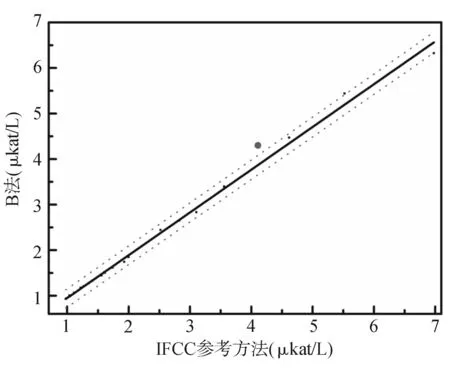
图7 B校准品的基质效应
讨论
CLSI EP9-A2文件的方法是目前临床实验室评价常规方法测量结果正确度的常用方法。它采用参考方法和常规方法同时测定不同浓度的血清样品,比较两种方法的一致性。《临床检验质量管理技术基础》[12]一书中指出:两种方法的线性回归方程斜率(a)在1.00 ± 0.02,截距(b)≈0作为一致性的标准。但截距≈0没有一个具体的评价标准,且相关实验数据表明,在斜率接近1时,有部分样品存在严重的系统误差。也就是说方法学比较可准确的反映参考方法与常规方法的相关性,但不能灵敏的反映常规方法的系统误差。CLSI EP9-A2文件中的差异图是“常规方法均值-参考方法均值”对“(常规方法均值+参考方法均值)/2”作图。这种评价方法不能很直观的反映常规方法与参考方法的偏倚程度。
本研究对传统Bland-Altman图形分析法进行改良,以参考方法测定结果为横坐标,常规方法测定均值与参考方法测定结果的偏倚程度为纵坐标作图(改良Bland-Altman图形分析法)。这种验证方法可以直观的反应常规方法与参考方法的偏倚程度。本研究以常规方法与参考方法的平均偏倚和绝对平均偏倚不超过±5.25%为标准(IFCC允许偏倚范围)判断常规方法的正确度。
本研究采用A法和B法在同一生化仪不同通道上同时测定20份不同浓度新鲜单人份血清样品。结果显示两种检测方法的检测结果存在明显差异,A法结果高于B法(见图1)。
为验证两种常规方法测量结果的正确度,本研究按CLSI EP9-A2文件进行评价(见图2、图3)。A法与IFCC参考方法的线性回归方程为Y=0.982 9X+0.010 8,R2=0.999 8;B法与IFCC参考方法的线性回归方程为Y=0.938 3X+0.012 9,R2=0.996 3。由此可见A法、B法与IFCC参考方法测定结果均有良好的相关性,而且A法的线性在要求范围内(Y=aX+b,a=1.00±0.02,b≈0),故判断A法测定结果正确。同理得B法线性未在要求范围内,B法测定结果不正确。因方法学比较不能灵敏的反映常规方法的系统误差,针对此缺陷需进一步证实。为进一步验证上述结论,采用改良Bland-Altman图形分析法进行进一步分析。
从图4、图5中可发现A法和B法测定结果散点基本上分布于水平零线以下,即测定结果与IFCC参考方法存在着一定程度的系统偏倚,其中A法的平均偏倚为-1.10%,其绝对平均偏倚为1.26%;B法的平均偏倚为-5.50%,其绝对平均偏倚为5.50%。因本研究以常规方法与参考方法的平均偏倚和绝对平均偏倚不超过±5.25%为标准来判断常规方法的正确度。故认为A法的测定结果虽存在一定的系统偏倚,但结果在IFCC参考方法允许偏倚范围内,所有数据的变异亦能满足临床可接受变异范围的要求,认为A法测定结果正确。而B法的测定结果存在较大的系统偏倚,且结果已超出IFCC参考方法的允许偏倚范围,故认为B法测定结果不正确。
当参考物质用于常规方法检测时必须在所有方法间确认其互换性[13]。但是,校准品的功能毕竟不同于参考物质。从图6、图7可以发现A法和B法配套的校准品在常规方法与参考方法间存在基质效应,A校准品更显著,但实验发现这并没有影响测定结果的正确度。而B法基质效应虽然没有如此明显,但测定结果系统性偏低。
根据CLSI EP9-A2、EP14-A2文件和改良Bland-Altman图形分析法进行综合分析,可以判定A法测定结果正确;B法与IFCC参考方法测定结果正确度性能不一致,即B法测定结果不正确,引起不正确的原因是由于存在明显的系统误差。
由此可见,不同的检测系统测定同一血清可得到不同的数据。因此,各厂家急需建立检测项目常规测量系统的测量正确度的评价方法,从而实现常规检测系统的溯源性。由于条件限制,本研究的数据仅仅是一个单位的实验结果,如果能经过多个单位实验得到相似结果,则结论可能更有说服力。
参考文献
[1]陈宝荣. “方法学比较”法评价临床检验定量测量方法正确度时应注意的问题与对策[J]. 临床检验杂志,2012,30(10): 821-825.
[2]Clinical and Laboratory Standards Institute. Method comparison and bias estimation using patient samples; approved guideline[S]. EP9-A2, CLSI, 2002.
[3]International vocabulary of metrology-basic and general concepts and associated terms [S]. JCGM 2000,2008.
[4]Clinical and Laboratory Standards Institute. User verification of performance for precision and trueness; approved guideline-second edition [S]. EP15-A2, CLSI, 2006.
[5]陈宝荣,孙慧颖,邵燕,等. 四种血清α-淀粉酶厂家系统测量结果的正确性评价[J]. 中华检验医学杂志,2012,35(4): 309-316.
[6]邵燕,孙慧颖,胡滨,等. 血清总胆红素常规系统测量结果的正确度评价[J]. 标记免疫分析与临床,2013,20(4): 266-268.
[7]陈宝荣,孙慧颖,邵燕,等. IFCC参考方法对两种测量系统GGT结果正确性的验证[J]. 标记免疫分析与临床,2011,18(5): 336-341.
[8]孙慧颖,邵燕,胡滨,等. 7种血清葡萄糖常规检测系统测量结果的正确度评价[J]. 临床检验杂志,2013,31(7): 542-544.
[9]In vitro diagnostic medical devices measurement of quantities in biological samples metrological traceability of values for catalytic concentration of enzymes assigned to calibrators and control materials [S]. ISO 18153,2003.
[10]Medical laboratories-particular requirements for quality and competence [S]. ISO 15189,2003.
[11]Clinical and Laboratory Standards Institute. Evaluation of matrix effects; approved guideline [S]. EP14-A2, CLSI, 2002.
[12]冯仁丰. 临床检验质量管理技术基础[M].上海:上海科学技术文献出版社, 2003:7.
[13]冯仁丰. 互换性依然是问题[J].检验医学,2013,28(12):1063-1068.
(本文编辑:龚晓霖)