慢性淋巴细胞白血病CD5漏检临床案例分析及对策
唐古生, 柳 敏, 胡晓霞, 高 磊, 杨建民, 王健民
(上海市长海医院血液内科,上海 200433)
慢性淋巴细胞白血病CD5漏检临床案例分析及对策
唐古生,柳敏,胡晓霞,高磊,杨建民,王健民
(上海市长海医院血液内科,上海 200433)
摘要:目的分析不同荧光素标记抗体对慢性淋巴细胞白血病(CLL)B细胞表面CD5检测结果差异及其对临床诊断的影响。方法采用流式细胞仪检测3例CD5表达强度不同的慢性淋巴细胞白血病(CLL)患者的免疫表型,采用SYSMEX XE2100 全自动血液分析仪检测血常规;以1例急性B淋巴细胞白血病(B-ALL)患者作为阴性对照。结果采用异硫氰酸荧光素(FITC)标记抗体检测4例患者骨髓异常B淋巴细胞CD5表达,CD5阳性细胞未见独立成群,阳性细胞比例分别为47.1%、17.7%、6.7%和7.9%;以≥20%为标准,仅病例1阳性。以PE-Cy7荧光素标记抗体重新检测,病例1和2的CD5阳性细胞独立成群,病例3 CD5表达呈连续表达模式,阳性细胞比例分别上升至91.1%、70.3%和38.2%。而对照病例4(B-ALL患者)2次检测CD5比例均为阴性。病例1、2、3符合典型CLL免疫表型。结论CLL患者B细胞表面常异常表达CD5,但其表达强度显著低于T细胞表面CD5表达。采用弱荧光素标记抗体检测B细胞表面CD5表达,会出现漏检进而影响临床诊断。对弱表达抗原选择合适的荧光素标记,并进行验证和比对确定其准确性,是正确提供疾病免疫表型的重要保障。
关键词:CD5;免疫表型;慢性淋巴细胞性白血病;流式细胞仪;漏检
中图分类号:
文章编号:1673-8640(2015)01-0021-05R446.11
文献标志码:码:A
DOI:10.3969/j.issn.1673-8640.2015.01.006
Abstract:ObjectiveTo analyze the variation of CD5 caused by different fluorescein-labeled antibodies on B cells in patients with chronic lymphocytic leukemia(CLL) and the influence on clinical diagnosis. MethodsFlow cytometry and SYSMEX XE2100 automated hematology analyzer were used for the detection of immunophenotype and blood cell counts of 3 CLL patients with different expression intensities of CD5, respectively. 1 patient with B-cell acute lymphocytic leukemia(B-ALL) was selected as negative control. ResultIn 4 patients with abnormal B lymphocytes, using fluorescein isothiocyanate(FITC) fluorescein-labeled antibody, no independent groups expressing CD5 were identified, and the proportions of CD5 positive cells were 47.1%, 17.7%, 6.7% and 7.9%. For ≥20% as standard, there was only 1 positive case. Re-tested with PE-Cy7 fluorescein-labeled antibody, however, there were independent groups of CD5 positive cells in case 1 and 2, and there was still a continuous expression pattern of CD5 in case 3. The proportions of CD5 positive cells increased to 91.1%, 70.3% and 38.2% in these 3 specimens from CLL patients. In case 4, the specimen from B-ALL patient, the proportions of CD5 positive cells were negative in the 2 conditions. Case 1, 2 and 3 were typical CLL phenotyping. ConclusionsCD5 is often abnormally expressed on B cells in CLL patients, but its expression intensity is significantly lower than that on T cells. Using weak fluorescein-labeled antibodies might miss CD5 expression on B cells, and thus it will affect the clinical diagnosis because of leak detection. It should select appropriate fluorescein-labeled antibodies for weakly expressed antigens and conduct validation and comparison to determine its accuracy, which is an important safeguard for the provision of correct disease phenotype.
基金项目:国家自然科学基金面上项目(81270638);国家自然科学基金青年基金资助项目(81102249)
作者简介:唐古生,男,1978年生,博士,主治医师,主要研究方向为血液系统恶性疾病免疫学临床诊断。
收稿日期:(2014-02-26)
Analysis on the missing detection of CD5 in chronic lymphocytic leukemia and its countermeasuresTANGGusheng,LIUMin,HUXiaoxia,GAOLei,YANGJianmin,WANGJianmin.(DepartmentofHematology,ChanghaiHospital,Shanghai200433,China)
Key words: CD5; Immunophenotype; Chronic lymphocytic leukemia; Flow cytometry; Leak detection

目前,最新的国内外慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)/小淋巴细胞淋巴瘤(small lymphocytic lymphoma, SLL)诊断标准中均纳入了免疫表型的要求[1-3]。典型的CLL免疫表型为CD19+、CD5+、CD23+、CD43+/-、CD10-、 CD22dim、CD20dim、sIgdim和cyclin D1-。在CLL鉴别诊断中常采用CLL免疫表型积分,其中CD5+、CD23+、FMC-、sIgdim、CD22/CD79bdim/-各积1分。CLL患者通常积分为4~5分,积分低于4分者需要结合淋巴结、脾脏、骨髓组织学及遗传学检查等进行鉴别诊断。因此,细胞膜表面CD5标志的检测对于CLL的诊断和鉴别诊断具有非常重要的意义。然而我们在常规CLL免疫表型检测过程中发现,异常B细胞表面CD5表达明显低于成熟T淋巴细胞表面CD5的表达。如果采用弱荧光素如异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记进行检测可能会导致白血病细胞表面CD5抗原表达率偏低,甚至漏检。现从近期确诊的CLL病例中选择典型的3例患者,分析该问题在实际临床工作中的表现及其解决策略。
材料和方法
一、对象
选择2013年6至7月于上海市长海医院血液科门诊确诊为CLL且CD5表达量呈低中高分布的典型患者3例(以Pa1~Pa3表示),以急性B淋巴细胞白血病(B-ALL)患者 1例(以Pa4表示)作为阴性对照。4例患者的临床特征和实验室检查见表1。CLL诊断标准参照中国慢性淋巴细胞白血病诊治指南(2011年版)[1]。B-ALL诊断标准参照中国成人急性淋巴细胞白血病诊断与治疗专家共识(2012年)[4]。
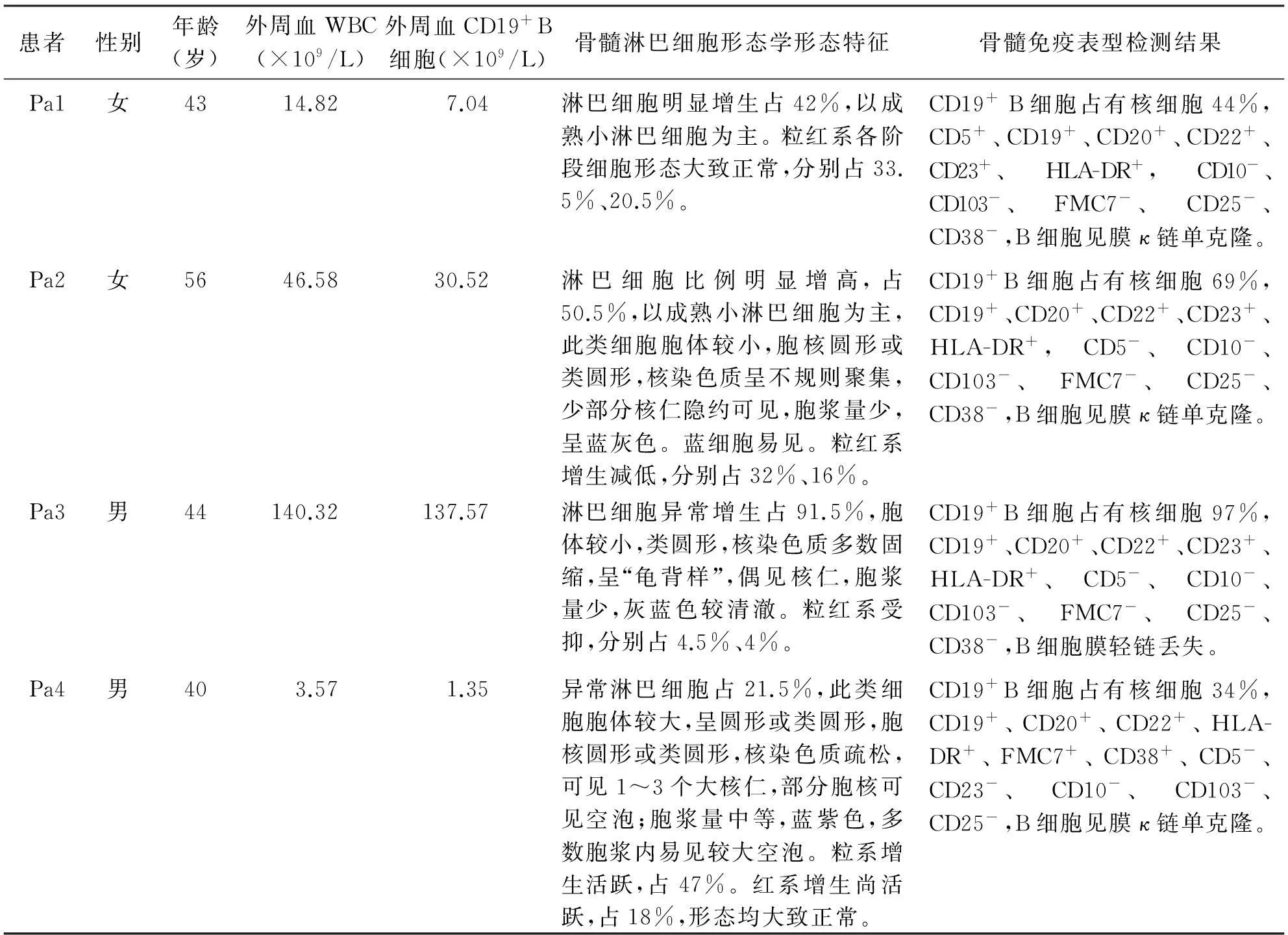
表1 患者临床资料特征
二、试剂和仪器
所用的单克隆抗体为美国Beckman-Coulter或BD公司产品,其中CD5检测采用BD公司预混的三色组合:CD5-FITC、CD10-藻红蛋白(phycoerythrin, PE)、CD19-Per-CP。本研究中重复检测CD5时,采用CD5-PE-Cy7和CD19-APC单标抗体,CD5抗体为同一克隆号。流式细胞仪为美国BD公司FACSAria I型,荧光激发光波长488 nm和633 nm,系统分析软件为DIVA 6.0.1。血常规检测采用SYSMEX XE2100 全自动血液分析仪(Sysmex公司)。
三、检测方法
采集所有患者外周血乙二胺四乙酸(EDTA)抗凝标本2 mL,常规检测血常规;骨髓穿刺获取骨髓液标本3 mL,EDTA抗凝,涂片形态学证实无稀释。 调整细胞数至每管白细胞总数为5×106,各指标根据抗体的颜色标记做适当组合。按说明书推荐用量加入抗体标本计数分管后先按各组合分别加入不同颜色标记的抗体,空白对照管加入采用各种颜色的同型对照。室温避光孵育15 min,2 mL Tris-NH4Cl裂解液裂解红细胞,磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤后上机。检测轻链的标本在加入抗体之前先用PBS洗涤3遍,以去除血浆中轻链对抗体的阻断结合作用。检测前常规进行仪器质控监测及荧光补偿调节。检测时首先根据前向散射光(forward scatter, FSC)和侧向散射光(side scatter, SSC)信号、CD45和SSC对淋巴细胞进行设门,膜表面标志表达以≥20%判断为阳性。
结果
4例患者的外周血和骨髓形态学检测、初次检测免疫表型表达结果见表1。4例患者CD5阳性细胞占CD19比例情况见图1。
分析时以CD19阳性细胞设门选定B细胞[图1(a),P3门],以未加抗体空白对照管,设定十字门初始位置,同时以CD19阴性和SSC低信号细胞群内CD5阳性细胞(含T细胞)和CD5阴性细胞作为内对照[见图1(a),P4门],确定最终门的位置,计算CD5+CD19+/CD19+比例。图中可见,4例患者CD19+B细胞均明显成群,前3例(Pa1~Pa3)患者具有相似的SSC信号,Pa4 CD19+细胞SSC信号明显增加[见图1(a),Pa4]。无论是FITC或PE-Cy7荧光素标记,4例患者T细胞CD5+细胞均独立成群,而 B细胞异常表达CD5时,其荧光强度显著低于自身T细胞表面CD5表达[见图1(b)、(c)]。以FITC标记检测CD5表达,前3例患者(Pa1~Pa3)B细胞表面CD5+细胞均未独立成群,呈连续表达模式,CD5+细胞占CD19阳性细胞比例分别为47.1%、17.7%、6.7%,Pa4未见B细胞表面明显CD5表达成群(见图1(b),Q2)。以膜表达≥20%为标准,仅Pa1 CD5表达阳性,Pa2、Pa3、Pa4 CD5表达均应判为阴性。
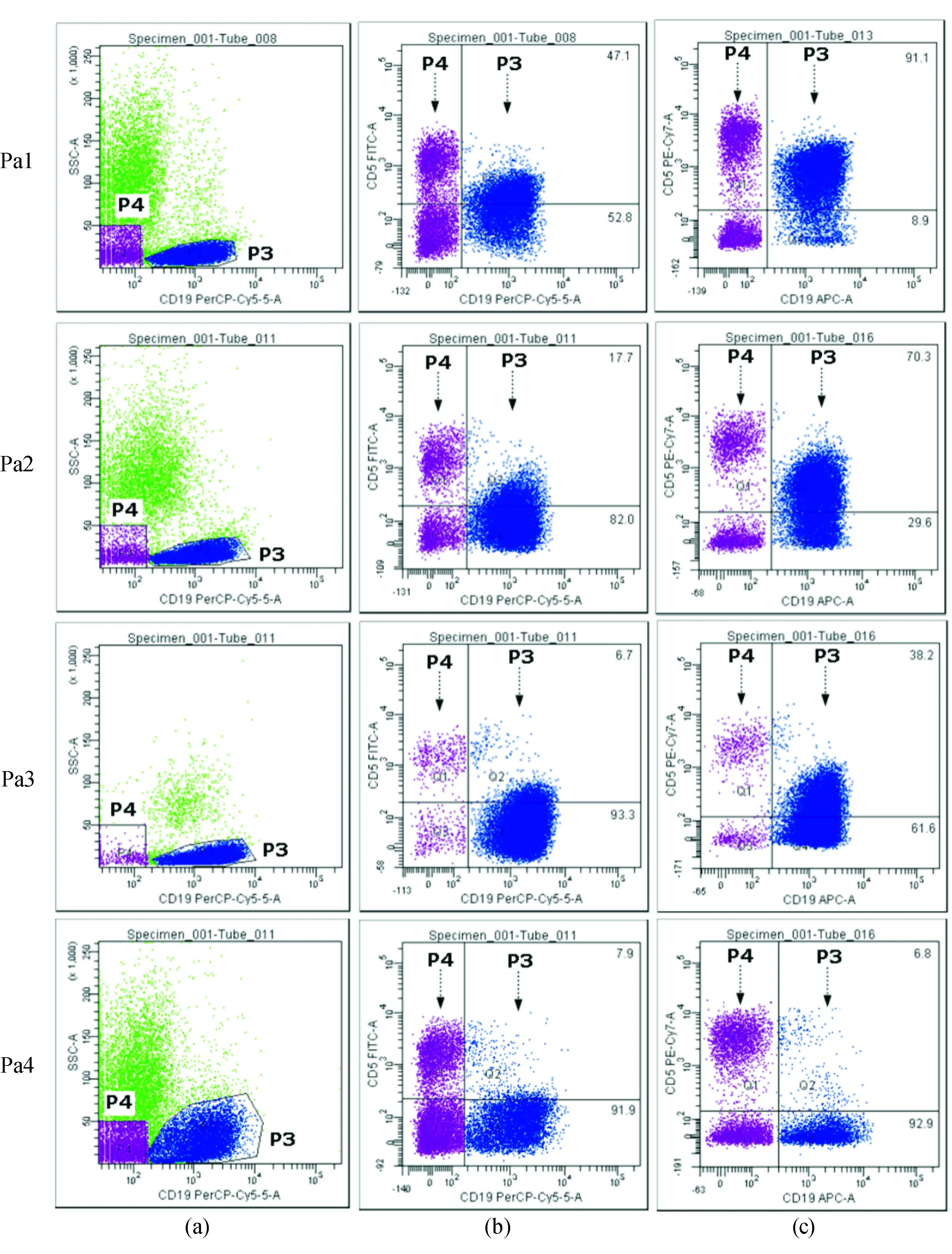
注:以FSC、SSC和CD45、SSC设门圈定有核细胞后,以CD19+细胞设门[见(a),P3门],判断CD5+细胞占CD19+细胞比例[见(b)、(c)];以CD19-和SSC低信号细胞群内CD5+细胞(含T细胞)和CD5-细胞作为内对照[见图1(a),P4门],设定十字Maker的位置,确定CD5+CD19+/CD19+细胞比例[Q2门内数值(%)];(b)列为FITC标记检测CD5表达,(c)列为PE-Cy7标记检测CD5表达
图1FITC标记降低了检测CLL患者B细胞表面CD5的检出率
以高亮度的PE-Cy7标记的CD5抗体重新检测这4例患者CD5表达。结果显示Pa1和Pa2的CD19+CD5+细胞独立成群,其占CD19+细胞比例分别显著上升为91.1%、70.3%,见图1中的Pa1和Pa2;而CD5表达仍呈连续表达模式,但CD5+细胞比例显著上升,占38.2%,见图1中的Pa3。此时,以膜表达≥20%为标准,3例患者CD5表达均可判为阳性。而Pa4采用PE-Cy7标记CD5检测时, CD5+细胞比例与FITC标记时接近,少部分细胞表达强度高,疑似门内混杂T细胞所致,且所占比例均未达到阳性标准,因此CD5表达判为阴性。
讨论
近年来白血病的免疫分型已成为血液恶性肿瘤诊断不可缺少的重要依据之一,已经被纳入多种白血病的诊断标准,同时也是白血病治疗后微小残留灶检测的重要方法之一。但在实际临床使用中,涉及的流式细胞仪型号多样、试剂种类繁多、选择抗体组合的经验和习惯的也不同、各种指标采用的标记荧光素也大不相同,因此临床检测结果变异较大,准确性难以评价,实验室间结果难以相互比对,结果分析需要较强的专业理论基础和实践经验。在选择不同荧光素标记的指标时,其原则是需要同时考虑荧光强度和抗原表位密度,对表达少的抗原表位应尽可能选择强度强的荧光素。然而在实际使用过程中,并不是每个实验室、针对每种疾病都能认识到这一点,并加以评估验证和进行正确的临床应用。而且有些抗原表位在某些细胞上高表达,某些细胞上低表达,对这类抗原的检测更需要对抗原本身的表达特点有深刻的了解,才能正确选择标记荧光素的种类,做出正确的检测结果。对于一些常见检测指标如B细胞表面CD5/CD19/CD10等,试剂厂家通常会生产一些标记了各种荧光素的预混的抗体组合,以减少常规操作步骤,减少操作误差。然而实际应用中,这些预混的组合因为预先标记荧光素的限制,是否适合用于特定疾病指标的检测仍需要进一步的临床验证。
对于CLL的免疫表型检测,目前的诊断标准已经提供了需要检测的主要指标。但在实际的临床工作中可能存在由于使用不恰当的荧光素标记,使得部分指标的检出率偏低,某些重要指标甚至影响了疾病的诊断。在国内对于CLL诊断的研究中,确诊为CLL患者的CD5阴性率从2.9%~28.2%不等,跨度非常大,且绝大部分报道CLL患者的CD5阴性率超过10%[5-12]。而国外文献报道CD5阴性B-CLL比例较低。大样本前瞻性研究发现确诊病例中仅约6.8%的患者为CD5-的非典型或变异型B-CLL[13-14],国内CD5-CLL的比率明显高于国外。这与目前国内外CLL的诊断标准把CD5+作为CLL的主要诊断依据似乎有一定的冲突。发生这种现象的原因可能与实验室检测手段和技术有一定的关系。因此本研究对确诊的CLL患者的CD5采用不同荧光素标记抗体进行检测,评价弱荧光素可能对CLL患者CD5检测的影响。
本研究在既往临床工作中针对临床怀疑是CLL患者的标本,初次筛查CD5、CD10、CD19的试剂为预混的三色组合:CD5-FITC、CD10-PE、CD19-PerCP。发现尽管采用CD5-FITC可以正确检测出部分CD5表达量较高的患者, CD5-FITC阳性B细胞在流式散点图中也可以呈现独立成群。但依然有部分患者尽管外周血B细胞绝对数、骨髓形态学和免疫表型特点均提示CLL诊断可能,但患者B淋巴细胞CD5未达到阳性判断标准。进一步分析发现B细胞表面异常CD5的表达强度明显低于患者体内T细胞表面CD5表达,而该预混试剂组合中CD5采用荧光强度最弱的FITC进行标记。考虑到弱荧光素标记弱表达抗原可能会造成该抗原检测的假阴性结果,因此采用荧光强度较强的PE-Cy7标记CD5抗体,重新对这些患者进行检测,结果发现部分患者CD5阳性细胞比例均呈大幅度上调。本研究所列举的3例患者中原来未能达到阳性标准的2例患者其CD5表达也判为阳性。综合本实验室外周血B细胞绝对数、骨髓形态学和临床症状体征、其它免疫分子表达等各方面的证据,本研究中前3例患者均最终确诊为CLL。从本研究所提供的流式图形来看,病例2和3若按照CD5-FITC检测结果判断应归类于CD5-CLL,而按照CD5-PE-Cy7检测结果判断,这样归类显然是不合适的,应该属于CD5+CLL患者。本研究所证实的这种人为检测差异的存在可能是国内文献报道的CD5-CLL患者比例明显高于国外的现象的重要原因。同时以明确为阴性表达的B-ALL患者标本(病例4)作为阴性对照,也证实本研究中第2次采用PE-Cy7标记重新检测发现3例患者CD5表达显著上调,并非是由于该荧光素提高了检测背景,而是由于其本身荧光强度高,提高了弱表达抗原的检测能力所致。所以,异常B细胞表面CD5的准确检测对于CLL的诊断和鉴别诊断异常重要。CD5漏检可人为增加CLL与其它CD5阴性或弱阳性慢性淋巴细胞增殖性疾病鉴别诊断的难度,甚至出现误诊,如脾边缘区淋巴瘤、滤泡淋巴瘤以及毛细胞白血病等。
本研究结果显示FITC标记的CD5抗体检测T细胞表面CD5没有问题。因为其CD5呈高表达,在流式散点图上可见到阳性细胞独立成群。然而B细胞表面表达CD5强度要弱很多,此时采用FITC标记就可能造成CD5表达检出率偏低,导致临床诊断困难。国内多个实验室曾采用FITC标记抗体检测B细胞表面CD5[5-6],存在CLL患者白血病细胞表面CD5漏检的可能。因此建议各实验室在使用该类试剂时,预先采用各种荧光素标记的CD5对确诊为CLL的病例进行检测,评价FITC标记的CD5在本实验室的检测系统中是否能够正确提供CD5表达率的检出情况,有条件时建议优先选择荧光强度较高的荧光素标记抗体检测CD5表达。在临床白血病和淋巴瘤其他免疫表型检测中,对弱表达抗原选择合适的荧光素标记,并在临床实践中加以验证和比对,确定其检测结果的准确性,对于提供疾病正确的免疫表型,进而为相关疾病的诊断提供充分的依据显得异常重要,应引起临床医生和实验室流式检测和报告人员的足够重视。
参考文献
[1]中华医学会血液学分会. 中国慢性淋巴细胞白血病的诊断与治疗指南(2011年版)[J]. 中华血液学杂志,2011,32(7): 498-501.
[2]范磊, 徐卫, 李建勇. 慢性淋巴细胞白血病2011年NCCN诊疗指南解读[J]. 白血病·淋巴瘤, 2011, 20(2):121-122.
[3]HALLEK M. Chronic lymphocytic leukemia: 2013 update on diagnosis, risk stratification and treatment[J]. Am J Hematol, 2013, 88 (9): 803-816.
[4]中华医学会血液学分会,中国抗癌协会血液肿瘤专业委员会.中国成人急性淋巴细胞白血病诊断与治疗专家共识[J]. 中华血液学杂志, 2012,33(9): 789-792.
[5]卢娟, 翟志敏, 张爱梅,等. 免疫表型在B慢性淋巴细胞白血病诊断和鉴别诊断中的意义[J]. 中国综合临床,2009,25(2): 170-172.
[6]许晓东,常乃柏,赵声明,等. 慢性淋巴细胞白血病患者31例免疫表型分析[J]. 中华老年医学杂志, 2010, 29(2): 135-137.
[7]张青艳, 陈智超, 赵阿兰, 等.慢性淋巴细胞白血病的临床免疫表型分析[J]. 山东医药, 2013,53(11): 1-3.
[8]刘艳荣, 常艳, 王卉, 等.慢性淋巴细胞系统白血病免疫表型分析[J]. 中华检验医学杂志,2003, 26(1): 17-21.
[9]许芳, 程澍, 翁香琴, 等.112例CD5阳性与15例CD5阴性慢性淋巴细胞白血病的比较分析[J].中华血液学杂志,2008, 29(2):134-135.
[10]易莎,张小斌,陈燕.103例慢性淋巴细胞白血病患者免疫表型的研究[J].临床血液学杂志,2010, 23(2): 86-88.
[11]马勤芬, 周惠芬, 朱明清, 等.51例慢性淋巴细胞白血病的免疫表型及细胞遗传学特征研究[J]. 中国实验血液学杂志, 2007, 15(4): 696-699.
[12]秦继霞 , 方美云, 孙国珍, 等. 免疫分型联合核型检查对初诊慢性淋巴细胞白血病的诊断价值[J]. 白血病·淋巴瘤, 2012, 21(11): 681-683.
[13]CAVALCANTI JU'NIOR GB, SALES VS, CAVALCANTI E SILVA DG, et al. Detection of CD5 in B-cell chronic lymphoproliferative diseases by flow cytometry: a strong expression in B-cell chronic lymphocytic leukemia[J]. Acta Cir Bras, 2005, 20(Suppl 1): 101-107.
[14]GEISLERr CH, LARSEN JK, HANSEN NE, et al. Prognostic importance of flow cytometric immun-ophenotyping of 540 consecutive patients with B-cell chronic lymphocytic leukemia[J]. Blood, 1991, 78(7):1795-1802.
(本文编辑:范基农)

