1~21日龄黄羽肉鸡饲粮铜营养需要量的研究
1~21日龄黄羽肉鸡饲粮铜营养需要量的研究
黄羽肉鸡由我国地方黄羽鸡种选育而成,具有肉质鲜美、肌间脂肪含量高、风味独特等特点,深受消费者喜爱。我国农业部于2004年制定并颁布了《鸡饲养标准》(NY/T 33—2004)[1],然而,随着家禽育种学科的快速发展,黄羽肉鸡的品种(品系)特点、生长性能等发生了很大变化,导致其营养需要改变。加上该饲养标准铜需要量主要是参照NRC(1994)[2]制定的,而NRC是以白羽肉鸡作为对象制定的,由于白羽肉鸡和黄羽肉鸡在生长发育、生理机能都有所差异,所以该饲养标准铜需要量并不完全符合黄羽肉鸡的特点,因此有必要对黄羽肉鸡铜需要量进行研究。对肉鸡铜需要量的研究主要是以白羽肉鸡为主,并且需要量主要集中在8~11 mg/kg内[3-6],不同阶段黄羽肉鸡的铜需要量却缺乏系统的研究。研究表明饲粮中常可通过添加一定剂量的铜来改变铜代谢,改善抗氧化性能、免疫性能,从而缓解应激,提高生长性能[7-9]。因此本试验以黄羽肉鸡为研究对象,研究饲粮添加不同水平铜对1~21日龄阶段快大型岭南黄羽肉鸡生长性能、抗氧化性能、免疫器官发育及血清和肝脏铜含量等的影响,从而确定该阶段黄羽肉鸡铜需要量,为微量元素添加剂的安全有效应用、黄羽肉鸡饲粮的科学配制和黄羽肉鸡饲养标准的修订提供科学依据。
1 材料与方法
1.1 试验动物与分组
试验在广东省农业科学院动物科学研究所动物营养研究室试验场进行。本试验选用1日龄健康、发育良好的块大型岭南黄羽肉公鸡雏鸡作为试验鸡1 440只,采用单因子随机分组设计,根据体重均衡原则随机分成6个组,分别饲喂添加0(对照)、4、8、16、32、64 mg/kg铜的饲粮。每个组6个重复,每个重复40只鸡。
1.2 试验饲粮及饲养管理
试验采用纯合基础饲粮(表1),其营养水平参考《鸡饲养标准》[1](NY/T 33—2004)中的黄羽肉鸡营养需要标准,根据《中国饲粮成分表(第15版)》计算饲粮配方,参考Okonkwo等[10]的方法选用大豆浓缩蛋白、酪蛋白、葡萄糖、玉米淀粉等配制。试验1组为对照组,采用基础饲粮,不添加铜(铜含量为2.80 mg/kg),试验2~6组在基础饲粮中分别添加4、8、16、32、64 mg/kg铜,铜以五水硫酸铜(CuSO4·5H2O)形式添加,以设计的铜等量替代预混料中的玉米芯粉。各组饲粮除铜水平不同外,其他营养成分水平基本一致。试鸡采用网上平养,自由采食与饮水。其他按常规饲养操作规程进行,试验期为21 d。
1.3 试验方法与测定指标
试验全期,每天仔细观察鸡群的精神状态、食欲、粪便、缺乏症、死亡等情况,记录试验各组雏鸡的死亡数,并对病死鸡逐只进行病理剖检,查明死因。
1.3.1 样品的采集与处理
试验结束时,每重复选取健康、接近平均体重的试鸡2只,每组12只,共72只,称活重后,翅静脉采血约10 mL,在室温下倾斜放置30 min后,3 500 r/min离心10 min,分离血清于-20℃保存待测。采血后将鸡完全放血处死,剖摘肝脏,做好标记,-20℃保存待测;摘取免疫器官(脾脏、胸腺、法氏囊),去除结缔组织和脂肪称重。
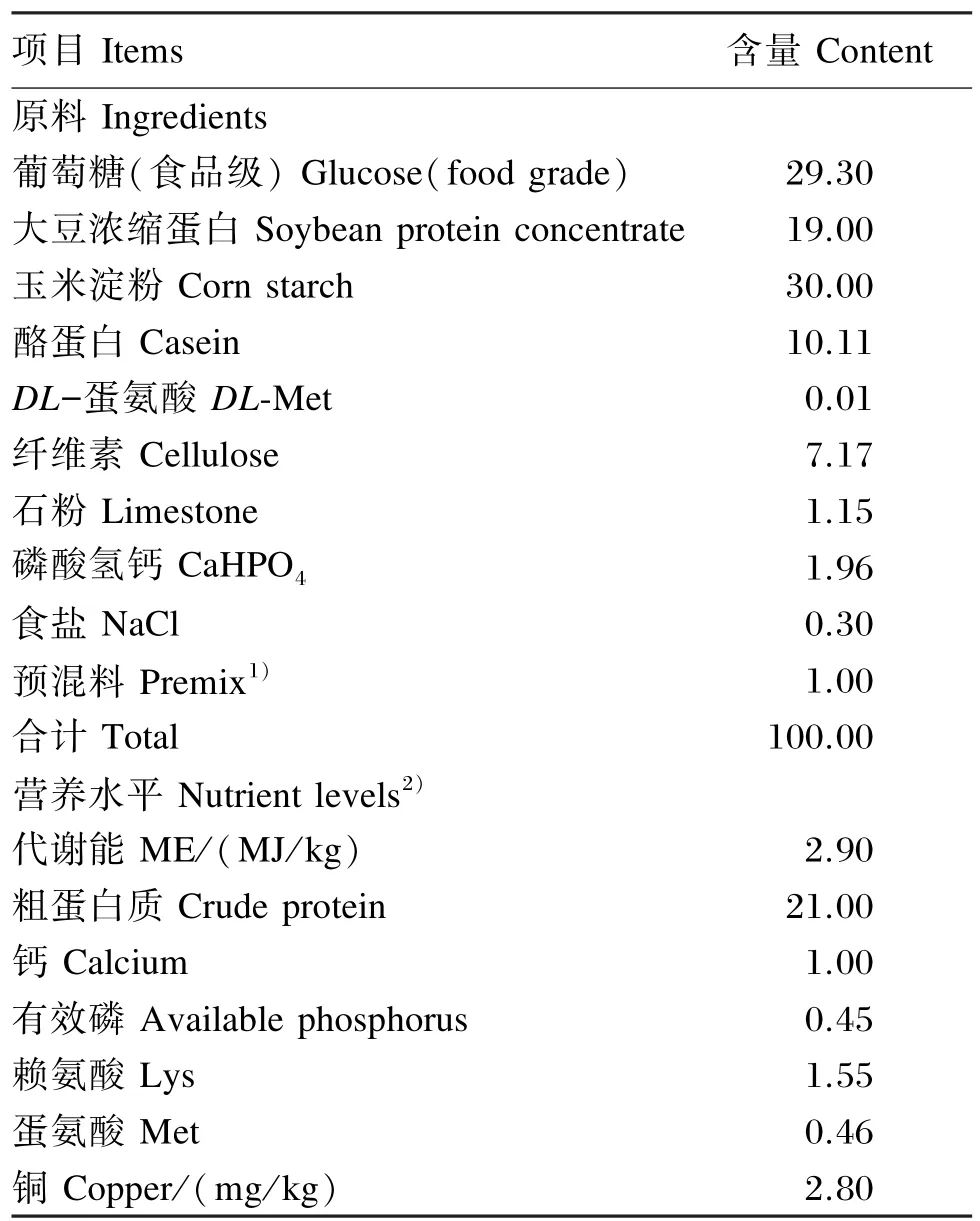
表1 基础饲粮组成与营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air⁃dry basis) %
1.3.2 生产性能指标
在试验结束前1天22:00断料供水,于次日08:00以重复为单位称鸡空腹重、计算每个重复剩余饲料,计算平均日增重、平均日采食量和料重比,记录死亡数,计算死亡率。
1.3.3 免疫器官指数
免疫器官(脾脏、胸腺、法氏囊)指数(%)=(免疫器官的重量/屠体重)×100。
1.3.4 血清生化指标
血清中过氧化产物丙二醛(malondialdehyde,MDA)含量、铜锌超氧化物歧化酶(CuZn⁃superox⁃ide dismutase,CuZnSOD)活性采用在紫外可见光分光光度仪(Biomate-5型,热电公司,美国)测定;血清中铜蓝蛋白(ceruloplasmin,CP)活性用酶标仪(SprctrsaMax-5型,美国瓦里安公司)按照联大茴香胺法测定;血清铜含量采用火焰原子吸收光谱仪(SpectrAA-50/55型,美国瓦里安公司)测定,操作步骤为:取200 μL血清于100 mL烧杯中,加5 mL浓硝酸(优级纯),盖上表面皿,置于电热板上消煮至澄清透明,待消煮过的样品冷却后用去离子水定容至10 mL,摇匀后测定铜含量。以上所用的分析试剂盒均购自南京建成生物工程研究所,样品处理方法按照试剂盒说明书步骤操作。
1.3.5 肝脏生化指标
肝脏MDA含量、CuZnSOD活性以及肝脏中铜含量的测定同血清中的测定方法。肝脏中金属硫蛋白(metallothionein,MT)含量用酶标仪(Sprc⁃trsaMax-5型,美国瓦里安公司)按照镉血红蛋白亲和力分析法测定[11];以上所用的分析试剂盒均购自南京建成生物工程研究所,样品处理方法按照试剂盒说明书步骤操作。
1.4 数据处理与统计统计
试验数据采用SAS 8.2软件的GLM程序进行方差分析,在差异显著的基础上再进行Duncan氏法多重比较以及线性(linear)和二次曲线(quad⁃ratic)趋势分析,统计显著性水平为P<0.05,极显著性水平为P<0.01。各组试验数据均以平均值±标准误(means±SE)或平均值表示。对相关敏感指根据数据特征选择拟合线性和二次曲线等不同的数学模型,然后根据拟合度选择拟合最佳的模型,用以确定黄羽肉鸡铜需要量。
2 结果与分析
2.1 饲粮铜添加水平对1~21日龄黄羽肉鸡生长性能的影响
由表2可知,饲粮添加不同水平铜对末重、平均日增重和料重比没有显著影响(P>0.05);4、64 mg/kg组试鸡平均日采食量显著高于其他组(P<0.05)。

表2 饲粮铜添加水平对1~21日龄黄羽肉鸡生长性能的影响Table 2 Effects of dietary copper supplemental level on growth performance of yellow⁃feathered broilers aged from 1 to 21 days
2.2 饲粮铜添加水平对21日龄黄羽肉鸡免疫器官的影响
由表3可知,饲粮添加不同水平铜对胸腺和脾脏指数没有显著影响(P>0.05);与对照组相比,饲粮添加8 mg/kg铜显著提高法氏囊指数(P<0.05),而其他组则差异不显著(P>0.05)。
2.3 饲粮铜添加水平对21日龄黄羽肉鸡血清、肝脏铜含量的影响
由表4可知,16、32和64 mg/kg组试鸡血清中铜的含量显著低于对照组和4、8 mg/kg组(P<0.05),其他组比较则差异不显著(P>0.05);饲粮添加不同水平铜对试鸡肝脏中铜含量没有显著影响(P>0.05)。

表3 饲粮铜添加水平对21日龄黄羽肉鸡免疫器官指数的影响Table 3 Effects of dietary copper supplemental level on immune organ indexes of yellow⁃feathered broilers at 21 days of age %
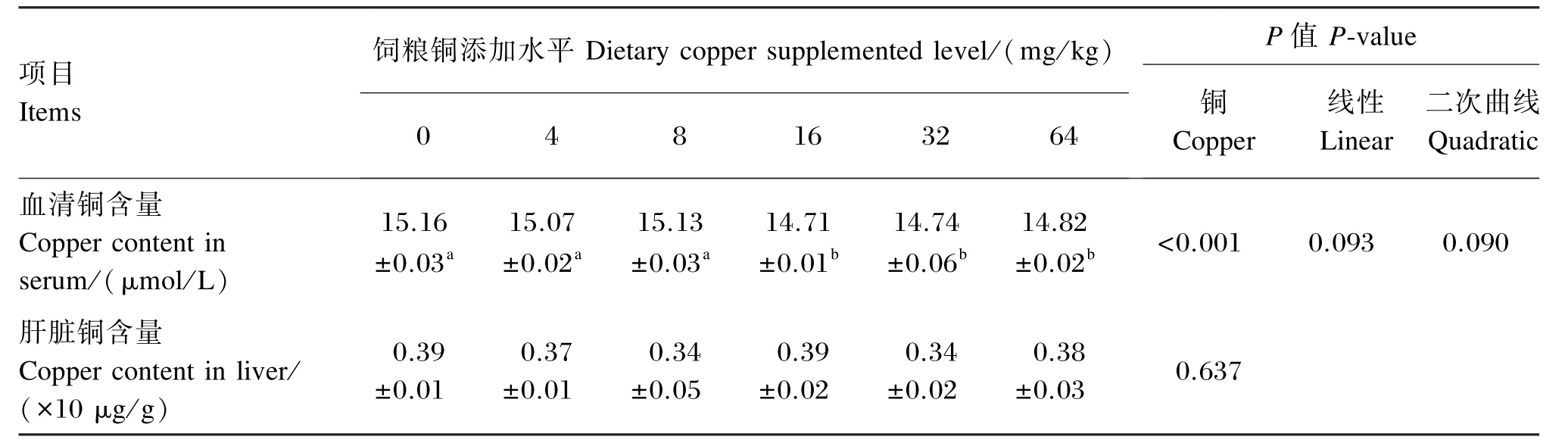
表4 饲粮铜添加水平对21日龄黄羽肉公鸡血清铜和肝脏铜含量的影响Table 4 Effects of dietary copper supplemental level on copper content in serum and liver of yellow⁃feathered broilers at 21 days of age
2.4 饲粮铜添加水平对63日龄黄羽肉鸡血清、肝脏抗氧化指标的影响
由表5可知,与对照组相比,饲粮铜添加水平对血清MDA含量的影响不显著(P>0.05);16、32 和64 mg/kg组试鸡血清CuZnSOD活性显著高于对照组和4 mg/kg组(P<0.05),并且8 mg/kg组也显著高于对照组(P<0.05),而其他组比较则差异不显著(P>0.05);16、32、64 mg/kg组试鸡血清CP活性显著低于对照组和4、8 mg/kg组(P<0.05),并且32和64 mg/kg组试鸡血清CP活性显著高于16 mg/kg组(P<0.05),而与其他组比较则差异不显著(P>0.05)。饲粮添加不同水平铜对肝脏中MDA和MT的含量影响不显著(P>0.05);8、16、32和64 mg/kg组试鸡肝脏中CuZnSOD活性显著高于对照组和4 mg/kg组(P<0.05),而其他组比较则差异不显著(P>0.05)。
2.5 对1~21日龄黄羽肉鸡敏感指标的多项式拟合结果
趋势分析表明,随饲粮铜水平的升高,试鸡血清和肝脏CuZnSOD活性初步判断与Baker等[12]和Robbins等[13]方法描述的曲线大致相符,运用SAS软件的NLIN程序建立二次曲线方程(Y=A1X2+B1X+C1,X<X0;Y=A1X20+B1X0+C1,X≥X0。式中:Y代表血清或肝脏CuZnSOD活性;X代表饲粮铜水平;A1和B1分别代表方程二次项和一次项的系数;C1代表方程的常数项;X0代表拐点所对应的饲粮铜水平,即为黄羽肉鸡铜需要量)与单斜率折线性方程(Y=A2X+B2,X<X0;Y=A2X0+B2,X≥X0。式中:Y代表血清或肝脏CuZnSOD活性;X代表饲粮铜水平;A2代表斜率;B2代表截距;X0代表拐点所对应的饲粮铜水平,即为黄羽肉鸡铜需要量)。本试验研究表明,总体上试鸡血清中CuZnSOD活性随饲粮铜水平升高呈线性上升变化(P<0.05),但上升变化主要集中在2.80~10.80 mg/kg铜水平,而18.80~64.80 mg/kg铜水平可视为平台期。非线性回归模型建立饲粮铜水平与血清中CuZnSOD活性之间的二次曲线方程(方程1)和单斜率折线方程(方程2),其中X代表饲粮铜水平,Y代表血清CuZnSO活性。方程1:Y=72.2423+3.1441X-0.0808X2,X<19.46;Y= 93.839,X≥19.46(R2=0.954 2,P=0.009 8)。方程2:Y=74.797 7+2.092 5X,X<13.38;Y=102.8,X≥13.38(R2=0.965 3,P=0.006 4)。但是肝脏CuZnSOD活性拟合的结果是差异不显著(P>0.05)(表3)。

表5 饲粮铜添加水平对21日龄黄羽肉鸡血清、肝脏抗氧化指标的影响Table 5 Effects of dietary copper supplemental level on antioxidant indexes in serum and liver of yellow⁃feathered broilers at 21 days of age
CP活性、血清铜含量、法氏囊指数数据分布初步符合Coma等[14]二次曲线和Robbins等[13]分段线性回归的方法的描述的分布,运用SAS软件的REG和NLIN程序分别建立二次曲线方程{Y=A3X2+B3X+C3。式中:Y代表血清CP活性或血清铜含量或法氏囊指数;X代表饲粮铜水平;A3和B3分别代表方程二次项和一次项的系数;C3代表方程的常数项;二次曲线的最高点对应的横坐标乘以矫正系数[即(-B3/2A3)×矫正系数]即为饲粮铜最适水平}、双斜率折线方程[Y=L+U×(XX0),X<X0;Y=L+V×(X0-X),X≥X0。式中:Y代表血清CP活性或血清铜含量或法氏囊指数;X代表饲粮铜水平;L代表拐点所对应的纵坐标值,即血清CP活性或血清铜含量或法氏囊指数;X0代表拐点所对应的横坐标即饲粮适宜铜需要量;U代表X<X0时的斜率;V代表X≥X0时的斜率]。但是程序运行结果显示血清CP活性或血清铜含量或法氏囊指数拟合结果差异都不显著(P>0.05)(表3、表4、表5),说明不适合用这2种曲线估测铜需要量。
3 讨 论
3.1 饲粮铜添加水平对1~21日龄黄羽肉鸡生长性能的影响
大量研究表明,饲粮中添加适宜的铜水平可以提高采食量、平均日增重和降低肉鸡料重比[4,9,15-16]。本试验结果表明,在0~32 mg/kg铜添加范围内,添加4 mg/kg铜时能显著肉鸡平均日采食量,这也与前面研究的结论一致。但是当饲粮添加铜水平为64 mg/kg(总铜水平66.8 mg/kg)时,肉鸡的平均日采食量也显著提高。有研究表明,饲粮高铜通过刺激神经肤激素从猪下丘脑的分泌,进而引起猪采食量增加[17-18],并且鸡与哺乳动物一样,禽类脑部也含有神经肽Y(neuro peptide Y,NPY)[19],因此64 mg/kg铜能促进肉鸡平均日采食量增加,可能是因为64 mg/kg铜属于高剂量范围,能够刺激神经肽Y的分泌,从而提高了平均日采食量。但是饲粮铜水平对平均日增重和料重比无显著影响,且肉鸡在试验期间生长和健康状况正常,说明基础饲粮中铜的含量(2.80 mg/kg)在该试验条件下能满足肉鸡生长。但是由于小鸡孵化过程后要继续吸收卵黄囊中含有的营养,并且动物在低铜条件下肝脏对铜等有蓄积作用[20],故鸡在低铜条件下可能加强了对母源铜有蓄积作用,这种母源铜和饲粮中铜含量,保证了即使在低铜条件下也能满足鸡铜的需要,但是其机理还需要进一步研究,因此低铜条件下小鸡自身储存铜耗竭的研究以及种鸡饲粮铜添加水平对小鸡铜需要量的影响是下一步研究的重点。
3.2 饲粮铜添加水平对1~21日龄黄羽肉鸡免疫器官发育的影响
研究表明,饲粮铜含量在一定范围内能够促进雏鸡法氏囊的发育,但是铜含量过高则不同程度地抑制了雏鸡法氏囊的发育,导致雏鸡体液免疫功能受损[21],并且低铜或高铜可使肉鸡胸腺、脾脏和法氏囊不同程度地萎缩,从而影响细胞免疫和体液免疫[22]。本试验研究表明,饲粮添加铜对脾脏和胸腺指数没有显著影响,但是8 mg/kg铜水平下法氏囊指数显著增加,说明此铜水平能促进肉鸡法氏囊的早期生长发育,这与上述的研究饲粮铜在一定范围内促进法氏囊发育一致,而对脾脏和胸腺发育无影响,但是具体机理需要进一步研究。
3.3 饲粮铜添加水平对1~21日龄黄羽肉鸡血清、肝脏铜含量的影响
研究表明,随着饲粮中铜水平的升高,血清中铜的含量增高[23-26]。但是本试验结果表明,随着饲粮中铜水平的升高,血清中铜的含量却显著降低。有研究表明,肝细胞内质网中合成的脱铜CP与吸收肝脏中的铜离子结合形成血浆CP,随后被分泌入血浆,生成铜离子[7,27],并且血浆中铜离子主要是由血浆中75%~95%铜以非扩散状态储存于CP中,而5%呈可透析状态通过肠黏膜绒毛顶端的转移(载体)是将铜从肠腔转移到肠黏膜表层细胞内然后再通过载体运输到肝脏的,在肝脏中掺入CP后经唾液酸结合,最后释入血液循环[7,28]。并且研究表明进入细胞内的铜和细胞铜蛋白遍布各细胞器和胞液,25%~50%铜分布于胞液,其中还原型谷胱甘肽(GSH)将铜运输到不同细胞器及新合成的超氧化物歧化酶(SOD)、MT和CP储存在细胞中[28]。因此,在肝中的铜也主要是以游离铜、铜蛋白的形式储存在肝细胞中。本试验研究结果可知,饲粮铜的添加水平超过16 mg/kg后CP显著降低,由于饲粮铜添加水平对肝脏铜含量差异不显著,所以血浆中CP可能和血清铜含量有一定联系;并且饲粮铜水平达到16 mg/kg时血清铜确实显著降低,证实了以上推论,但是具体机理还需要进一步研究论证。
肝脏是体内铜的重要贮存和代谢器官,肝脏铜离子含量能反映体内铜的状态[2,24,29]。研究表明随饲粮铜水平提高,肝脏铜离子含量增加[2,29-31],但是本试验结果表明随着饲料铜水平的提高,肝脏铜离子含量并不增加。也有研究表明,临界缺乏的低铜状态下机体能通过加强肝脏铜离子的蓄积以平衡或满足铜的需要[20],在高铜条件下,肝脏铜离子的蓄积量在达到饱和之前时一定剂量和时间范围内的饲粮高铜能有效地促进肝脏铜离子的蓄积,使肝脏对铜的蓄积量都保持在动态平衡状态[31-32]。本试验结果表明,饲粮铜水平对肝脏铜离子含量差异不显著,只有当肝脏铜离子的蓄积量达到饱和时,继续增加饲粮铜含量则导致肝脏铜离子迅速大量地释放;因此说明黄羽肉鸡在肝脏铜离子的蓄积量在未达到饱和时,肝脏铜离子可能处于动态平衡中,肝脏铜离子含量始终未变,其中具体的机理还需要进一步研究与验证。
3.4 饲粮铜添加水平对1~21日龄黄羽肉鸡抗氧化性能的影响
铜的生理功能之一是抗氧化作用,铜能参与到抗氧化防御系统中,影响自由基和改变抗氧化酶与底物的状态,铜严重缺乏或过量都会引起病变,包括许多血浆和组织中含铜酶活性等生化指标的显著变化[33]。
CuZnSOD是最常见的抗氧化酶之一,也是机体内超氧自由基的主要清除剂,对于维持生物膜的完整性、机体免疫功能、动物健康都有非常重要的作用。在调节CuZnSOD活性中铜较锌起着更主要的作用,铜作为CuZnSOD的辅助因子。Dameron等[34]报道幼年生长动物主动脉中的CuZnSOD活性受到饲粮中铜水平的调节,当动物饲粮缺铜时,可降低其许多组织中CuZnSOD的活性[35],并且CuZnSOD活性随饲粮铜水平的升高显著提高[36]。本研究饲粮添加不同水平铜显著提高了血清和肝脏里CuZnSOD的活性,这与上述结果一致。
CP可作为超氧阴离子的清除剂,能抑制通过黄嘌呤氧化酶调节的正铁细胞色素C的还原作用,以减少此过程中诱发的超氧阴离子自由基的生成,具有类似CuZnSOD的作用[37],CP主要由肝脏合成,然后随血液循环在身体各处发挥作用[38]。许多研究所证实,饲料中添加铜可提高CP的活性[39-40];但也有研究表明CP活性随饲粮铜水平的增加而升高,但当饲粮铜达到一定水平(过量)时,CP活性显著下降[41-44]。本试验结果表明,与对照组相比,随着饲粮中铜水平升高未出现铜CP的活性显著升高的情况,反而在达到铜水平达到18.74 mg/kg后CP活性显著下降,说明可能铜已经过量,这也与何霆等[45]的研究结果一致,但是具体的机理还需要进一步研究与验证。
MT在体内主要与铜和锌结合,组织中MT含量受锌和铜状态的影响,当锌水平稳定时,铜的摄取速度超过了细胞内铜的清除能力而发生铜沉积时,将诱导大量MT合成,而铜缺乏时,肝脏MT的代谢也会发生改变[46]。本试验研究表明,饲粮不同水平铜对试鸡肝脏中MT的含量无显著影响,这可能是由于动物机体内铜摄取速度和细胞内铜的清除能力能保持了动态平衡[47],从而使肝脏中的MT含量没有显著变化,但是具体的机理还需要进一步研究与验证。
MDA是脂质过氧化降解的主要产物,其含量反映了体内脂质过氧化的氧化程度及细胞受自由基攻击的程度。测定MDA的含量可反映机体内脂质过氧化强弱,间接反映机体氧化损伤的程度[48-49]。本试验结果表明,饲粮中不同水平的铜对血清和肝脏中MDA含量也无显著影响,说明血清和肝脏中的脂质过氧化物的生成量在该铜水平范围内较稳定。
3.5 黄羽肉鸡铜需要量的探讨
研究畜禽营养素需要量的方法多种多样,传统营养学上常采用剂量反应法研究畜禽营养素需要量,但随着统计知识和SAS软件的开发应用,越来越多的学者采用建立合适的数学模型的方法来描述和预测畜禽对营养素的需要量和反映[12-14]。评定营养需要量的时,随着饲粮铜水平的增加,反映指标要达到一个平台期,即不再有显著意义上的增加或降低[50]。根据这一定义,本试验适宜评价铜营养需要量的指标为血清和肝脏中CuZnSOD活性和血清CP活性。本试验通过方差分析、多重比较的结果,以平均日采食量、血清和肝脏中CuZnSOD活性适宜作为评价指标,1~21日龄黄羽肉公鸡铜需要量分别为6.80和10.80 mg/kg;根据拟合结果可知,血清CuZnSOD活性的单斜率折线方程的回归系数R2大于方程2的R2,说明方程2拟合度优于方程1,即饲粮铜水平低于13.38 mg/kg时,血清中CuZnSOD活性随铜水平升高而升高,饲粮中铜水平为13.38 mg/kg时,试鸡血清中CuZnSOD活性达到平台期,即1~21日龄试鸡铜需要量为13.38 mg/kg。
国内外有关肉鸡的铜需要量的大部分接近于NRC(1994)[2]和《鸡饲养标准》(NY/T 33—2004)[1]的推荐量(8 mg/kg),《美国饲料周刊》(Feedstuffs)的推荐标准是11 mg/kg[3]。从本试验结果来看,1~21日龄黄羽肉鸡获得最佳生长性能和免疫器官发育、抗氧化功能的铜需要量为10.80 mg/kg,通过非线性回归模型以血清中CuZnSOD活性估测的饲粮铜需要量分别为13.38 mg/kg,都高于NRC(1994)和黄羽肉鸡饲养标准(2004)的推荐量(8 mg/kg);有研究表明,黑色素和褐色素的相对数量与分布决定了动物被毛表现出从白至黑多种毛色[51],其中起最重要作用的就是酪氨酸酶,铜含量的多少直接影响酪氨酸酶的活性,并且酪氨酸酶能氧化酪氨酸形成黑色素和形成褐色素的前体物质,进而影响毛色[52-53];由于黄羽肉鸡羽毛比白羽肉鸡羽毛色素沉积更多,这就有可能需要更多的酪氨酸酶,所以可能就表现出黄羽肉鸡比白羽肉鸡铜需要量高;其次NRC选用以生产性能为评价指标,而本试验以生产性能和抗氧化性能为评价指标;这种评判指标不同也能造成需要量差异。正是由于这种鸡的品种和评价指标不同,才产生了本研究高于NRC (1994)[2]和《鸡饲养标准》(NY/T 33—2004)[1]的推荐量(8 mg/kg)的结果;但是具体机理还需要进一步研究。因此,生产中应根据鸡的品种和评判指标对肉鸡铜添加水平做适当调整。
4 结 论
①饲粮中添加适宜水平的铜可改善1~21日龄黄羽肉鸡采食量、提高抗氧化性能、免疫器官发育。
②在本试验条件下,以生长性能和抗氧化性能为评定指标,1~21日龄快大型黄羽肉鸡铜需要量为10.80 mg/kg;而通过非线性回归模型以血清中CuZnSOD活性估测的铜需要量为13.38 mg/kg。
参考文献:
[1] 中华人民共和国农业部.NY/T 33—2004鸡饲养标准[S].北京:中国农业出版社,2004.
[2] NRC.Nutrient requirements of poultry[S].9th ed.Washington,D.C.:National Academy Press,1994.
[3] WALDROUP P W.Dietary nutrient allowances for chickens and turkeys[J].Feedstuffs,1990,62(31):74-82.
[4] 周桂莲,韩友文,杜忠亮.肉仔鸡铜需要量的研究[J].动物营养学报,1996,8(4):6-14.
[5] 古少鹏,郑明学,李宝钧,等.铜和维生素A及其互作效应对肉鸡免疫功能的影响[J].中国生态农业学报,2011,19(1):135-140.
[6] 李红雪,吕林,计成,等.不同铜源和铜水平对肉仔鸡前期生长性能和组织中维生素E氧化稳定性的影响[J].中国畜牧杂志,2010,46(17):58-61.
[7] AJUWON O R,IDOWU O M O,AFOLABI S A,et al.The effects of dietary copper supplementation on oxidative and antioxidant systems in broiler chickens [J].Archivos de Zootecnia,2011,60(230):275-282.
[8] 姜云霞.微量元素铜的研究进展及其对动物健康的影响[J].微量元素与健康研究,2007,24(5):58-61.
[9] 吕武兴.肉仔鸡微量矿物元素营养研究进展[J].湖南畜牧兽医,2004(2):1-3.
[10] OKONKWO A C,KU P K,MILLER E R,et al.Cop⁃per requirement of baby pigs fed purified diets[J].The Journal of Nutrition,1979,109(6):939-948.
[11] CAO J,HENRY P R,GUO R,et al.Chemical charac⁃teristics and relative bioavailability of supplemental or⁃ganic zinc sources for poultry and ruminants[J].Jour⁃nal of Animal Science,2000,78(8):2039-2054.
[12] BAKER D H,KATZ R S,EASTER R A.Lysine re⁃quirement of growing pigs at two levels of dietary pro⁃tein[J].Journal of Animal Science,1975,40(5):851-856.
[13] ROBBINS K R,SAXTON A M,SOUTHERN L.Esti⁃mation of nutrient requirements using broken⁃line re⁃gression analysis[J].Journal of Animal Science,2006,84(13S):E155-E165.
[14] COMA J,CARRION D,ZIMMERMAN D R.Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J].Journal of Animal Science,1995,73(2):472-481.
[15] 常新耀,王翠.日粮中添加铜对肉仔鸡生产性能的影响[J].饲料工业,2007,28(20):39-41.
[16] 张春善,高林青,宋金昌,等.铜和维生素A及互作效应对肉仔鸡生产性能及理化指标的影响[J].畜牧兽医学报,2006,37(9):940-945.
[17] 顾有方.日粮高铜可提高猪的采食量[J].国外畜牧科技,1995,22(2):18-19.
[18] PAU K Y F,KHORRAM O,KAYNARD A H,et al.Simultaneous induction of neuropeptide Y and gona⁃dotropin⁃releasing hormone release in the rabbit hypo⁃thalamus[J].Neuroendocrinology,1989,49(2):197-201.
[19] 黄金秀,吕林,张亿一,等.禽类采食量生理调节因子的研究进展[J].动物营养学报,2006,18(增刊):353-360.
[20] 刘选珍,李鸣,黄承钰,等.大鼠铜营养状况生化评价指标的筛选[J].卫生研究,2007,36(3):385-386.
[21] 徐之勇,崔恒敏,彭西,等.日粮高铜对雏鸡法氏囊影响的研究[J].畜牧兽医学报,2008,39(5):658-664.
[22] 赵德明,方文军,张日俊,等.铜缺乏对肉鸡淋巴组织器官发育的影响[J].中国兽医科技,1996,26(6):13-14.
[23] 张苏江,刘国文,王哲.饲料铜水平对生长猪血清铜、血清锌和血清铁的影响[J].畜牧兽医杂志,2003,22(1):1-3.
[24] 王明根,张明,徐济梅,等.日粮中添加铜对小鼠血清和肝脏中铜、锌、锰的影响[J].安徽技术师范学院学报,2005,19(1):8-10.
[25] 王建明,孙奕南,谢璋琪.生长猪饲料添加中等剂量铜的可能性探讨[J].广东饲料,1999(3):17-18.
[26] 钱莘莘,梅光芝,郭萍,等.生长肥育猪日粮中添加高铜和超高铜对其肉、肝中铜元素的影响[J].饲料工业,1997,18(7):10-11.
[27] SONG Z J,ZHU L X,ZHAO T,et al.Effect of copper on plasma ceruloplasmin and antioxidant ability in broiler chickens challenged by lipopolysaccharide[J].Asian⁃Australasian Journal of Animal Sciences,2009,22(10):1400-1406.
[28] CARRI M T,GALIAZZO F,CIRIOLO M R,et al.Ev⁃idence for co⁃regulation of Cu,Zn superoxide dis⁃mutase and metallothionein gene expression in yeast through transcriptional control by copper via the ACE 1 factor[J].FEBS Letters,1991,278(2):263-266.
[29] 张力,柳树青.日粮不同铜水平对生长猪组织器官矿物元素和血液生化指标的影响[J].福建农业大学学报,1994,23(2):196-198.
[30] 钱剑,王哲,刘国文.铜在动物体内代谢的研究进展[J].动物医学进展,2003,24(2):55-57.
[31] 王学智,杨志强,马伟,等.小白鼠肝脏微量元素与日粮铜含量变化的动态关系研究[J].中兽医医药杂志,2002(3):12-14.
[32] 罗文丽,陈代文,余冰,等.不同铜源对大鼠生长性能及组织中铜含量和血清中抗氧化酶活性的影响[J].中国畜牧杂志,2009,45(23):26-29.
[33] PROHASKA J R.Responses of rat cuproenzymes to variable dietary copper[J].The Journal of Nutritional Biochemistry,1997,8(6):316-321.
[34] DAMERON C T,HARRIS E D.Regulation of aortic CuZn⁃superoxide dismutase with copper.Caeruloplas⁃min and albumin reactivate and transfer copper to the enzyme in culture[J].Biochemical Journal,1987,248 (3):669-675.
[35] KLEVAY L M,SAARI J T.Comparative responses of rats to different copper intakes and modes of supple⁃mentation[C]//Proceedings of the Society for Exper⁃imental Biology and Medicine:Society for Experimen⁃tal Biology and Medicine.New York:Royal Society of Medicine,1993,203(2):214-220.
[36] 张苏江,张光圣,王哲,等.猪饲料铜水平对血清酶活性的影响[J].动物科学与动物医学,2002,19(8):16-19.
[37] 季红光,王恩美,谢天培.缺铜对大鼠自由基防御系统酶组分和血清溶血素的影响[J].营养学报,1990,12(2):146-157.
[38] 常彦忠,钱忠明.铜蓝蛋白与脑铁代谢[J].生理科学进展,2002,33(2):101-105.
[39] LAURIDSEN C,HØJSGAARD S,SØRENSEN M T. Influence of dietary rapeseed oil,vitamin E,and cop⁃per on the performance and the antioxidative and oxi⁃dative status of pigs[J].Journal of Animal Science,1999,77(4):906-916.
[40] HILL G M,LINK J E,MEYER L,et al.Effect of vita⁃min E and selenium on iron utilization in neonatal pigs [J].Journal of Animal Science,1999,77(7):1762-1768.
[41] 张彩英,胡国良,曹华斌,等.饲粮铜添加水平对育成蛋鸡免疫功能和抗氧化酶活性的影响[J].动物营养学报,2011,23(1):154-161.
[42] 赵丽,杨帆,彭西,等.高铜对雏鸭抗氧化酶活性的影响[J].中国兽医学报,2009,29(2):210-213.
[43] TURNLUND J R,DOMEK J M,NAIR P P,et al.Copper retention in intestinal mucosal cells of young men at normal and high copper intakes[J].The Jour⁃nal of Trace Elements in Experimental Medicine,2003,16(2/3):105-108.
[44] 姜俊芳,张春善,贾春燕,等.铁与维生素A及其互作效应对肉仔鸡的生产性能、铁、铜、锰、锌表观存留率的影响[J].动物营养学报,2003,15(1):31-37.
[45] 何霆,刘汉林,梁琳,等.肉用仔鸡的饲粮铜水平[J].广东畜牧兽医科技,1994,19(2):1-3,18.
[46] 刘选珍.大鼠铜缺乏和过量敏感指标筛选及铜锌生物效应[D].博士学位论文.成都:四川大学,2007.
[47] COUSINS R J.Absorption,transport,and hepatic me⁃tabolism of copper and zinc:special reference to met⁃allothionein and ceruloplasmin[J].Physiological Re⁃views,1985,65(2):238-309.
[48] CLIMKO R P,ROEHRICH H,SWEENEY D R,et al.Ecstacy:a review of MDMA and MDA[J].The Inter⁃national Journal of Psychiatry in Medicine,1986,16 (4):359-372.
[49] 胡锴,任常宝,颜城,等.高铜日粮对肉鸡肝脏抗氧化功能的影响[J].中国家禽,2011,33(12):12-15.
[50] WEDEKIND K J,YU S,COMBS G F.The selenium requirement of the puppy[J].Journal of Animal Phys⁃iology and Animal Nutrition,2004,88(9/10):340-347.
[51] 李影球,张国良,夏中生.营养与优质鸡羽色异常[J].中国畜禽种业,2007,3(8):42-44.
[52] 李继兴.铜对卡拉库尔羊毛色影响的研究[D].硕士学位论文.阿拉尔:塔里木大学,2012.
[53] 角根琴,李新荣.猪铜离子中毒和高致病性猪蓝耳病的鉴别诊治[J].畜禽业,2008(7):58-59.
(责任编辑 陈 燕)
Copper Requirement of Yellow⁃Feathered Broilers Aged from 1 to 21 Days
LI Long JIANG Shouqun∗ZHENG Chuntian GOU Zhongyong CHEN Fang RUAN Dong YU Deqian
(The Key Laboratory of Animal Nutrition and Feed Science(South China)of Ministry of Agriculture,State Key Laboratory of Livestock and Poultry Breeding,Guangdong Public Laboratory of Animal Breeding and Nutrition,Guangdong Key Laboratory of Animal Breeding and Nutrition,Institute of Animal Science,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
∗Corresponding author,professor,E⁃mail:jsqun3100@sohu.com
Abstract:This experiment was conducted to investigate the effects of dietary copper supplemental level on growth performance,immune organ development,antioxidative property,copper content in serum and liver of yellow⁃feathered broilers etc.,then to estimate the dietary copper requirement of yellow⁃feathered broilers aged from 1 to 21 days.A total of 1 440 twenty⁃two days old healthy,well⁃developmental,fast large male Lingnan yellow⁃feathered broilers were randomly assigned to six groups.Each group consisted of six replicates with 40 birds per replicate.Diets of these groups included the purified basal diet supplemented with different levels of copper to ensure dietary copper levels up to 2.80(control),6.80,10.80,18.80,34.80,66.80 mg/kg,re⁃spectively.The contents of other nutrients in diets were consistent.The experiment lasted for 21 days.Results showed as follows:under the experiment condition,1)the average daily feed intake of broilers in 4,64 mg/kg groups were significantly higher than those in the other groups(P<0.05),but there were no signifi⁃cant differences in the final weight,average daily gain,ratio of feed to gain among all groups(P>0.05).2)Compared with the control group,diet supplemented with 8 mg/kg copper significantly improved index of bur⁃sa of Fabricius(P<0.05),but copper supplemental level did not significantly affect the spleen and thymus in⁃dexes(P>0.05).3)The CuZn⁃superoxide dismutase(CuZnSOD)activity in serum and liver in 8,16,32 and 64 mg/kg groups was significantly higher than that in the control group(P<0.05).Dietary copper supple⁃mental level did not significantly affect the content of malondialdehyde in serum and liver of broilers(P>0.05).Diet supplemented with 16,32 and 64 mg/kg copper significantly decreased the ceruloplasmin activity in serum(P<0.05).4)Compared with the control group,diet supplemented with 16,32 and 64 mg/kg cop⁃per significantly decreased the copper content in serum(P<0.05).But copper supplemental level had no sig⁃nificant effects on the contents of copper and metallothionein in liver(P>0.05).In conclusion,base on the growth performance,immune organ development and antioxidative property,the fitting dietary supplemental copper level of yellow⁃feathered broilers aged from 1 to 21 days is 8 mg/kg,base of 2.80 mg/kg of the copper content in the basal diet,copper requirement of yellow⁃feathered broilers at this phase is 10.80 mg/kg.Base on the estimated result by nonlinear regression analysis,the copper requirement of yellow⁃feather broilers aged from 1 to 21 days is 13.38 mg/kg.[Chinese Journal of Animal Nutrition,2015,27(2):578⁃587]
Key words:yellow⁃feathered broilers;copper;requirement;growth performance;antioxidative property

