鹅血红素对患缺铁性贫血症幼龄大鼠生长发育、铁代谢和器官组织元素分布的影响
解 超 王宝维葛文华 张名爱 徐晓波 岳 斌(青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109)
鹅血红素对患缺铁性贫血症幼龄大鼠生长发育、铁代谢和器官组织元素分布的影响
解 超 王宝维∗葛文华 张名爱 徐晓波 岳 斌
(青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109)
摘 要:本试验旨在研究不同水平鹅血红素对患缺铁性贫血症(IDA)3~7周龄大鼠生长发育、铁代谢及其器官组织元素(铁、铜、锰、锌、硒)分布的干预修复作用,以确定鹅血红素的使用效果和适宜补充量。选取同期受孕母鼠开始造模,模型组孕鼠受孕15 d后,开始饲喂低铁饲粮,持续至哺乳期结束(分娩后21 d),IDA模型建成后选取3周龄大鼠180只,随机分为5组(每组6个重复,每个重复6只),即:缺铁组、FeSO4组、低剂量组、中剂量组、高剂量组,各组分别每天灌注去离子水10 mL/kg BW,1%FeSO410 mL/kg BW和鹅血红素0.11、0.22、0.33 g/kg BW,均饲喂低铁饲粮。正常组自孕期开始一直饲喂基础标准对照饲粮。试验期28 d。结果表明:1)高剂量组幼龄大鼠的平均日增重、末重、器官指数(除心脏指数)与正常组无显差异著(P>0.05)。与缺铁组相比较,高剂量组幼龄大鼠血液中血红蛋白含量、红细胞数、红细胞压积、平均红细胞体积、血清铁、转铁蛋白饱和度显著或极显著升高(P<0.05或P<0.01),红细胞分布宽度和总铁结合力显著或极显著降低(P<0.05或P<0.01),大鼠心脏铁、铜、锌含量显著升高(P<0.05),肝脏铜、锰含量显著或极显著降低(P<0.05或P<0.01)。2)FeSO4溶液作为补铁剂长期服用对幼龄大鼠缺铁模型的干预效果不明显。由此可见,鹅血红素摄入量为0.33 g/kg BW时能有效干预IDA幼龄大鼠的生长发育和造血能力,并能调控幼龄大鼠各器官组织内的元素分布趋于正常,效果优于FeSO4。
关键词:鹅血红素;幼龄大鼠;生长发育;血液指标;元素分布
铁缺乏是世界上最常见、覆盖率最高的营养缺乏症之一。铁缺乏直接造成缺铁性贫血症(iron deficiency anemia,IDA),不仅常见于幼龄动物,对育龄期妇女、婴幼儿和儿童也有同样影响。研究表明,孕中后期母体缺铁导致幼仔缺铁,并影响其生长发育。幼仔能更敏感的感受到组织内铁缺乏,因为他们的细胞增殖快,器官发育迅速。目前,国内外对于补铁剂的研究尚停留在化学药品,没能对生物铁进行深入系统研究,将鹅血红素用作补铁剂的技术还处于空白。为此,对该产品的开发利用具有重要科学意义和市场应用前景。血红素是一种生物铁,不刺激消化道而被肠道直接吸收,可长期服用,补铁效果明显。赵金香等[1]和张彬等[2]研究表明,有机铁较无机铁更能促进仔猪生长。田婷等[3]研究了大鼠IDA模型的建立,通过单纯的低铁饲粮喂养大鼠的方法,建立IDA模型。张义琼等[4]研究证明了IDA引起儿童的生长发育迟缓及造血机能下降。目前,用于治疗或预防IDA补铁剂常用硫酸亚铁、氯化亚铁、葡萄糖酸亚铁等,这些补铁剂虽然铁含量高,但体内利用率较低,毒副作用较大,且有特殊金属铁锈味,影响适口性,难以长期食用;另外,对于IDA的研究多采用成年大鼠模型,未有从母体怀孕期缺铁开始研究,且利用的血红素多从猪、牛血中提取;迄今为止,利用鹅血红素干预3~7周龄大鼠IDA模型的试验尚未见报道。因此,本试验通过建立幼龄大鼠IDA模型,利用鹅血红素作为试验材料,研究其对幼鼠机体铁代谢干预效果、规律与最佳补充量,为研发新型高效补铁产品提供理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
鹅血红素(本实验室提取,血红素含量20%,剩余成分为血红蛋白、肽和氨基酸,铁含量30 mg/g);食品级FeSO4(购自湖北金铭洲化学有限公司);缺铁饲粮及标准对照饲粮(南通特洛菲饲料科技有限公司提供:缺铁饲粮铁含量为12 mg/kg,标准对照饲粮铁含量为45 mg/kg);清洁级大鼠(购自青岛市药品检查所);去离子水;生理盐水;新洁尔灭;试验垫料(购自青岛木材厂)。
1.1.2 主要仪器
真空采血管(EDTA-K2,青岛新国医中医医院)、冷冻离心机(TGL-16G,上海安亭科学仪器厂)、超低温冰箱(MDF-U4086,日本三洋)、超级恒温水浴锅(DKB-501,上海精宏试验设备有限公司)、全自动生化分析仪(日立7600-020)、微量移液器(德国EPPENDORF)、全自动酶标仪Multi⁃skan MK3、电子天平(AR1140,奥豪斯国际贸易有限公司)、超声波清洗机(HS-600D,宁波市)、立式转齿胶体磨超微粉碎机(JTM120)、紫外可见分光光度计(UV-1100,上海美谱达仪器有限公司)、日立Z5000型原子吸收分光光度计、高压灭菌锅、制冰机、大鼠灌胃针、大鼠饲养专用笼具及饮水瓶(苏州市苏杭科技器材有限公司)、匀浆器等。
1.2 试验方法
试验选用清洁级健康SD大鼠,分2个阶段:IDA模型建立期和鹅血红素干预期。
1.2.1 怀孕大鼠IDA模型建立
选取同期怀孕雌性SD大鼠72只,分为IDA模型组和对照组,每组6个重复,每个重复6只。从孕中后期(即怀孕后15 d)开始试验,IDA模型组孕鼠开始饲喂低铁饲粮,对照组饲喂标准对照饲粮,试验持续至哺乳期结束(大鼠哺乳期为21 d)。试验期间,大鼠自由摄食、饮水(去离子水),室内温度(22±2)℃,相对湿度(55±5)%,室内通风良好。每天观察大鼠的精神状态,活动情况,每周称量1次体重。
造模结束后,在IDA模型组和对照组中随机抽样,禁食12 h后屠宰,取血,测定其生长指标和血液生化指标,判断造模效果。
1.2.2 鹅血红素干预幼龄大鼠IDA
在对照组怀孕大鼠所产幼龄大鼠中随机选取36只作为干预试验的正常组。在IDA模型组怀孕大鼠所产幼龄大鼠中选取180只随机分为5组(每组6个重复,每个重复6只),分别为缺铁组、FeSO4组、低剂量组、中剂量组、高剂量组,饲喂情况如表1所示。

表1 干预期大鼠分组饲喂情况Table 1 Group feeding situation during the trial intervention
试验期间,大鼠自由摄食、饮水(去离子水),室内温度(22±2)℃,相对湿度(55±5)%,室内通风良好。每天观察大鼠的精神状态,活动情况,记录摄食量,每周称量1次体重。
1.3 检测指标
试验期间为观察幼龄大鼠生长发育情况,每周测定并记录其体重、体长、表观特征和活动情况。鹅血红素干预试验至第28天时,对试验幼龄大鼠禁食12 h后,断颈动脉采血,用抗凝离心管收集全血,普通离心管收集血样后3 000 r/min离心15 min分离得血清。试验动物处死后立即解剖,测定心脏、肝脏、脾脏、肾脏的铁、铜、锌、锰、硒含量和器官指数。同时通过测定分析血液指标:血红蛋白含量(HGB)、红细胞数(RBC)、红细胞压积(HCT)、平均红细胞体积(MCV)、红细胞分布宽度(RDW⁃CV)、总铁结合力(TIBC)、血清铁含量(SI),通过转铁蛋白饱和度(TS)和不饱和铁结合力(UIBC)观察铁代谢的情况。
1.4 数据统计分析
试验数据以“平均值±标准差”表示,数据统计利用SPSS 18.0软件包中的平衡试验设计方差分析过程(ANOVA)进行,平均值的多重比较采用Duncan氏法进行。
2 结果与分析
2.1 低铁饲粮诱导幼龄大鼠IDA模型的建立
由表2可知,经过28 d的干预后,IDA模型组幼龄大鼠的体重、体长显著低于对照组(P<0.05),其全血铁指标(SI、TS、HGB和HCT)也显著下降(P<0.05)。结果表明,幼龄大鼠缺铁模型建立成功。

表2 低铁饲粮对幼龄大鼠生长及血液指标的影响Table 2 Effects of low⁃iron diet on growth and blood parameters of young rats
2.2 鹅血红素对幼龄大鼠生长发育的影响
2.2.1 鹅血红素对幼龄大鼠体重的影响
由表3可知,干预试验开始时,与缺铁组、FeSO4组相比,低、中、高剂量组幼龄大鼠的初重无显著差异(P>0.05),与正常组相比有显著差异(P<0.05);干预试验结束时,与正常组相比,缺铁组、FeSO4组、低剂量组幼龄大鼠末重有极显著差异(P<0.01),中剂量组有显著差异(P<0.05),高剂量组无显著差异(P>0.05);与缺铁组和FeSO4组相比,高剂量组幼龄大鼠体重极显著升高(P<0.01),中、低剂量组显著升高(P<0.05)。
结果表明,IDA幼龄大鼠生长缓慢,饲粮中补充鹅血红素对其有显著修复作用。

表3 鹅血红素对幼龄大鼠体重的影响Table 3 Effects of goose heme on body weight of young rat
2.2.2 鹅血红素对幼龄大鼠各器官指数的影响
由表4可知,各组幼龄大鼠的肝脏指数和肾脏指数均无显著差异(P>0.05)。与正常组相比较,缺铁组幼龄大鼠的心脏指数极显著升高(P<0.01),脾脏指数显著升高(P<0.05);FeSO4组、低剂量组和中剂量组幼龄大鼠的心脏指数和脾脏指数显著升高(P<0.05);高剂量组幼龄大鼠的心脏指数显著升高(P<0.05),脾脏指数无显著差异(P>0.05)。与缺铁组相比,高剂量组幼龄大鼠的心脏指数显著降低(P<0.05)。与FeSO4组相比,缺铁组、低剂量组、中剂量组和高剂量组幼龄大鼠的心脏指数和脾脏指数均无显著差异(P>0.05)。
结果表明,鹅血红素补充量为每日0.33 g/kg BW时能够在一定程度上降低幼龄大鼠的心脏指数和脾脏指数,使器官指数趋于正常组。

表4 鹅血红素对幼龄大鼠器官指数的影响Table 4 Effects of goose heme on organ indexes of young rat %
2.3 鹅血红素对幼龄大鼠铁代谢的影响
2.3.1 鹅血红素对幼龄大鼠血液常规指标的影响
由表5可知,与正常组相比较,缺铁组和FeSO4组幼龄大鼠血液中的HGB、RBC、HCT和MCV均显著或极显著降低(P<0.05或P<0.01),RDW⁃SD显著或极显著升高(P<0.05或P<0.01);低、中剂量组幼龄大鼠血液中的HCT、MCV和RBC均显著或极显著降低(P<0.05或P<0.01),RDW⁃SD显著升高(P<0.05);高剂量组的HGB、RBC、HCT和RDW⁃SD均无显著差异(P>0.05)。
与缺铁组相比较,FeSO4组幼龄大鼠血液中的HGB、RBC、HCT和MCV均无显著差异(P>0.05),RDW⁃SD显著降低(P<0.05);低剂量组幼龄大鼠血液中的RBC、HCT和MCV无显著差异(P>0.05),HGB极显著升高(P<0.01),RDW⁃SD显著降低(P<0.05);中剂量组幼龄大鼠血液中的RBC无显著差异(P>0.05),HGB、HCT、MCV显著或极显著升高(P<0.05或P<0.01),RDW⁃SD显著降低(P<0.05);高剂量组幼龄大鼠血液中的HGB、RBC、HCT和MCV显著或极显著升高(P<0.05或P<0.01),RDW⁃SD显著降低(P<0.05)。
与FeSO4组相比较,低剂量组幼龄大鼠血液中的RBC、HCT、MCV和RDW⁃SD均无显著差异(P>0.05);中剂量组幼龄大鼠血液中的RBC无显著差异(P>0.05),HGB、HCT和MCV均显著升高(P<0.05),RDW⁃SD无显著差异(P>0.05);高剂量组幼龄大鼠血液中的RBC无显著差异(P>0.05),HGB、HCT和MCV极显著升高(P<0.01),RDW⁃SD无显著差异(P>0.05)。
结果表明,鹅血红素补充量为每日0.33g/kg BW时能够显著或极显著提高缺铁幼龄大鼠血液中HGB、RBC、HCT和MCV,降低血液中RDW⁃SD。
2.3.2 鹅血红素对幼龄大鼠铁结合力的影响
由表6可知,与正常组相比较,缺铁组幼龄大鼠的TIBC和UIBC极显著升高(P<0.01),SI和TS极显著降低(P<0.01);FeSO4组幼龄大鼠的TIBC和UIBC显著升高(P<0.05),SI和TS极显著降低(P<0.01);低剂量组幼龄大鼠的TIBC和UIBC显著升高(P<0.05),SI和TS极显著降低(P<0.01);中剂量组幼龄大鼠的TIBC和UIBC显著升高(P<0.05),SI显著降低(P<0.05),TS极显著降低(P<0.01);高剂量组幼龄大鼠的TIBC和UIBC显著升高(P<0.05),SI和TS无显著差异(P>0.05)。
与缺铁组相比较,FeSO4组和低剂量组幼龄大鼠的SI、TS和UIBC无显著差异(P>0.05),TIBC显著降低(P<0.05);中剂量组幼龄大鼠的TIBC显著降低(P<0.05),SI显著升高(P<0.05),UIBC 和TS无显著差异(P>0.05);高剂量组幼龄大鼠的TIBC极显著降低(P<0.01),SI和TS极显著升高(P<0.01),UIBC显著降低(P<0.05)。
与FeSO4组相比较,高剂量组幼龄大鼠的SI显著升高(P<0.05),TS极显著升高(P<0.01)。
结果表明,鹅血红素补充量为每日0.33 g/kg BW时能够显著或极显著提高缺铁幼龄大鼠的SI和TS,效果明显优于FeSO4组。另外,鹅血红素的补充还能在一定程度上降低幼龄大鼠的TIBC和UIBC,改善其缺铁状况。

表6 鹅血红素对幼龄大鼠铁结合力的影响Table 6 Effects of goose heme on iron binding capacity of young rats
2.4 鹅血红素对幼龄大鼠器官组织元素含量的影响
2.4.1 鹅血红素对幼龄大鼠各器官组织内铁含量的影响
由表7可知,与正常组相比较,缺铁组、FeSO4组、低剂量组幼龄大鼠的心脏、脾脏和肾脏的铁含量极显著降低(P<0.01),肝脏铁含量显著降低(P<0.05);中剂量组和高剂量组幼龄大鼠的心脏、肝脏和脾脏的铁含量显著降低(P<0.05);中剂量组幼龄大鼠肾脏的铁含量极显著降低(P<0.01);高剂量组幼龄大鼠的心脏、肝脏、脾脏和肾脏的铁含量显著降低(P<0.05)。
与缺铁组相比较,FeSO4组、低剂量组幼龄大鼠的器官组织内铁含量无显著差异(P>0.05);中剂量组幼龄大鼠脾脏内铁含量显著升高(P<0.05);高剂量组幼龄大鼠心脏和肾脏的铁含量显著升高(P<0.05),脾脏的铁含量极显著升高(P<0.01)。
与FeSO4组相比较,中剂量组幼龄大鼠脾脏铁含量显著升高(P<0.05);高剂量组幼龄大鼠心脏和肾脏的铁含量显著升高(P<0.05),脾脏的铁含量极显著升高(P<0.01)。
结果表明,缺铁导致器官内铁含量降低,鹅血红素补充量为每日0.33 g/kg BW时能够显著或极显著提高幼龄大鼠心脏、脾脏和肾脏的铁含量,对肝脏铁含量的影响不显著。
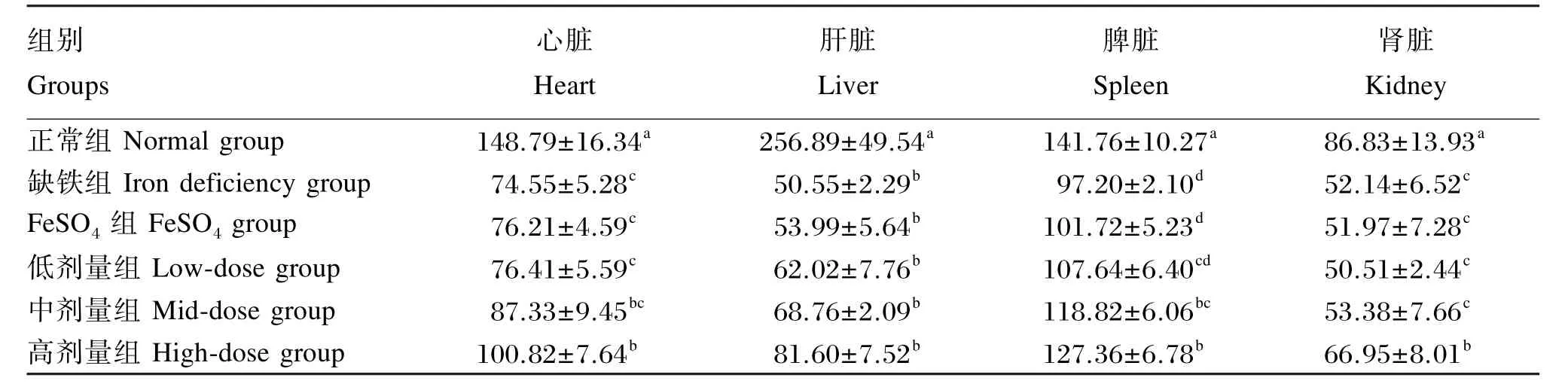
表7 鹅血红素对幼龄大鼠各器官组织铁含量的影响Table 7 Effects of goose heme on organic tissues iron content of young rats μg/g
2.4.2 鹅血红素对幼龄大鼠各器官组织内铜含量的影响
由表8可知,各组幼龄大鼠脾脏和肾脏的铜含量均无显著差异(P>0.05)。
与正常组相比较,缺铁组幼龄大鼠的心脏铜含量极显著降低(P<0.01),肝脏铜含量极显著升高(P<0.01);FeSO4组、低剂量组、中剂量组和高剂量组幼龄大鼠的心脏铜含量显著降低(P<0.05);FeSO4组幼龄大鼠的肝脏铜含量显著升高(P<0.05)。
与缺铁组相比较,FeSO4组幼龄大鼠的心脏和肝脏铜含量均无显著差异(P>0.05);低剂量组和中剂量组幼龄大鼠的肝脏铜含量显著降低(P<0.05);高剂量组幼龄大鼠的心脏铜含量显著升高(P<0.05),肝脏铜含量极显著降低(P<0.01)。与FeSO4组相比较,高剂量组幼龄大鼠的肝脏铜含量显著降低(P<0.05)。
结果表明,幼龄大鼠缺铁导致心脏铜含量降低,肝脏铜含量升高,鹅血红素补充量为每日0.33 g/kg BW时能够显著或极显著提高幼龄大鼠心脏铜含量,降低其肝脏铜含量。
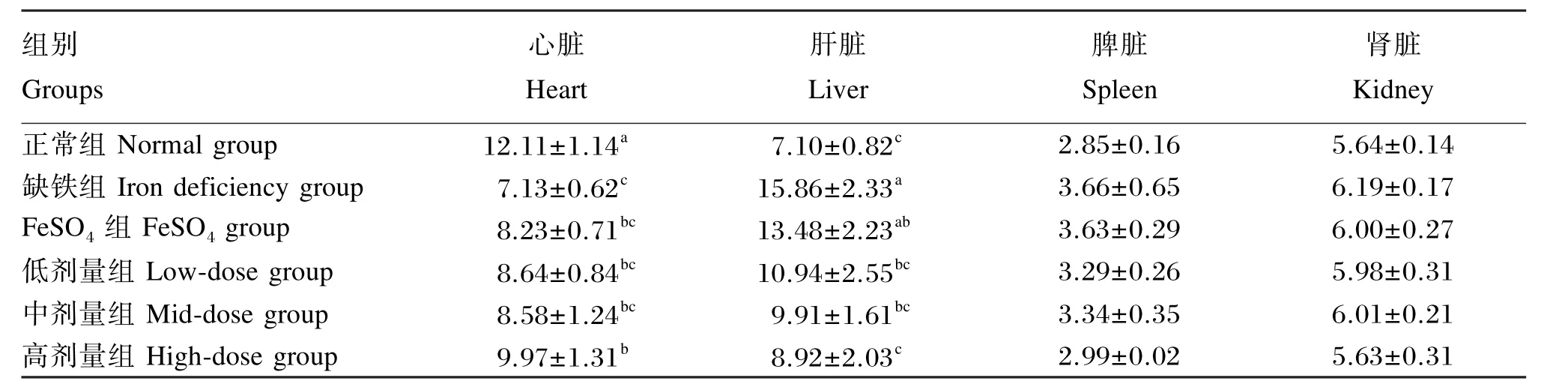
表8 鹅血红素对幼龄大鼠各器官组织铜含量的影响Table 8 Effects of goose heme on organic tissues copper content of young rats μg/g
2.4.3 鹅血红素对幼龄大鼠各器官组织锰含量的影响
由表9可知,各组幼龄大鼠肾脏的锰含量均无显著差异(P>0.05)。与正常组相比较,缺铁组幼龄大鼠的心脏锰含量显著降低(P<0.05),肝脏和脾脏锰含量显著或极显著升高(P<0.05或P<0.01);FeSO4组幼龄大鼠的心脏锰含量显著降低(P<0.05),肝脏锰含量无显著差异(P>0.05),脾脏锰含量显著升高(P<0.05);低、中和高剂量组各器官组织内锰含量均无显著差异(P>0.05)。
与缺铁组相比较,FeSO4组幼龄大鼠各器官组织内锰含量均无显著差异(P>0.05);低剂量组脾脏锰含量显著降低(P<0.05);中、高剂量组幼龄大鼠的肝脏和脾脏锰含量显著降低(P<0.05)。与FeSO4组相比较,低、中和高剂量组幼龄大鼠的心脏、肝脏和脾脏锰含量均无显著差异(P>0.05)。
结果表明,幼龄大鼠缺铁导致心脏锰含量降低,肝脏和脾脏锰含量升高,鹅血红素补充量为每日0.33 g/kg BW时能够显著或极显著提高幼龄大鼠心脏锰含量,降低其肝脏和脾脏锰含量。
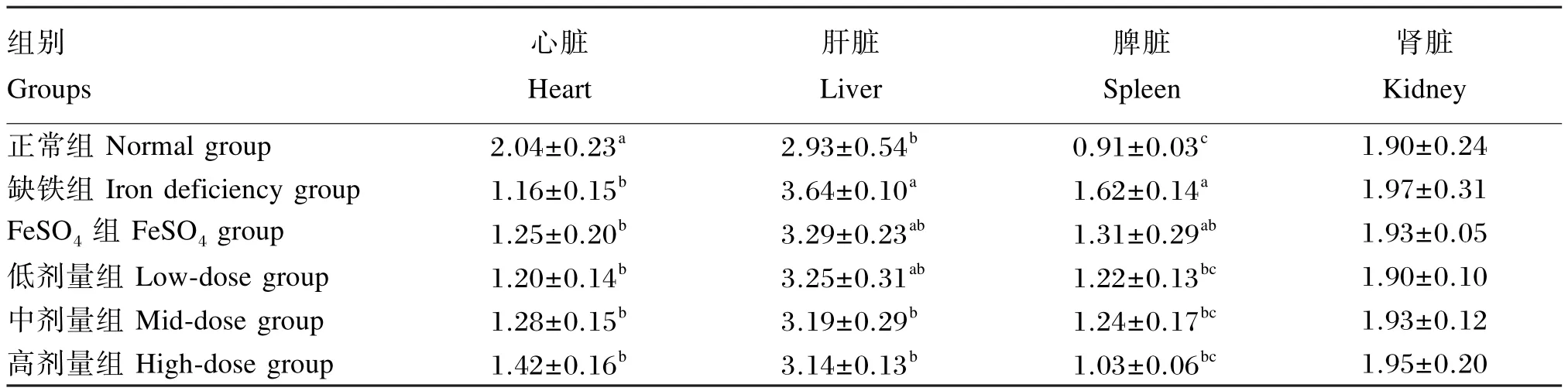
表9 鹅血红素对幼龄大鼠各器官组织锰含量的影响Table 9 Effects of goose heme on organic tissues manganese content of young rats μg/g
2.4.4 鹅血红素对幼龄大鼠各器官组织内锌含量的影响
由表10可知,各组幼龄大鼠肝脏、脾脏和肾脏的锌含量均无显著差异(P>0.05)。
与正常组相比较,缺铁组、FeSO4、低剂量组和中剂量组幼龄大鼠的心脏锌含量极显著降低(P<0.01);高剂量组心脏锌含量显著降低(P<0.05)。与缺铁组相比较,高剂量组幼龄大鼠的心脏锌含量显著降低(P<0.05)。与FeSO4组相比较,高剂量组幼龄大鼠的心脏锌含量显著降低(P<0.05)。
结果表明,幼龄大鼠缺铁导致心脏锌含量降低,鹅血红素补充量为每日0.33 g/kg BW时能够显著或极显著提高幼龄大鼠心脏锌含量。
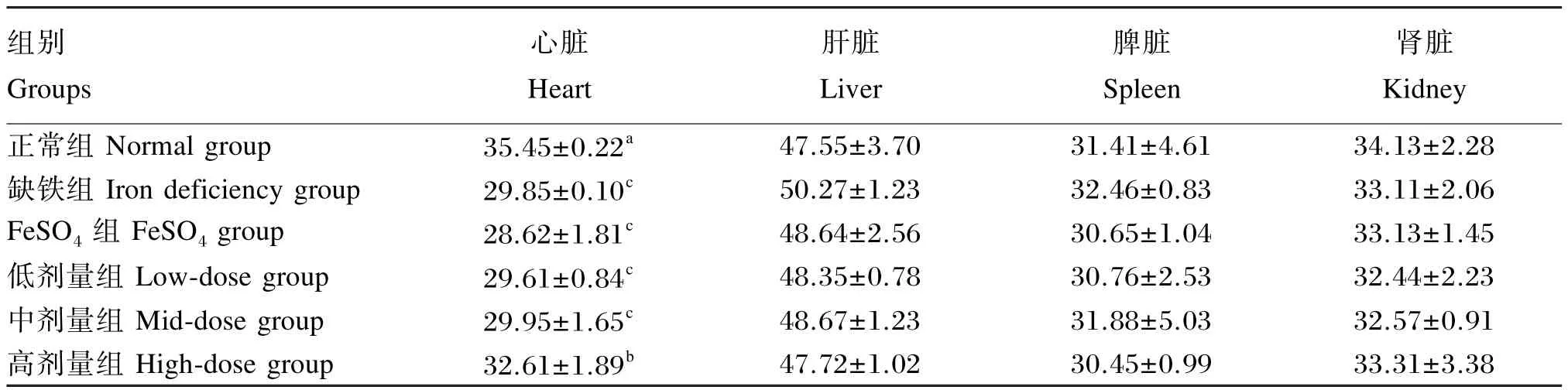
表10 鹅血红素对幼龄大鼠各器官组织锌含量的影响Table 10 Effects of goose heme on organic tissues zinc content of young rats μg/g
2.4.5 鹅血红素对幼龄大鼠各器官组织内硒含量的影响
由表11可知,各组幼龄大鼠心脏的硒含量均无显著差异(P>0.05)。与正常组相比较,缺铁组、FeSO4组、低剂量组和中剂量组幼龄大鼠的肝脏硒含量显著降低(P<0.05),脾脏、肾脏硒含量显著升高(P<0.05);高剂量组肝脏硒含量显无显著差异(P>0.05),脾脏和肾脏硒含量显著升高(P<0.05)。与缺铁组和FeSO4组相比较,低、中和高剂量组幼龄大鼠的肝脏、脾脏和肾脏硒含量无显著差异(P>0.05)。
结果表明,幼龄大鼠缺铁导致肝脏硒含量降低,脾脏和肾脏硒含量升高,鹅血红素补充量为每日0.33 g/kg BW时能够在一定程度上提高幼龄大鼠肝脏硒含量。

表11 鹅血红素对幼龄大鼠各器官组织硒含量的影响Table 11 Effects of goose heme on organic tissues selenium content of young rats μg/g
3 讨 论
3.1 幼龄大鼠IDA模型的建立及其生长发育
郑建梅等[6]、Van De Lagemaat等[7]对婴、幼儿营养性IDA进行观察分析,发现IDA导致婴幼儿生长缓慢、发育不良、皮肤苍白、心脏和脾脏肿大。白松涛[8]、赵惠君[9]曾研究发现,孕后期和哺乳期铁缺乏会严重影响婴幼儿生长发育。Rhodes等[10]试验证明,孕后期及哺乳期缺铁可导致幼鼠先天性高血压。本试验首次建立起大鼠在幼龄阶段的IDA模型,既孕后期及哺乳期缺铁。试验期间,IDA模型组幼龄大鼠出现了不同程度的铁缺乏症状,如生长缓慢、被毛粗糙、脱毛、肤色苍白、粪便发黄以及生长迟缓等,同时出现精神萎靡、活动减少和睡眠期间多抽搐等情况。幼龄阶段的铁缺乏不容小觑,对机体生长发育影响极大,而鹅血红素作为生物铁极易被肠道吸收,是极佳的补铁剂。本试验表明,与FeSO4组相比,鹅血红素高剂量组干预效果明显更好,长期服用可缓解幼龄大鼠IDA症状。
3.2 鹅血红素对幼龄大鼠铁代谢的影响
王彦华等[11]通过对IDA的临床研究证明,根据血清中的HGB、RBC、HCT、MCV及TIBC、SI和TS大小能判定IDA程度。Boudey等[12]曾研究了血浆锌原卟啉(ZPP)对IDA试验大鼠的影响,系统分析了ZPP摄入剂量对IDA大鼠生化指标的影响极其评价机制。本试验结果表明,与缺铁组和FeSO4组相比,血红素各组能够显著或极显著的提高幼龄大鼠血液中HGB、RBC、HCT、MCV、SI和TS,降低血液中RDW⁃SD、TIBC。与FeSO4组相比,鹅血红素作为一种生物补铁剂,能更有效地改善幼龄大鼠缺铁症状,增加RBC,并能改善其造血机能。
3.3 幼龄大鼠各器官组织内的元素分布情况
铁、铜、锌、硒等元素构成了人类发育和生存的微营养环境[13]。幼龄大鼠处于造血高峰期,器官需铁量较高,缺铁导致器官组织内铁含量极显著降低,影响到其他元素在幼龄大鼠器官组织内的含量及代谢。幼龄大鼠缺铁导致心脏铜、锰含量降低,肝脏铜、锰含量大幅度升高,因铜、锰的主要功能是辅助造血[14],幼龄大鼠肝脏铜、锰含量大幅增加是为了催化更多血红蛋白的合成,帮助造血[15]。缺铁导致心脏锌含量降低,而锌是大脑和身体生长发育必不可少的元素,且铁缺乏与锌缺乏往往同时发生[16]。缺铁还导致肝脏硒含量降低,而硒对肝脏健康尤为重要。综上所述,前人的研究表明铁缺乏会影响机体器官组织内铁、铜、锰、锌、硒等矿物质元素分布,其调控机理还有待进一步研究。
本试验结果表明,与缺铁组和FeSO4组相比,鹅血红素各组能够在一定程度上调控幼龄大鼠各器官组织内的矿物质元素分布,增加各器官组织内的铁含量,从而调节缺铁导致的铜、锰、锌、硒元素在器官中分布不平衡的现象,使心脏铜、锰、锌含量升高;肝脏铜、锰含量降低,硒含量升高;脾脏锰、硒含量降低,使各元素分布趋于正常,恢复肝脏正常的造血机制。
4 结 论
①鹅血红素显著增加IDA幼龄大鼠的体重和体长,促进其生长发育,同时可以缓解其缺铁引发的心脏和脾脏肿大等因缺铁引起的并发症。
②鹅血红素显著增加幼龄大鼠血液中HGB、RBC、HCT、MCV、SI和TS,降低RDW⁃SD、TIBC,增强其TIBC,对幼龄大鼠的IDA有显著的修复作用。
③鹅血红素显著增加幼龄大鼠各器官组织中的铁含量;鹅血红素能够调控幼龄大鼠各器官组织内的矿物质元素分布。
④FeSO4溶液作为补铁剂长期服用对幼龄大鼠缺铁模型的干预效果不明显。
⑤当鹅血红素的摄入量为每日0.33 g/kg BW时,IDA幼龄大鼠的干预修复作用最佳,其效果优于FeSO4。
参考文献:
[1] 赵金香,矫继峰,赵义龙.酵母铁对仔猪血液生理指标的影响[J].吉林畜牧兽医,2007,28(8):13-15.
[2] 张彬,李丽立,李铁军,等.不同铁源对哺乳仔猪生长、代谢和环境的影响[J].应用生态学报,2000,11 (1):92-95.
[3] 田婷,冯楠,胡晓梅,等.Wistar大鼠缺铁性性贫血模型的建立[J].当代医学,2011,17(35):41-42.
[4] 张义琼,周晨燕,高举,等.儿童缺铁性贫血临床和实验室分析[J].四川医学,2009,30(10):1560-1562.
[5] 张琨,张培军,崔贞玉,等.血红素铁胶囊改善大鼠缺铁性贫血状况的研究[J].中国卫生检验杂志,2008,18(6):1191-1192.
[6] 郑建梅,杨道科.婴、幼儿营养性缺铁性贫血249例相关因素分析[J].中华妇幼临床医学杂志,2009,5 (3):60-63.
[7] VAN DE LAGEMAAT M,AMESZ E M,SCHAAFS⁃MA A,et al.Iron deficiency and anemia in iron⁃forti⁃fied formula and human milk⁃fed preterm infants until 6 months post⁃term[J].European Journal of Nutri⁃tion,2014,53(5):1263-1271.
[8] 白松涛.妊娠期缺铁性贫血治疗方法的系统性评价[D].硕士学位论文.遵义:遵义医学院,2012.
[9] 赵惠君.儿童缺铁和缺铁性贫血的防治[J].实用儿科临床杂志,2012,27(3):163-165.
[10] RHODES C J,WHARTON J,HOWARD L,et al.Iron deficiency in pulmonary arterial hypertension:a poten⁃tial therapeutic target[J].European Respiratory Jour⁃nal,2011,38(6):1453-1460.
[11] 王彦华,陈颖,董小林,等.诊断缺铁性贫血常用铁参数的临床意义[J].临床血液学杂志,2007,20(2):99-101.
[12] BOUDEY M,AÏT⁃OUKHATAR N,READ M H,et al.Usefulness of plasma zinc protoporphyrin(ZPP)dosage in the assessment of iron status in the iron defi⁃ cient rat[M]//NÈVE J,CHAPPUIS P,LAMAND M.Therapeutic uses of trace elements.[S.l.]:Spring⁃er,1996:199-201.
[13] 廖鲁兴,黄晓蓉,赖玉熔,等.硒对大鼠组织中硒、镉、锌、铜、锰含量的影响[J].营养学报,1995,17(3):279-283.
[14] 季红光,王恩美,谢天培.缺铜对大鼠自由基防御系统酶组分和血清溶血素的影响[J].营养学报,1990,12(2):146-152.
[15] 周葆初,曾绍娟,董国淑,等.硒、锰对大鼠全血及组织中硒、锰水平以及谷胱甘肽过氧化物酶活性的影响[J].地方病通报,1991,6(1):15-19.
[16] 李利根,郭振荣,赵霖,等.缺锌和补锌对烫伤大鼠血清和组织锌含量,含锌酶、激素、蛋白质的影响[J].中国临床营养杂志,2006,14(1):29-32.
[17] LOKESHWAR M R,DALAL R,MANGLANI M,et al.Anemia in newborn[J].The Indian Journal of Pedi⁃atrics,1998,65(5):651-661.
[18] 丁虹.贫血和铁缺乏对易患人群的影响及控制措施[J].中国食物与营养,2005(5):49-52.
[19] 梁聪,吴仕伟,王立,等.铁元素的生理功能及缺铁性贫血对人体健康的影响[J].医学信息,2011,24 (1):158.
[20] MILMAN N,BERGHOLT T,ERIKSEN L,et al.Iron requirements and iron balance during pregnancy.Is i⁃ron supplementation needed for pregnant women?[J].Ugeskrift for Laeger,1997,159(41):6057-6062.
[21] SIEGA⁃RIZ A M,HARTZEMA A G,TURNBULL C,et al.The effects of prophylactic iron given in pre⁃natal supplements on iron status and birth outcomes:a randomized controlled trial[J].American Journal of Obstetrics and Gynecology,2006,194(2):512-519.
[22] 张敏红,王海宝.我国缺铁性贫血与补铁药的现状[J].中国药师,2005,8(12):1044-1046.
[23] 张莹莹,胡余明,胡春生,等.血红素铁改善大鼠缺铁性贫血状况实验研究[J].实用预防医学,2010,17 (12):2503-2504.
[24] 孙丙政,王云峰,黄聪,等.口服补铁剂及多糖铁络合物的研究进展[J].微量元素与健康研究,2009,26 (5):64-67.
[25] 李艳丽,冉文玉.妊娠合并缺铁性贫血的产前筛查和治疗[J].中外医学研究,2011,9(24):133.
[26] SCHWARTZ W J,THURNAU G R.Iron deficiency a⁃nemia in pregnancy[J].Expert Review of Obstetrics&Gynaecology,2013,8(6):587-596.
[27] ARTHUR TSAI M D,JEFFREY S,BERNS M D.A⁃nemia Management[M]//BYHAM⁃GRAY L D,CHERTOW G M,BURROWES J D.Nutrition in kid⁃ney disease.Totowa,NJ:Humana Press,2008:337-356.
[28] 马娟.不同剂量铁补充对缺铁性贫血大鼠的疗效及副作用观察[D].硕士学位论文.上海:第二军医大学,2013.
[29] 杨真,罗海吉,卢晓翠,等.大鼠缺铁性贫血模型建立及各指标观察研究[J].热带医学杂志,2006,6(3):284-286,321.
(责任编辑 武海龙)
Effects of Goose Heme on Growth Development,Iron Metabolism and Organic Tissues Element Distribution of Iron Deficiency Anemia Young Rats
XIE Chao WANG Baowei∗GE Wenhua ZHANG Ming’ai XU Xiaobo YUE Bin
(Nutrition and Feed Laboratory of China Agriculture Research System Qingdao,Institute of High Quality Waterfowl,Qingdao Agricultural University,Qingdao 266109,China)
∗Corresponding author,professor,E⁃mail:wangbw@qau.edu.cn
Abstract:The experiment was conducted to study the effects of different dosages of goose heme on growth de⁃velopment,iron metabolism and organic tissues element(iron,copper,manganese,zinc and selenium)distri⁃bution of iron deficiency anemia(IDA)rats aged from 3 to 7 weeks,and to find the appropriate supplemental level of goose heme and its feeding effect.The same late pregnancy period maternal were selected and fed by low⁃iron diet,from 15 days after pregnancy to the end of lactation,to establish the IDA model.After that,a total of 180 three⁃week⁃old young rats were randomly assigned into 5 groups with 6 replicates per group and 6 rats per replicate.Adding distilled water 10 mL/kg BW(iron deficiency group),1%FeSO410 mL/kg BW (FeSO4group)and goose heme 0.11(low⁃dose group),0.22(mid⁃dose group),0.33 g/kg BW(high⁃dose group),fed low iron feed.Normal group had been fed a basal control diet during modling and intervention pe⁃riod.The experiment lasted for 4 weeks.The results showed as follows:1)the average body gain,final weight and organ indexes(except heart index)in high⁃dose group had no significant different with normal group(P>0.05).Compared with the iron deficiency group,the hemoglobin,red blood cell,hematokrit,mean corpuscu⁃lar volume,serum iron and transferrin saturation in blood of young rats in high⁃dose group were significantly increased(P<0.05 or P<0.01),the erythrocyte hemoglobin distribution width and total iron binding capacity in high⁃dose group were significantly decreased(P<0.05 or P<0.01),the contents of iron,copper and zinc in heart of rats in high⁃dose group were significantly increased(P<0.05),the contents of copper and manganese in high⁃dose group were significantly decreased(P<0.05 or P<0.01).2)Taking FeSO4as iron supplement to intervene IDA model was not significant after long⁃term use.In conclusion,supplemented with 0.33 g/kg BW goose heme can effective intervene the growth development and hematopoietic ability of IDA young rats,and to make organic tissues element distribution tends to be normal,the effects are better than FeSO4.[Chinese Journal of Animal Nutrition,2015,27(2):408⁃417]
Key words:goose heme;young rats;growth development;blood parameters;element distribution
通信作者:∗王宝维,教授,硕士生导师,E⁃mail:wangbw@qau.edu.cn
作者简介:解 超(1989—),女,山东滨州人,硕士研究生,研究方向为营养与保健。E⁃mail:xiechaomm@126.com
基金项目:国家水禽产业技术体系专项基金(CARS⁃43⁃11);山东省农业重大应用技术创新项目(6681301)
收稿日期:2014-09-22
doi:10.3969/j.issn.1006⁃267x.2015.02.011
文章编号:1006⁃267X(2015)02⁃0408⁃10
文献标识码:A
中图分类号:S816.7

