拟南芥花粉管与柱头互作的乙醇代谢耦合模型
拟南芥花粉管与柱头互作的乙醇代谢耦合模型
陶璐,岳训*
(山东农业大学信息科学与工程学院,山东 泰安 271018)
摘要:依据拟南芥公开的代谢途径数据库,构建了基于酶与酶的拟南芥代谢网络模型。利用拟南芥花粉管与柱头互作过程中的转录组数据,挖掘出花粉管与柱头在互作过程中的特异表达基因,进一步将特异表达的酶基因匹配到已构建的拟南芥代谢网络中,根据网络拓扑模型中的节点(酶)之间的共表达关联性,最后给出了一个拟南芥花粉管与柱头互作的乙醇代谢耦合模型。
关键词:拟南芥;授粉;代谢网络
中图分类号:Q942文献标志码:A
收稿日期:2014-11-26;修回日期:2015-01-09.
基金项目:国家社会科学
作者简介:种乐熹,男,硕士研究生,研究方向:生物信息学;E-mail:chong_lx@163.com.
doi:10.3969/j.issn.1672-5565.2015.01.10
Ethanol metabolism coupling model betweenArabidopsispollen tube and stigma
TAO Lu, YUE Xun*
(CollegeofInformationSciencesandEngineering,ShandongAgriculturalUniversity,TaianShandong271018,China)
Abstract:According to the public database of Arabidopsis metabolism pathway, this paper constructed a metabolism correlation networks model based on enzymes correlation. Transcriptional expression data of the interaction between Arabidopsis pollen tub and stigma were used to mine significant differentially expressed genes. The significant differentially expressed genes that encoded enzymes were mapped to the enzyme correlation networks model. According to the co-regulation and inter-regulation model of the co-expressed enzymes in the consecutive steps for metabolic routes, we proposed an ethanol metabolism coupling model between Arabidopsis pollen tube and stigma.
Keywords:Arabidopsis; Pollination; Enzyme correlation networks model
传粉与受精是植物产生种子的基础,也是植物进行有性生殖的关键所在。植物雌雄配子体互作是植物生殖与发育生物学研究领域重要和热点问题之一[1]。传粉与受精的效率和质量直接关系到作物产量的高低。系统地阐明植物花粉管与柱头互作的机制,对提高作物产量具有重要意义[2]。
花粉管在雌蕊组织内的导向性生长是雌雄配子体相互作用的重要阶段之一[3]。与植物其他器官不同,花粉管以极性而非扩散性方式生长。花粉管可以在体外简单培养基中生长[4],而当其在雌蕊体内生长时,雌蕊提供其快速生长所需的物质。在过去的20多年中,为了探究植物花粉管与柱头在授粉过程中的调控机理,科学家们对此进行了大量的研究[5-6]。但是,授粉过程中雌雄配子体互作的分子调控机制细节仍然不是很清楚[7]。
随着拟南芥(Arabidopsis thaliana)等植物基因组全序列测定的完成,在后基因组学与蛋白质组学时代,转录组、蛋白组等组学技术的应用和从计算系统生物学水平上系统深入开展雌雄配子体互作调控网络的研究,已成为植物生殖与发育生物学研究领域的重要发展趋势。
本文从计算系统生物学水平上对拟南芥花粉管在柱头引导组织中导向生长过程中的互作机制进行探究,依据拟南芥公开的代谢途径数据库,构建了基于酶与酶的拟南芥代谢网络模型。然后利用拟南芥花粉管和柱头互作过程中的转录表达数据,挖掘互作过程中的特异表达的基因,进一步将特异表达基因编码的酶匹配到已构建的代谢互作网络中,根据网络拓扑结构中的节点关联性,发现柱头组织可以通过产生的乙醇参与到花粉管TCA循环中,间接为花粉管在柱头组织中的快速生长提供能量和营养物质。最后给出了一个拟南芥花粉管与柱头互作的乙醇代谢耦合模型。
1材料、数据及方法
1.1拟南芥柱头数据
Boavida利用拟南芥ATH1的全基因组阵列, 比较了野生型未授粉柱头与授粉后0.5H,3.5H和8H柱头的表达谱,得到了拟南芥Affymetrix ATH1寡核苷酸微阵列芯片数据[8]。本文以这组芯片数据为基础,通过数据分析等方法对拟南芥花粉管与柱头的互作机制进行分析(NCBI基因综合数据库编号:GSE27281)。
1.2拟南芥花粉管数据
采用Qin et al.研究获得的包括干花粉粒、未萌发花粉、离体培养0.5H和4H的花粉、萌发的花粉和在柱头中生长的花粉管等的芯片数据[9](NCBI基因综合数据库编号:GSE17343)。
1.3拟南芥代谢网络的构建
构建拟南芥代谢网络需按照以下七步进行:
(1)从拟南芥代谢途径数据库(http://www. Arabidopsis. org/biocyc/)中下载源数据文件(TXT格式)。文件中包含有540个代谢途径,7 127个酶,3 418个生化反应,3 323个化合物等内容。
(2)源数据文件中的内容并不是都对构建代谢网络有效,所有先将拟南芥代谢途径数据文件(包括代谢途径、反应酶、相关基因、反应式和各种化合物)导入Oracle数据库,做数据预处理。
(3)代谢网络模型构建规则的确定。如图1所示,如果在酶1的催化下反应生成了底物A和B,底物A或者底物B又经过酶2的催化反应生成了底物C,那么酶1和酶2就建立起了关联。代谢物反应式是确定酶与酶是否存在联系的依据。在代谢网络模型中,网络拓扑中的一个节点就代表一个酶,一条边代表两个节点(酶)之间存在关联。
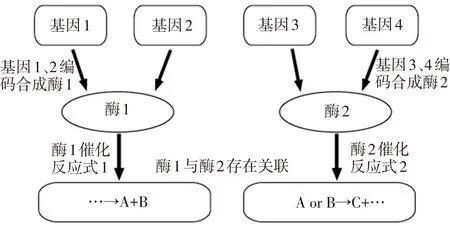
图1 代谢网络模型构建规则
(4)在确定了代谢网络构建规则的基础上,利用Oracle数据库和SQL(结构化查询语言)对源文件处理。首先从源数据文件中提取出存在的反应关系式以及相对应催化反应关系式的酶。然后利用SQL语句,将反应关系式中的反应物与催化该反应的酶进行一一对应,同时将反应关系式中的生成物与催化该反应的酶进行一一对应。
(5)剔除上述两组数据中含有小分子(H+, NADH, NADP, NADPH, NH3, ATP, ADP, AMP, NAD, CoA, O2, CO2, Glu 和pyrophosphate)的反应物或生成物记录。由于这些小分子通常是作为细胞电子转移的媒介,与代谢过程作用不大。如不剔除,会增加所构建网络的负担,对进一步的网络拓扑分析造成一定的干扰。
(6)利用Oracle数据库平台和SQL语句,在代谢网络构建规则的基础上构建酶与酶一一对应的关系。完成构建网络前的必需数据预处理准备。
(7)将上一步中已经处理准备好的酶与酶一一对应的数据导入生物分子网络分析软件Cytoscape。最后,拟南芥代谢网络模型在Cytoscape平台上直观呈现出来[10]。如图2(a)所示。
1.4基因本体分析
基因本体(Gene ontology, GO)是一个在生物信息学领域中广泛使用的本体。它主要包括三个分支:细胞组件、分子功能和生物过程[11]。本文使用的生物网络基因本体分析工具是软件Cytoscape中的一个插件(BiNGO 2.3)[12],用来识别过表达基因的P值在5×10-5水平上的功能团。
1.5差异基因
那些在至少一个生物学过程中特异表达,并且野生型和实验体差异倍数大于等于2,错误反现率小于等于1×10-10的基因,被认为是差异基因。利用差异基因进行GO分析,可以大致确定差异基因的生物功能。
1.6拟南芥花粉管和柱头的差异基因编码酶的子网络的构建
从拟南芥代谢途径数据库(http://www.arabidopsis.org/biocyc/)中下载代谢途径(pathway)的源数据文件。文件中包含有酶编号和基因编号等内容。将文件导入到Oracle数据库中,利用SQL语句找到拟南芥花粉管和柱头中差异基因编码的酶。在拟南芥代谢网络模型中将拟南芥花粉管和柱头在授粉过程中特异表达基因编码的酶表示出来。如图2(b, c),分别是拟南芥花粉管和柱头在授粉过程中特意表达的基因编码酶在已构建的拟南芥代谢网络中的标记,图2(d, e)分别是拟南芥花粉管和柱头在授粉过程中特意表达的基因编码的酶所构成的子网络模型。
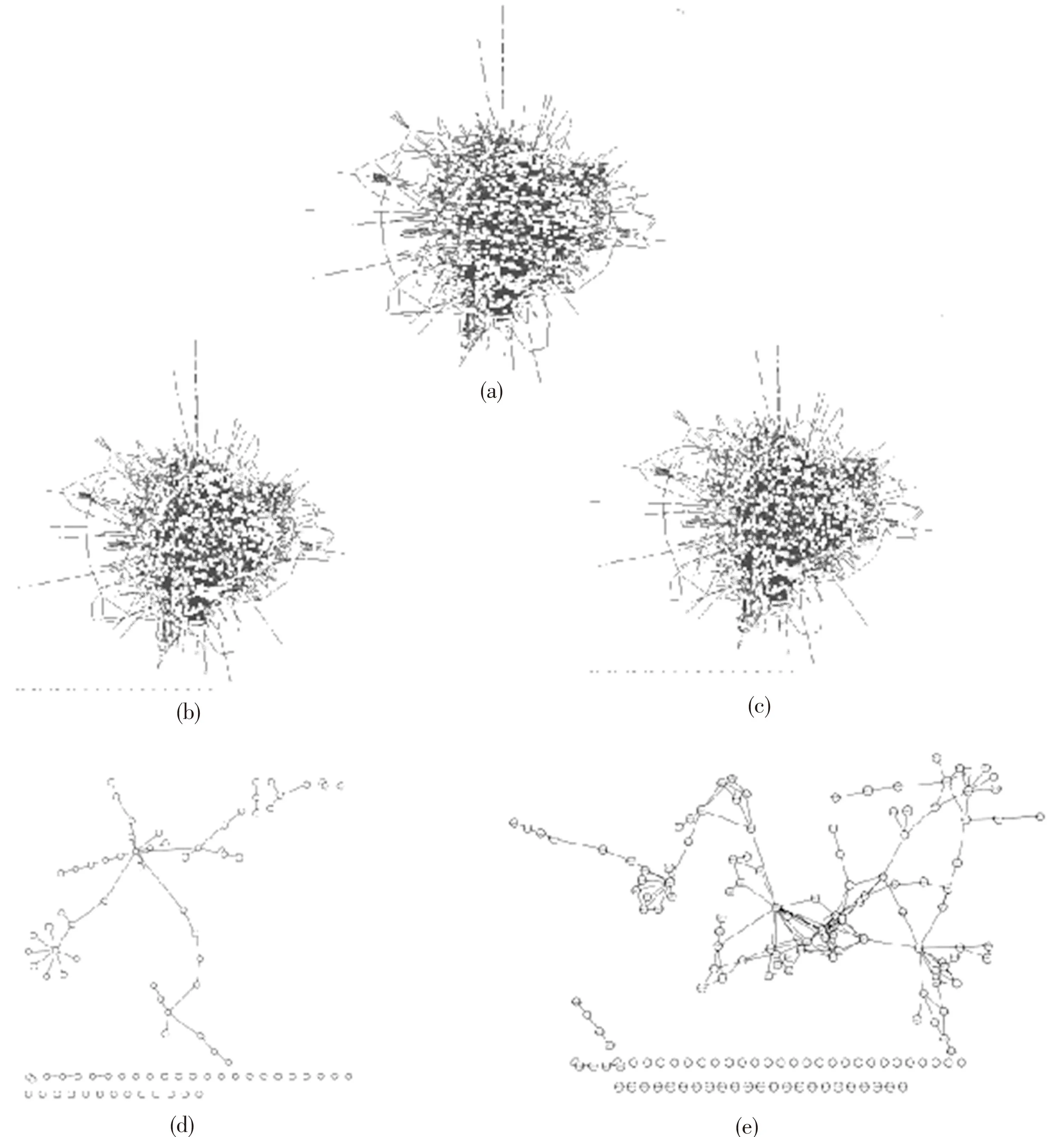
图2 拟南芥花粉管和柱头代谢网络拓扑
注:(a) 拟南芥代谢网络模型;(b) 突出显示的是拟南芥花粉管在授粉过程中特意表达的基因所编码的酶在已构建的拟南芥代谢网络中的标记;(c) 突出显示的是拟南芥柱头在授粉过程中特意表达的基因所编码的酶在已构建的拟南芥代谢网络中的标记;(d) 拟南芥花粉管在授粉过程中特意表达的基因所编码的酶所构成的子网络模型;(e) 拟南芥花粉管在授粉过程中特意表达的基因所编码的酶所构成的子网络模型.
Notes:(a) The metabolic network model of Arabidopsis; (b) The enzymes encoded by differentially expressed genes in pollen tube during the process of pollination were highlighted in the metabolic network model of Arabidopsis; (c) The enzymes encoded by differentially expressed genes in stigma during the process of pollination were highlighted in the metabolic network model of Arabidopsis; (d) The sub-network constructed by the enzymes which encoded by differentially expressed genes in pollen tube; (e) The sub-network constructed by the enzymes which encoded by differentially expressed genes in stigma.
2结果与分析
2.1拟南芥花粉管和柱头的差异基因
在拟南芥花粉管中找到1 121个差异基因,在拟南芥柱头中找到了1 468个差异基因,这些差异基因在授粉过程中的表达水平都比较显著。而后,利用生物网络基因本体分析工具(BiNGO 2.3)[12],分析拟南芥花粉管和柱头的差异基因,发现大部分的差异基因都富集在几个分类类别中,如“代谢过程”,“生物合成过程”,“细胞壁修复”,“株型细胞壁松弛”和“细菌应对防御”。
2.3拟南芥花粉管中乙醇二级代谢和TCA代谢途径上酶基因的特异表达
通过对拟南芥花粉管和柱头数据的分析,发现了一些编码催化连续反应的共表达酶的特意表达基因。
拟南芥授粉花粉管中乙醇二级代谢(如图3):(1)AT5G63620 编码乙醇脱氢酶(alcohol dehydrogenase)(EC:1.1.1.1),催化乙醇(ethanol)转化为乙醛(acetaldehyde);(2)AT1G54100 编码乙醛脱氢酶(aldehyde dehydrogenase)(EC:1.2.1.3),催化乙醛(acetaldehyde)转化为醋酸盐(acetate);(3)AT5G36880 编码乙酰辅酶A合成酶(acetyl-CoA synthetase)(EC:6.2.1.1),催化醋酸盐(acetate)转化为乙酰辅酶( acetyl-CoA)。
拟南芥授粉花粉管中TCA循环代谢(如图4):(1)AT2G17130 编码异柠檬酸脱氢酶(isocitrate dehydrogenase)(NAD+)(EC:1.1.1.41),催化柠檬酸脱氢酶(D-threo-isocitrate)转化为2-氧戊二酸盐(2-oxoglutarate);(2)AT5G65750和AT3G55410编码2-氧戊二酸盐脱氢酶E1 (2-oxoglutarate dehydrogenase E1)(EC 1.2.4.2),催化2-氧戊二酸盐(2-oxoglutarate)转化为琥珀酰辅酶A(succinyl-CoA);(3)AT5G08300 编码琥珀酰辅酶A合成酶 (Succinyl-CoA synthetase)(EC 6.2.1.5),催化琥珀酰辅酶A (Succinyl-CoA)转化为琥珀酸盐(succinate);(4)AT5G66760编码琥珀酸脱氢酶(succinate dehydrogenase (ubiquinone) flavoprotein subunit)(EC 1.3.5.1),催化琥珀酸盐(Succinate)转化为延胡索酸盐(Fumarate)。
如上数据都表明:在拟南芥花粉管中,乙醇通过二级代谢可参与到TCA循环代谢途径中,促进花粉管中ATP产量的提高,为花粉管在柱头引导组织中极性、快速生长提供能量和物质保障。
2.4拟南芥柱头中糖酵解代谢途径上酶基因的特异表达
花粉管是目前所知的生长的最快的植物细胞。而这种快速的生长模式,就需要大量的能量和物质做基础[13]。为了满足快速生长花粉管的细胞需求,柱头中大量的蛋白质合成、生化反应等代谢途径被激活,为花粉管的快速生长提供充足的物质和能量[14]。利用多组学网络分析的方法同样发现,在拟南芥授粉的柱头中,所编码共表达酶的基因、糖酵解的连续反应以及与能产生高能营养(乙醇)的关键酶的转录表达水平都呈现出明显升高趋势。如图5所示。
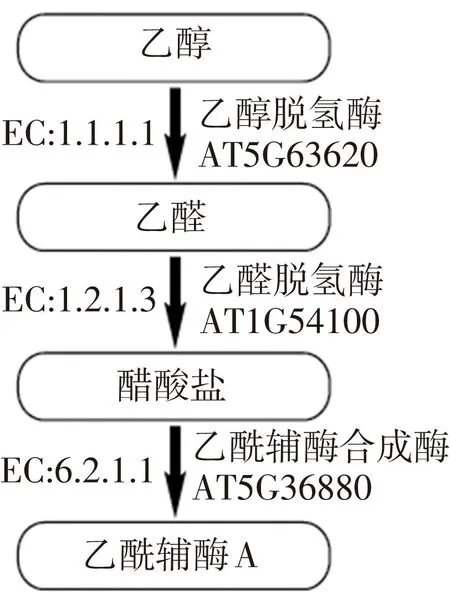
图3 拟南芥花粉管中乙醇二级代谢
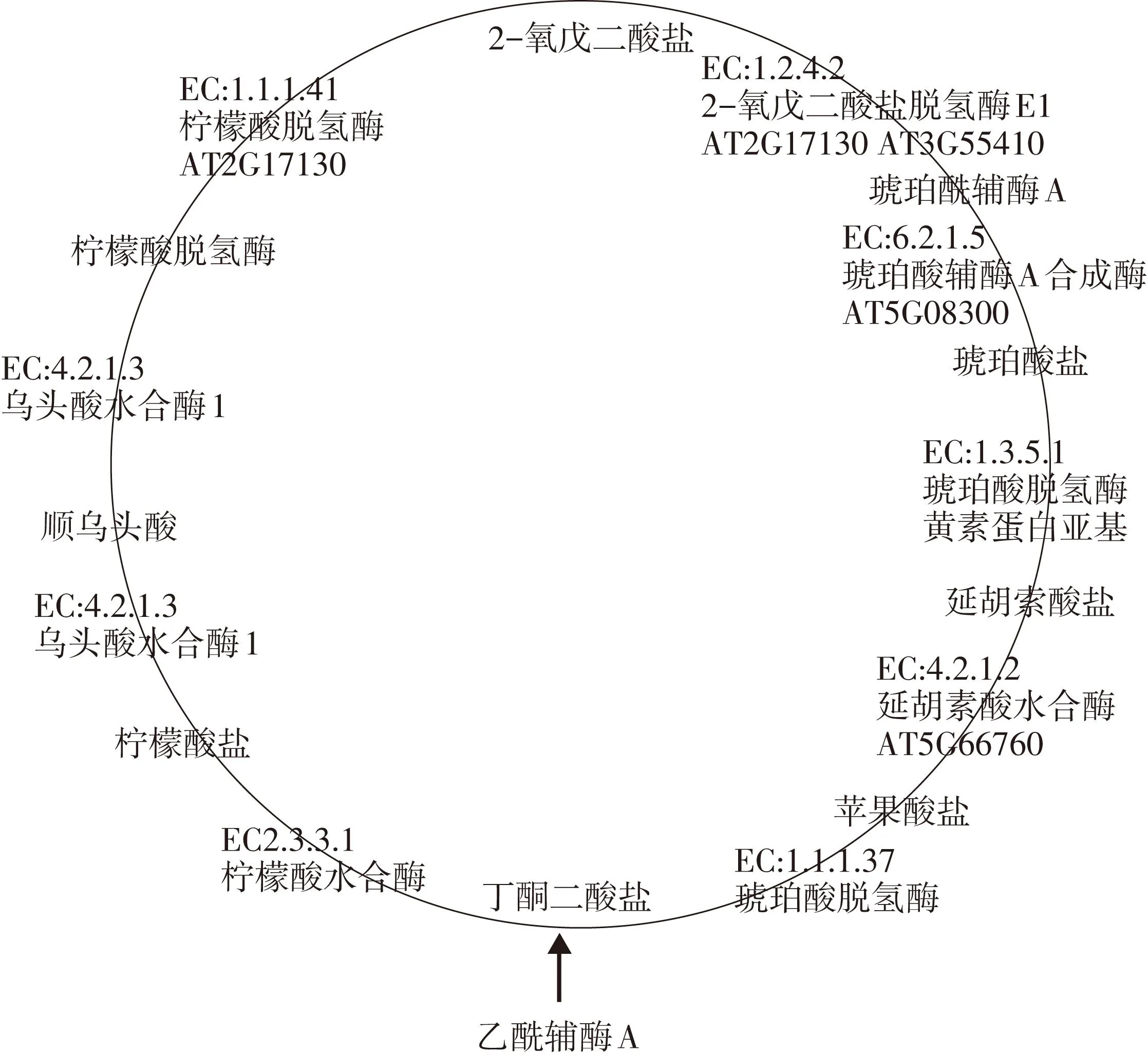
图4 拟南芥花粉管中 TCA循环代谢途径
(1)两个拟南芥基因(AT1G20950和AT4G04040)编码6-磷酸果糖转磷酸酶(fructose-6-phosphate 1-phosphotransferase) (EC 2.7.1.90)。催化6-磷酸果糖转磷酸酶(fructose-6-phosphate 1-phosphotransferase)转化为果糖(fructose-1)和磷酸(6-bisphosphate),作为糖酵解(glycolysis IV)代谢途径的最开始反应。
(2)在糖酵解代谢的第二步中,多组学网络分析表明在拟南芥中没有编码果糖二磷酸醛缩酶(fructose-bisphosphate aldolase) (EC 4.1.2.13)的差异基因,果糖二磷酸醛缩酶可以催化果糖(fructose-1)、二磷酸(fructose-1)转化为3-磷酸甘油醛(D-glyceraldehyde 3-phosphate)。本文推断果糖二磷酸醛缩酶(fructose-bisphosphate aldolase)可能是起因于被称为“自噬行为”的细胞降解过程。
(3)两个拟南芥基因(AT1G16300 和 AT1G79530)编码甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase) (GAPDH) (EC 1.2.1.12),催化D-3-磷酸甘油醛(D-glyceraldehyde 3-phosphate)转化为1,3-二磷酸-D-甘油酸(1,3-bisphospho-D-glycerate)。
(4)磷酸甘油酸激酶(Phosphoglycerate kinase) (EC 2.7.2.3),催化1,3-二磷酸-D-甘油酸(1,3-bisphospho-D-glycerate)转化为3-磷酸-D-甘油酸(3-phospho-D-glycerate)。重要的是,拟南芥的柱头中并没有发现编码磷酸甘油酸激酶的基因。而后,通过重新查找这些基因的源数据库,结果与分析发现结论一致。
(5)AT1G09780编码2,3-二磷酸甘油酸依赖性磷酸甘油酸变位酶(2,3-bisphosphoglycerate-dependent phosphoglycerate mutase) (EC 5.4.2.1),催化3-磷酸-D-甘油酸(3-phospho-D-glycerate)转化为2-磷酸-D-甘油酸(2-phospho-D-glycerate)。
(6)AT1G74030编码烯醇酶(enolase) (EC 4.2.1.11),催化2-磷酸-D-甘油酸(2-phospho-D-glycerate)转化为磷酸烯醇丙酮酸盐(phosphoenolpyruvate)。
(7)丙酮酸激酶(pyruvate kinase) (PKM2) (EC 2.7.1.40),催化磷酸烯醇丙酮酸盐(phosphoenolpyruvate)转化为丙酮酸盐(pyruvate),是糖酵解反应最后的一个步骤。
有趣的是,在分析过程中发现了几个能产生高能营养物质(乙醇)的关键酶。首先三个拟南芥基因(AT1G04040, AT3G17790 和 AT3G52820)编码了酸性磷酸酶(acid phosphatase) (EC 3.1.3.2)催化磷酸单酯(phosphate monoester)转化为乙醇(ethanol)。其次,两个拟南芥基因编码了甘油磷酸二脂酶(glycerophosphodiester phosphodiesterase) (EC 3.1.4.46),催化甘油磷酸二脂酶(glycerophosphodiester)转化为乙醇(ethanol)。
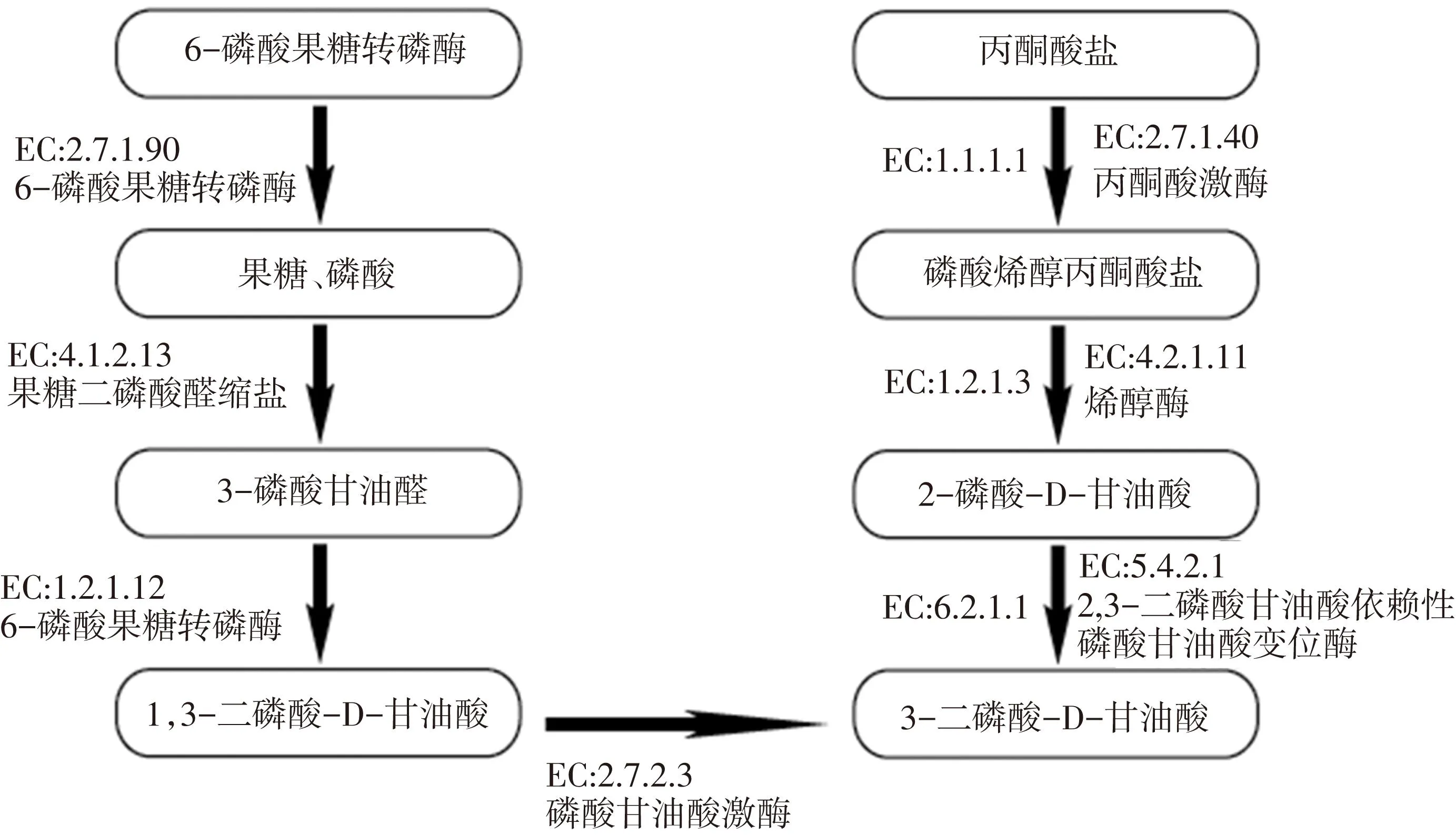
图5 拟南芥柱头中的糖酵解代谢
3讨论
通过上面的数据分析表明:当授粉后的花粉管在柱头分泌区的细胞外基质中生长时,柱头可能确实能被激活许多代谢活动,为花粉管生长提供能量和所需物质。例如,糖酵解相关的代谢途径被激活:糖分转化为丙酮酸,丙酮酸被进一步代谢为高能营养物质乙醇,柱头组织中的乙醇又被转运到极性、快速生长的花粉管中,参与到花粉管的TCA循环代谢途径,产生能量和营养物质。
根据上述分析,本文提出了拟南芥花粉管与柱头互作的乙醇耦合模型(如图6)。
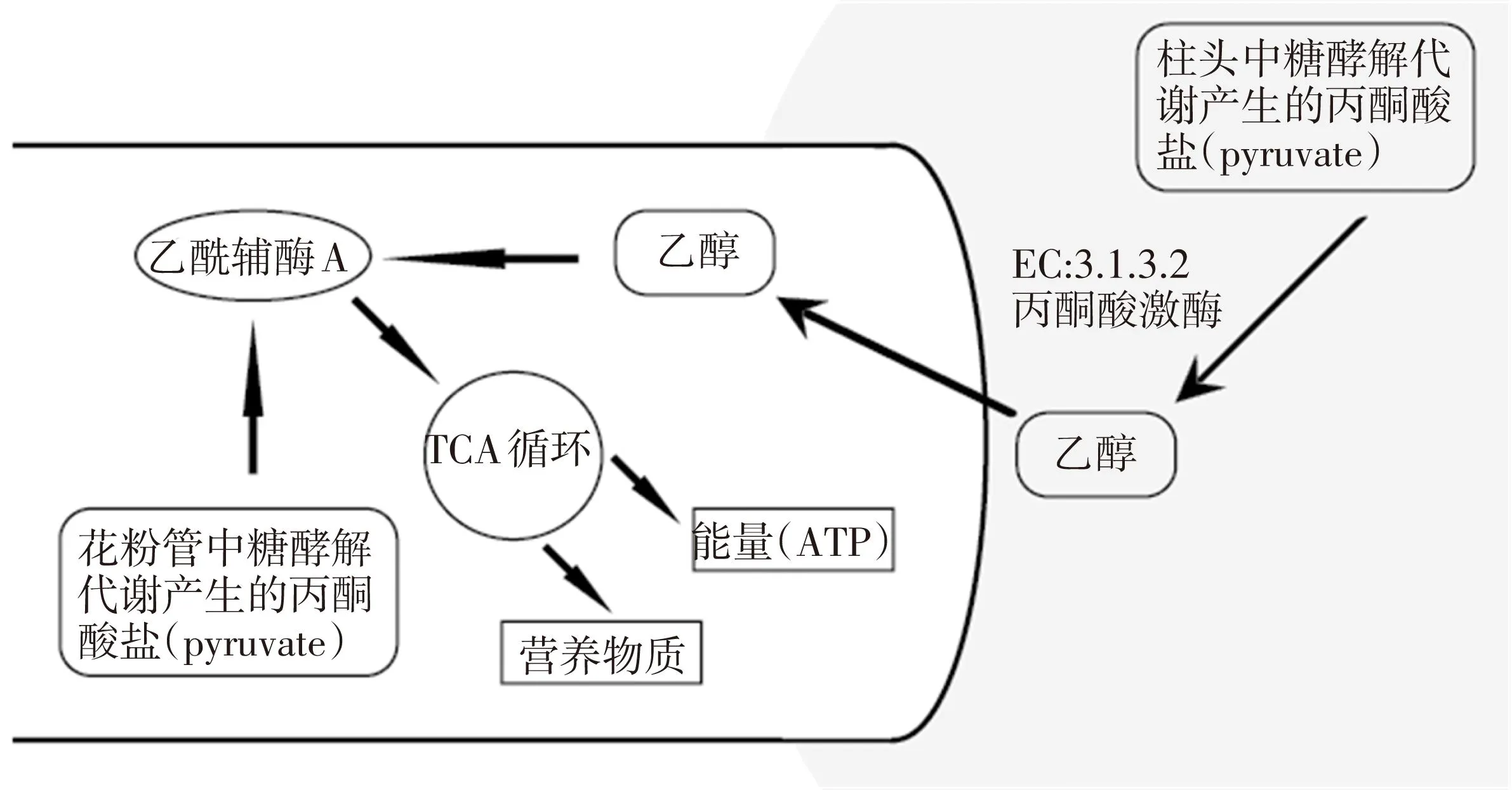
图6 拟南芥花粉管与柱头互作的乙醇代谢耦合模型
花粉萌发和花粉管的快速生长是一个需要大量能量和物质的生物过程。特别是某些代谢途径,如细胞质溶质的糖酵解代谢等,这些代谢过程中产生的丙酮酸脱氢酶、TCA(柠檬酸)循环、乙醇等都对花粉管的生长有着非常重要的作用。
(1)当花粉管在柱头的引导组织中生长延长时,花粉管的延长触发了柱头引导组织中糖酵解产生的能量的转移,激活了糖类物质转化为丙酮酸盐。
(2)丙酮酸盐进一步代谢为能被花粉管吸收利用的高能营养物质乙醇。
(3)在花粉管中乙醇通过II级降解,进一步代谢为乙酰辅酶A(acetyl-CoA)。
(4)乙酰辅酶A(acetyl-CoA)参与到花粉管的TCA循环汇总,促进了ATP产量的增加,从而为花粉管的快速生长提供了能量保证。
综上,在拟南芥花粉管和柱头的互作生物学问题背景下,从计算系统生物学水平上,以拟南芥花粉管和柱头代谢组学数据为基础,运用多组学网络分析方法,构建了拟南芥代谢互作网络模型,进一步挖掘拟南芥花粉管和柱头在授粉过程中特异表达的基因,根据网络拓扑中的节点关联性和代谢互作网络的实际生物学问题,发现拟南芥花粉管中的乙醇和柱头中糖酵解代谢产生的被转运到花粉管中的乙醇可以参与到花粉管TCA循环代谢途径中,为花粉管在柱头引导组织中快速、极性生长所需要的能量和营养物质提供了保障。最后,本文建立了拟南芥花粉管和柱头互作的乙醇代谢耦合模型。
参考文献(References)
[1]HISCOCK S J, ALLEN A M. Diverse cell signaling pathways regulate pollen-stigma interactions: the search for consensus [J]. New Phytologist, 2008, 179(2):286-317.
[2]SIVITZ A B,REINDERS A,WARD J M, et al. Arabidopsis sucrose transporter AtSUC1 is important for pollen germination and sucrose induced anthocyanin accumulation [J]. Plant Physiology, 2008, 147(1): 92-100.
[3]刘敬婧,侯英楠,瞿礼嘉.高等植物受精过程中雌-雄相互作用的分子调控机制[J].中国科学:生命科学,2013,43(10):842-853.
LIU Jingjing, HOU Yingnan, QU Lijia. Molecular mechanisms behind the male-female interaction in fertilization in higher plants [J]. Scientia Sinica Vitae, 2013, 43(10):842-853.
[4]WANG Y X, MAGNARD J L, MCCORMICK S, et al. Progression through meiosis I and meiosis II in arabidopsis anthers is regulated by an A-type cyclin predominately expressed in prophase I [J].Plant Physiology, 2004, 136(4): 4127-4135.
[5]SWANSON R, EDLUND A F, PREUSS D. Species specificity in pollen-pistil interactions[J]. Annual Review of Genetics, 2004, 38: 793-818.
[6]GAO X Q, ZHU D Z, ZHANG X S. Stigma factors regulating self-compatible pollination[J].Frontiers in Biology, 2010, 5(2): 156-163.
[7]HIGASHIYAMA T. Peptide signaling in pollen-pistil interactions [J]. Plant Cell Physiology, 2010, 51(2): 177-189.
[8]BOAVIDA L C, BORGES F, BECKER J D, et al. Whole genome analysis of gene expression reveals coordinated activation of signaling and metabolic pathways during pollen-pistil interactions in arabidopsis [J]. Plant Physiology, 2011, 155(4): 2066-2080.
[9]QIN Y, LEYDON A R, MANZIELLO A, et al. Penetration of the stigma and style elicits a novel transcriptome in pollen tubes, pointing to genes critical for growth in a pistil [J]. Plos Genetics, 2009, 5(8): e1000621.
[10]LI M N, XU W Y, YANG W Q, et al. Genome-wide gene expression profiling reveals conserved and novel molecular functions of the stigma of rice [J]. Plant Physiology, 2007, 144(4):1797-1812.
[11]YOUNG M D, WAKEFIELD M J, SMYTH G K, et al. Gene ontology analysis for RNA-SEQ: accounting for selection bias [J]. Genome Biology, 2010, 11(2):R14.
[12]MAERE S, HEYMANS K, KUIPER M. Bingo: a cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks [J]. Bioinformatics, 2005, 21(16):3448-3449.
[13]TAYLOR L P, HEPLER P K. Pollen germination and tube growth[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48:461-491.
[14]OBERMEYER G, FRAGNER L, LANG V,et al. Dynamic adaption of metabolic pathways during germination and growth of lily pollen tubes after inhibition of the electron transport chain [J]. Plant Physiology, 2013, 162(4):1822-1833.
*通信作者:胡德华,男,教授,博士生导师,研究方向:生物信息学;E-mail:hudehua2000@163.com.

