微生物培养基中U(Ⅵ)和U(Ⅳ)测定方法的建立及稳定性研究
刘小玲,陈晓明,b,阮 晨,许 燕,王 超,廖祥兵,宋 收,罗学刚
(西南科技大学a.生命科学与工程学院,b.核废物与环境安全国防重点学科实验室,中国 绵阳 621010)
微生物培养基中U(Ⅵ)和U(Ⅳ)测定方法的建立及稳定性研究
刘小玲a,陈晓明a,b*,阮晨a,许燕a,王超a,廖祥兵a,宋收a,罗学刚a
(西南科技大学a.生命科学与工程学院,b.核废物与环境安全国防重点学科实验室,中国 绵阳621010)
摘要为了消除微生物培养基对U(Ⅵ)和U(Ⅳ)质量浓度测定的影响,建立微生物培养基中测定U(Ⅵ)和U(Ⅳ)质量浓度ρ的方法,优化了在稀盐酸体系中利用U(Ⅵ)制备U(Ⅳ)的条件:10 mg/L U(Ⅵ),锌粒用量12 g/L,反应时间180 min.通过测定ρ总U减去ρU(Ⅵ),计算出ρU(Ⅳ),建立了同时测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)的分光光度法.微生物培养基对U(Ⅵ)和U(Ⅳ)有明显影响:LB和NA培养基对U(Ⅵ)的影响率分别为37.3%和47.9%;单组分中蛋白胨和牛肉膏对U(Ⅵ)的影响率较大,分别达到33.5%和19.7%;而U(Ⅵ)和U(Ⅳ)在TGY培养基中较稳定.采用该方法测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ),能消除微生物培养基对U的影响,且具有精密度高、操作简单等优点,能实现生物样品中ρU(Ⅵ)和ρU(Ⅳ)的快速测量.
关键词U(Ⅳ)的制备;分光光度法;微生物培养基;U稳定性
Establishment of Determination Method and Stability of
U(Ⅵ) and U(Ⅳ) in Microbial Medium
LIUXiao-linga,CHENXiao-minga,b*,RUANChena,XUYana,WANGChaoa,
LIAOXiang-bina,SONGShoua,LUOXue-ganga
(a. School of Life Science and Engineering, b. School of National Defense Science and Technology,
Southwest University of Science and Technology, Mianyang 621010, China)
AbstractIn order to eliminate the influence of microbial culture medium to the measurement of U(Ⅵ) and U(Ⅳ) mass concentration and establish detection method of U(Ⅵ) and U(Ⅳ) in microbial medium, the optimal preparation conditions of U(Ⅳ) in dilute hydrochloric acid system were discussed in this study. The optimal preparation conditions of U(Ⅳ) include U(Ⅵ) at a final concentration of 10 mg/L, zinc dosage of 12 g/L, the reaction time of 180 min. U(Ⅳ) by U(Ⅵ) and total U is determined. Spectrophotometry is established to measure the concentration of U(Ⅵ) and U(Ⅳ) in microbial medium. Microbial culture medium has significant effect on the measurement of U(Ⅵ) and U(Ⅳ). The influence rates of LB, NA medium to U(Ⅵ) are 37.3% and 47.9%, respectively. The influence rates of peptone and beef extract in single component to U(Ⅵ) are 33.5% and 19.7%, respectively. U(Ⅵ) and U(Ⅳ) in TGY medium are relatively stable. The proposed spectrophotometry method has high recovery rate, accuracy and precision, simple operation and so on, which could be used to measure the concentrations of U(Ⅵ) and U(Ⅳ) rapidly.
Key wordspreparation of U(Ⅳ); spectrophotometric method; microbial medium; U stability
随着核工业的发展,含U放射性废物不断进入环境中,对人类健康和生态环境造成威胁.地壳表层平均铀含量为3 μg/g[1].铀矿冶、核电站、核武器实验等含铀废水中,铀的质量浓度约为5 mg/L,远高于国家排放标准(0.05 mg/L),也远高于世界卫生组织(WHO)规定饮用水标准最高铀质量浓度50 μg/L[2-3].高浓度铀的放射性和化学毒性影响动物和人体肾脏和骨骼的正常功能[4],因此,U污染的环境修复问题已成为当前的研究热点.据报道微生物修复U污染比物理化学修复更具有显著优势[5].自然环境中,U有Ⅲ,Ⅳ,Ⅴ和Ⅵ 4种价态,U(Ⅲ)和U(V)不稳定,极易歧化,因此U(Ⅵ)和 U(Ⅳ)是两种最主要的价态[6].
因U易受环境中pH值、有机物、氧化还原条件等的影响,其化学形态在实际环境体系中可互相转化,增加了U价态分析的难度.
目前,微生物培养基中U(Ⅵ)和 U(Ⅳ)的测量方法为偶氮胂(Ⅲ)分光光度法[7-8].其原理是U(Ⅵ)和 U(Ⅳ)在酸性条件下与偶氮胂(Ⅲ)形成1∶1络合物,在特定波长处测其吸光度[9-10].但偶氮胂(Ⅲ)分光光度法在U(Ⅵ)和U(Ⅳ)质量浓度的测量过程中,忽略了微生物培养基对U的影响及U(Ⅳ)的不稳定性,而不能同时准确测量其中U(Ⅳ)的质量浓度.因此,为了深入研究微生物对U的氧化还原作用,有必要在微生物培养基中建立一种能同时测量U(Ⅵ)和U(Ⅳ)质量浓度的方法.
通过将U的多形态分析转为单一形态分析,即运用分光光度法,通过U的氧化还原,测量体系中U(Ⅵ)和总U的质量浓度ρ,ρ总U减去ρU(Ⅵ)得出ρU(Ⅳ),可消除培养基中U(Ⅳ)不稳定性及微生物培养基对其影响问题.U(Ⅳ)作为U(Ⅵ)的还原产物,也是氧化还原过程中的反应试剂,其制备方法包括还原剂还原法(金属还原剂、汞齐及合金还原剂、低价金属化合物)、电化学法、光催化法等[11].其中部分还原方法操作复杂、易受还原剂、催化剂及反应条件等的限制.因此需寻找一种操作过程简单、不易引入干扰物质,避免在HCl、HF、稀H2SO4、低浓度HClO4中U(Ⅵ)还原产物U(Ⅳ)的再氧化作用的U(Ⅳ)制备方法;再运用U的氧化还原过程建立U(Ⅵ)和U(Ⅳ)的分光光度法;通过该方法研究U(Ⅵ)和U(Ⅳ)在微生物培养基中的稳定性,为微生物固定U(Ⅵ)选用适合的培养基提供理论依据.
1材料与方法
1.1 材料和试剂
TGY培养基(胰蛋白胨酵母葡萄糖培养基):胰蛋白胨5 g,酵母粉3 g,葡萄糖1 g,定容至1 000 mL,pH 7.0~7.2.
LB培养基(溶菌肉汤培养基):酵母粉5 g,蛋白胨10 g,氯化钠10 g,定容至1 000 mL,pH 7.2~7.4.
NA培养基(牛肉膏蛋白胨培养基):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,定容至1 000 mL,pH 7.0.
1 000 mg/L U(Ⅵ)标准储备液:1.782 2 g醋酸双氧U(UO2(CH3COO)2·H2O上海谱振生物科技有限公司),溶解并定容至1 000 mL,摇匀,避光保存,其他各浓度U(Ⅵ)由此溶液稀释获得.
0.05%偶氮胂(Ⅲ)显色液(上海阿拉丁):偶氮胂(Ⅲ)0.05 g,定容至100 mL.
无砷锌粒(成都市科龙化工试剂厂).其他试剂均为国产分析纯.
1.2 U(Ⅵ)标准曲线的制作
取1 000 mg/L U(Ⅵ) 2 mL,去离子水定容至50 mL,配制成40 mg/L U(Ⅵ),8支10 mL比色管,分别加入40 mg/L U(Ⅵ)0,0.2,0.4,0.6,0.8,1.0,1.5,2 mL,0.05%偶氮胂Ⅲ1 mL,缓冲液定容至10 mL,充分摇匀,静置30 min,于652 nm处测其吸光度.
1.3 U(Ⅳ)的制备方法优化
在6 mol/L HCl介质中,以锌粒为还原剂,考察U(Ⅵ)初始浓度、锌粒用量、反应时间等对U(Ⅳ)制备的影响,得出优化条件[12].最后测量溶液残留U(Ⅵ),考察U(Ⅳ)的生成率.

(1)
式中ρ1为U(Ⅵ)起点质量浓度,mg/L;ρ2为U(Ⅵ)残留质量浓度,mg/L.
1.3.1初始U(Ⅵ)质量浓度对U(Ⅳ)制备的影响分别取1 000 mg/L U(Ⅵ) 0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL于50 mL容量瓶中,加入6 mol/L HCl 45 mL,加入锌粒0.6 g,使其用量为12 g/L,定容.U(Ⅵ)最终分别为4,6,8,10,12,14,16,18,20 mg/L.
1.3.2锌粒用量对U(Ⅳ)制备的影响取1 000 mg/L U(Ⅵ) 0.5 mL于50 mL容量瓶中,加入6 mol/L HCl 45 mL,加入锌粒分别为0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8,2.0 g,定容.使锌粒用量分别为4,8,12,16,20,24,28,32,36 g/L.
1.3.3反应时间对U(Ⅳ)制备的影响取1 000 mg/L U(Ⅵ) 0.5 mL于50 mL容量瓶中,加入6 mol/L HCl 45 mL,加入锌粒使其用量为12 g/L,反应时间分别为90,120,150,180,210 min,定容.
1.4微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)测试方法的建立
1.4.1微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)分光光度法的建立微生物培养基中U(Ⅳ)由于易受温度、空气中气体、体系中酸性介质等影响发生氧化,造成形态发生变化.在U(Ⅵ)和U(Ⅳ)的微生物培养基混合体系中,运用偶氮胂(Ⅲ)分光光度法先测量样品中ρU(Ⅵ),另取样品将U(Ⅳ)氧化成总U,利用ρ总U减去ρU(Ⅵ)得出ρU(Ⅳ),即整个研究过程中通过ρU(Ⅵ)和ρ总U定量ρU(Ⅳ),使多组分分析转换成单组分分析.该方法解决了微生物培养基对U的影响及U(Ⅳ)的不稳定性问题,能同时测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ).
偶氮胂(Ⅲ)分光光度法测试ρU(Ⅵ):取2 mL样品,1 mL 0.05%偶氮胂(Ⅲ)显色液,0.4 mol/L氯乙酸-0.4 mol/L氯乙酸钠缓冲液定容至10 mL,静置30 min,波长652 nm处测量其吸光度;偶氮胂(Ⅲ)分光光度法测试ρU(Ⅳ)则先测试样品中ρU(Ⅵ),另取2 mL样品采用1 mL浓硝酸加热赶酸,保持微沸状态,直到出现白色残渣为止,溶解并定容至5 mL.用偶氮胂(Ⅲ)分光光度法测试ρU(Ⅵ),此为ρ总U.含U混合体系中ρU(Ⅳ)由两者的差值得出.ρU(Ⅳ)按式(2)计算:
ρU(Ⅳ)=ρ总U-ρU(Ⅵ).
(2)
式中ρU(Ⅳ)为U(Ⅳ)质量浓度,mg/L;ρ总U为总U质量浓度,mg/L;ρU(Ⅵ)为U(Ⅵ)质量浓度,mg/L.
1.4.2浓硝酸用量对U(Ⅳ)氧化率的影响取10 mg/L U(Ⅳ)25 mL于容量瓶中,TGY培养基定容至50 mL.分别加入0,0.5,1.0,1.5,2.0,2.5,3.0 mL浓硝酸对2 mL培养基中的U(Ⅳ)进行氧化,反应完成后偶氮胂(Ⅲ)分光光度法测量ρU(Ⅵ),即ρ总U.考察浓硝酸用量对U(Ⅳ)氧化率的影响,U(Ⅳ)的氧化率按式(3)计算:
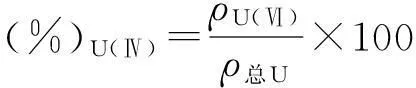
(3)
式中ρU(Ⅵ)为U(Ⅵ)质量浓度,mg/L;ρ总U为总U质量浓度,mg/L.
1.5 U在培养基中的稳定性研究
1.5.1U(Ⅵ)在TGY,LB,NA培养基中的稳定性研究取过滤除菌1 000 mg/L U(Ⅵ) 1 mL,分别加入至已灭菌的99 mL NA,LB,TGY的液体培养基中,得到最终10 mg/L U(Ⅵ).30 ℃,120 r/min,震荡60 h,间隔12 h 取样,测量微生物培养基对U(Ⅵ)的影响率.微生物培养基对U(Ⅵ)的影响率按式(4)计算:
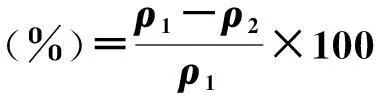
(4)
式中ρ1为U(Ⅵ)起点质量浓度,mg/L;ρ2为U(Ⅵ)残留质量浓度,mg/L.
1.5.2培养基单组分对U(Ⅵ)稳定性的影响按单组分在微生物培养基中的比例,即3 g/L酵母粉,10 g/L 蛋白胨,3 g/L牛肉膏,5 g/L胰蛋白胨,1 g/L葡萄糖,10 g/L氯化钠的液体培养基中加入过滤除菌的1 000 mg/L U(Ⅵ) 1 mL,得到最终10 mg/L U(Ⅵ).30 ℃,120 r/min,震荡60 h,间隔12 h取样,考察培养基单组分对U(Ⅵ)的影响.
1.5.3U(Ⅳ)在TGY培养基中的稳定性研究等体积混合过滤除菌的10 mg/L U(Ⅳ)与灭菌TGY培养基, 30 ℃,120 r/min,震荡60 h,间隔12 h取样.含U混合体系中,测量2 mL样品中ρU(Ⅵ),另取2 mL样品加入1 mL浓硝酸将其中U(Ⅳ)硝化为总U,测ρ总U,ρU(Ⅵ),计算出ρU(Ⅳ),考察TGY培养基中U(Ⅳ)的稳定性.
2结果与讨论
2.1 U(Ⅵ)标准曲线的制作
以U(Ⅵ)质量浓度为横坐标,吸光度为纵坐标,拟合后得到U(Ⅵ)标准曲线,结果如图1所示.可知标准曲线方程y=0.040x-0.007,R2=0.999,在ρU=0.0~20.0 mg/L范围内,吸光度-ρU关系符合比尔定律.
2.2 U(Ⅳ)的制备方法优化
2.2.1ρU(Ⅵ)对U(Ⅳ)制备的影响保持反应体系中的ρU(Ⅵ)分别为4,6,8,10,12,14,16,18,20 mg/L,HCl浓度6 mol/L,锌粒12 g/L,总反应体积为50 mL.U(Ⅳ)生成率随U(Ⅵ)初始浓度的变化见图2.由图2可知,在4~10 mg/L U(Ⅵ)终浓度范围内,U(Ⅳ)生成率随着ρU(Ⅵ)的增大保持稳定状态,达到95%左右.但ρU(Ⅵ)为10~20 mg/L时,U(Ⅳ)生成率随着ρU(Ⅵ)的增加,生成率急剧下降.因此,选择最适ρU(Ⅵ)为10 mg/L.
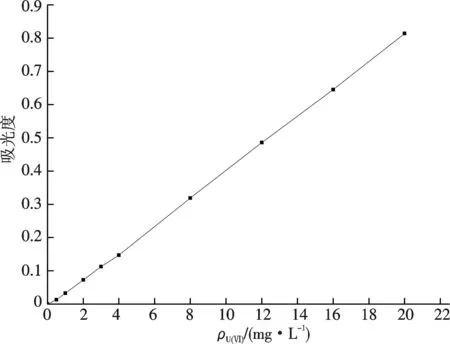
图1 U(Ⅵ)标准曲线Fig.1 Standard curve of U (Ⅵ)

图2 U(Ⅵ)质量浓度对U(Ⅳ)制备的影响Fig.2 Influence of U (Ⅵ) concentration on preparation of U (Ⅳ)
2.2.2锌粒用量对U(Ⅳ)制备的影响保持反应体系中的ρU(Ⅵ)为10 mg/L,HCl浓度为6 mol/L,总反应体积为50 mL,反应体系中的锌粒用量分别为4,8,12,16,20,24,28,32,36 g/L.U(Ⅳ)生成率随锌粒用量的变化见图3.由图3可知,锌粒用量在4~12 g/L范围内,U(Ⅳ)生成率随着锌粒浓度的增加而增大.当锌粒用量为12 g/L时,生成率达到最大.但当锌粒用量大于28 g/L时,生成率呈明显减小趋势,且有典型的黑色絮状沉淀.推测锌粒过量时,会对ρU(Ⅵ)的测量有较大影响.因此选择最适宜锌粒用量为12 g/L.
2.2.3反应时间对U(Ⅳ)制备的影响保持反应体系中的ρU(Ⅵ)为10 mg/L,HCl浓度为6 mol/L,总反应体积为50 mL,锌粒12g/L,反应时间分别为90~210 min.U(Ⅳ)生成率随反应时间的变化见图4.

图3 锌粒用量对U(Ⅳ)制备的影响Fig.3 Influence of zinc dosage on preparation of U (Ⅳ)
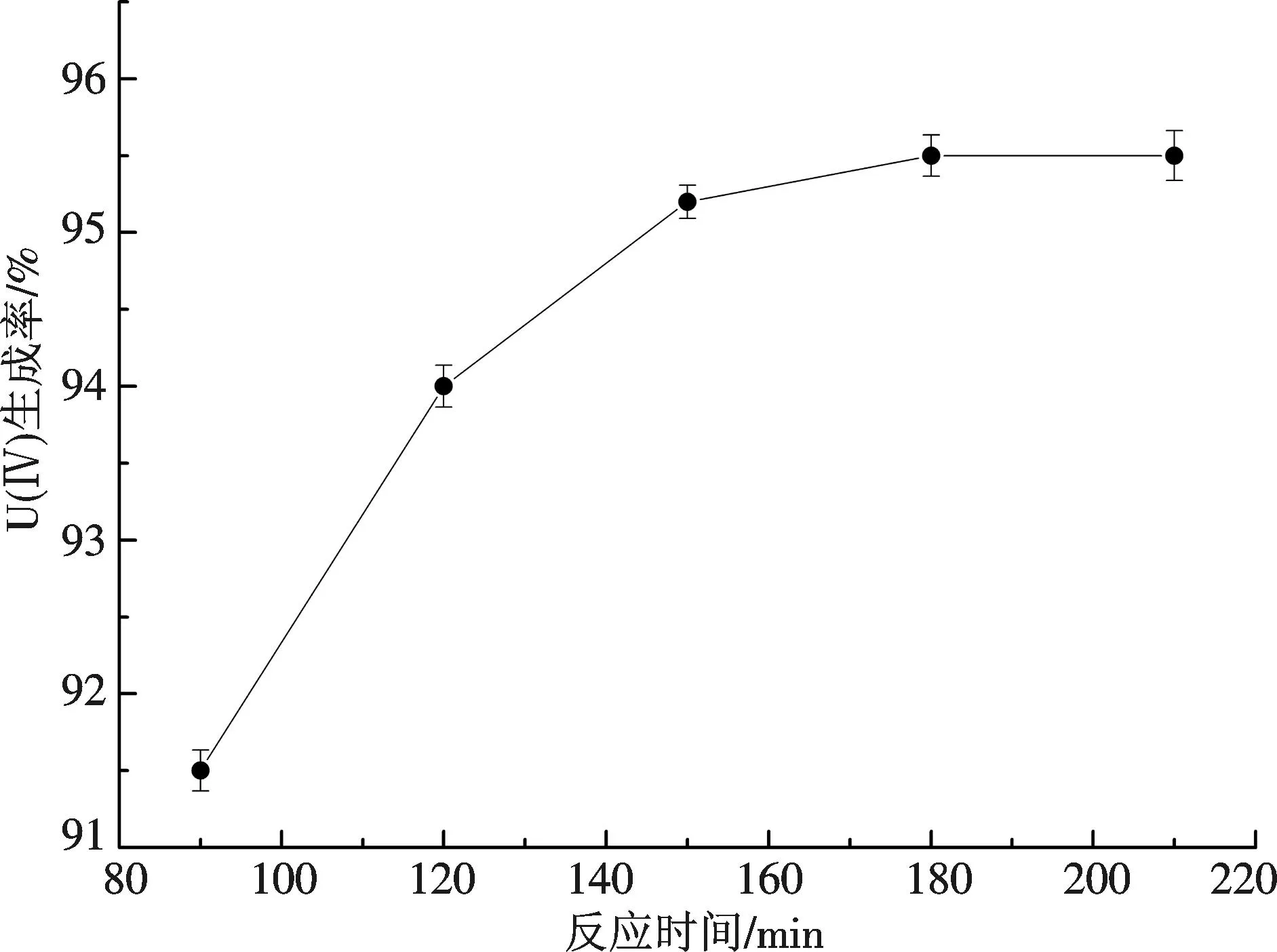
图4 反应时间对U(Ⅳ)制备的影响Fig.4 Influence of reaction time on preparation of U (Ⅳ)
由图4可知,U(Ⅳ)生成率随着反应时间的增加而缓慢增大,当反应时间达到180 min时,再增加反应时间,U(Ⅳ)生成率变化不明显.因此,体系中最适宜反应时间为180 min.
从图2~图4得出,U(Ⅵ)初始质量浓度、锌粒用量、反应时间是影响U(Ⅳ)制备的3个重要因素.ρU(Ⅵ)为10 mg/L,锌粒为12 g/L,反应时间180 min是U(Ⅳ)制备的最优条件,此时U(Ⅳ)的生成率达到95%.这与李斌等[13]报道通过肼催化还原U(Ⅵ)制备U(Ⅳ)的生成率99%相比虽略低,但利用肼为还原剂制备U(Ⅳ)易受温度、还原剂、催化剂及反应条件等的影响.研究过程中采用锌粒还原U(Ⅵ)制备U(Ⅳ)与其他制备U(Ⅳ)的方法相比具有明显的优势,操作过程简单、快速、避免了U(Ⅳ)的不稳定性问题及其他制备U(Ⅳ)过程中易受操作工艺和实验条件限制的问题.
2.3 微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)测试方法的建立


图5 硝酸用量对U (Ⅳ)氧化率的影响 Fig.5 Influence of the amounts of nitric acid on oxidation rate of U (Ⅳ)
本研究与刘金巍等[15]指出地质样品经HF-HNO3-HCl-HClO4硝化后,样品中有机质对U的测量无干扰一致,说明浓HNO3氧化效率高,可消除培养基中氨基酸和有机质等大分子物质对ρU测量的影响.
2.3.2分光光度法精密度和准确度分析5 mg/L U(Ⅵ)和5 mg/L U(Ⅳ)的等体积混合TGY培养基中,运用偶氮胂(Ⅲ)分光光度法结合氧化还原过程平行测定5次,进行精密度和准确度分析,结果见表1.

表1 方法的精密度和准确度
由表1和2.1及文献[9]可得,ρU(Ⅵ)测量的线性范围为0.05~20.0 mg/L,回收率为96%,RSD=1.7%,误差为-4%.因此,本方法能用于生物样品中U(Ⅵ)和U(Ⅳ)的测定.
2.4 U在培养基中的稳定性研究
2.4.1U(Ⅵ)在TGY,LB,NA培养基中的稳定性研究采用分光光度法考察10 mg/L U(Ⅵ)在TGY,LB,NA微生物培养基中的稳定性,结果见图6.由图6可知,蛋白胨、牛肉膏、氯化钠组成的NA培养基对ρU(Ⅵ)的影响最大,48 h影响率可达到47.9%;酵母粉、蛋白胨、氯化钠组成的LB培养基作用48 h对ρU(Ⅵ)的影响率达到37.3%;60 h后,NA和LB培养基对U(Ⅵ)测量的影响率呈锯齿状的趋势,可能是培养基对U(Ⅵ)的作用不稳定,具体原因还待探究.胰蛋白胨、酵母粉、葡萄糖组成的TGY培养基作用12 h对ρU(Ⅵ)的影响率仅为5.6%.Halbach等[16]通过研究花岗岩基岩中有机物与U结合实验表明: 有机物官能团通过离子交换机制和等量铀酰离子进行结合.NA和LB培养基中的主要成分蛋白胨、牛肉膏等有机质和氨基酸类物质,其官能团可能与U(Ⅵ)结合.
2.4.2培养基单组分对U(Ⅵ)的稳定性的影响由2.4.1可知U(Ⅵ)在LB及NA培养基中不稳定,因此进一步考察了全组分中一定比例的酵母粉、蛋白胨、牛肉膏、胰蛋白胨、葡萄糖、氯化钠对10 mg/L U(Ⅵ)的影响,结果见图7.由图7可知,各单组分对U(Ⅵ)的影响率分别为7.4%,33.5%,19.7%,2.8%,2.7%,5.2%.结果表明由蛋白胨、牛肉膏、氯化钠组成的NA培养基全组分对U(Ⅵ)的影响相对TGY和LB培养基较大.Li等[17]研究了芽孢杆菌属dwc-2对U的吸附机制,结果表明芽孢杆菌属dwc-2对U(Ⅵ)的吸附是复杂的,至少涉及生物集聚、离子交换和复合体形成.也有文献通过研究微生物对U(Ⅵ)的还原物机制表明:其还原机制较复杂,包括U(Ⅵ)和细胞表面发生了离子交换、成核、螯合、微沉淀、酶对U(Ⅵ)的还原等作用[18-19].曾峰等[20]还指出一定浓度U胁迫会使植物羟基、羧基等发生明显变化.微生物培养基主要成分为碳源、氮源和无机盐,包括一些特殊官能团、阴离子、阳离子等,推测U(Ⅵ)可能与培养基中的有机质、氨基酸的某些基团发生了络合、螯合等作用,与培养基中的阴阳离子发生了离子交换作用,从而影响了ρU(Ⅵ)的测量.其中蛋白胨、牛肉膏影响较大,可能是其多肽和氨基酸类物质中R基含有的苯环共轭双键系统,与U(Ⅵ)发生络合反应,说明培养基中有机物中某些基团能与金属阳离子发生结合,这与郭丽艳等[21]研究不同物质对铬价态测定结果的影响研究结果相似.

图6 TGY,LB,NA培养基对U(Ⅵ)的影响Fig.6 Influence of TGY, LB, NA medium on U (Ⅵ)

图7 微生物培养基单组分对U(Ⅵ)的影响Fig.7 Influence of microbial medium single-component on U(Ⅵ)

图8 TGY培养基对U(Ⅳ)的影响Fig.8 Influence of TGY medium on U (Ⅳ)
2.4.3U(Ⅳ)在TGY培养基中的稳定性研究10 mg/L U(Ⅳ)加入等体积TGY培养基中,即为5 mg/L U(Ⅳ).按1.5.3步骤考察了U(Ⅳ)在TGY培养基中的稳定性,结果见图8.由图8可知,TGY培养基对U(Ⅳ)的影响在12~60 h内基本保持稳定,影响率仅为8.6%,表明U(Ⅳ)在TGY培养基中保持稳定.由图6可知,U(Ⅵ)在TGY培养基中保持稳定,即U(Ⅵ)和U(Ⅳ)在TGY培养基中均能保持相对稳定,该研究对U在微生物培养基中的价态分析提供了基础.
3结论
在稀HCl 体系中,以锌粒为还原剂,考察了U(Ⅵ)质量浓度、锌粒用量、反应时间对U(Ⅳ)制备的影响.其优化条件是U(Ⅵ) 10 mg/L,锌粒12 g/L,反应时间180 min.
以ρU(Ⅵ)和ρ总U定量ρU(Ⅳ),建立了测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)的分光光度法.考察了浓硝酸用量对U(Ⅳ)氧化率的影响.测量ρU(Ⅵ)的线性范围为0.05~20.0 mg/L,回收率为96%,RSD=1.7%,误差为-4%.因此,本方法能用于生物样品中ρU(Ⅵ)和ρU(Ⅳ)的测试.该方法与ICP-MS测量方法相比,具有操作简单、价格便宜、不易引入干扰物质的特点,且该方法在含U混合体系中能实现ρU(Ⅵ)和ρU(Ⅳ)的同时测定,对微生物修复U污染具有重要意义.
运用分光光度法考察了微生物培养基中U(Ⅵ)和U(Ⅳ)的稳定性.结果表明,相对于NA和LB培养基而言,U(Ⅵ)和U(Ⅳ)在TGY培养基中能够保持稳定.进一步考察了组成培养基一定比例的单组分对U(Ⅵ)的影响,得出牛肉膏、蛋白胨因含有氨基酸、有机质等物质,对U(Ⅵ)影响较大.通过稳定性考察可为微生物固定U(Ⅵ)选用适合的培养基提供参考.
参考文献:
[1]KALIN M, WHEELER W N, MEINRATH G. The removal of uranium from mining waste water using algal/microbial biomass[J]. J Environ Radioact, 2004,78(2):151-177.
[2]聂小琴, 董发琴, 刘明学,等. 生物吸附剂梧桐树叶对铀的吸附研究[J]. 光谱学与光谱分析, 2013,33(5):1290-1294.
[3]GAVRILESCU M, PAVEL L V, CRETESCU I. Characterization and remediation of soils contaminated with uranium[J]. J Hazard Mater, 2009,163(2):475-510.
[4]BLEISE A, DANESI P R, BURKART W. Properties, use and health effects of depleted uranium (DU): a general overview[J]. J Environ Radioact, 2003,64(2):93-112.
[5]BAEZA A, FERNANDEZ M, HERRANZ M,etal. Removing uranium and radium from a natural water[J]. Water Air Soil Pollut, 2006,173(1-4):57-69.
[6]CROSBY H A, JOHNSON C M, RODEN E E,etal. Coupled Fe (Ⅱ)-Fe (Ⅲ) electron and atom exchange as a mechanism for Fe isotope fractionation during dissimilatory iron oxide reduction[J]. Environ Sci Technol, 2005,39(17):6698-6704.
[7]SAWIN S B. Analytical use of arsenazo Ⅲ: Determination of thorium, zirconium, uranium and rare earth elements[J]. Talanta, 1961,8(9):673-685.
[8]KHAN M H, WARWICK P, EVANS N. Spectrophotometric determination of uranium with arsenazo-Ⅲ in perchloric acid[J]. Chemosphere, 2006,63(7):1165-1169.
[9]郭一飞, 梁俊福, 焦荣洲,等. 分光光度法测量高放废液处理工艺中的U[J]. 原子能科学技术, 2000,34(3):252-258.
[10]王亮, 何辉, 张秋月. 直接分光光度法测量四价U[J]. 中国原子能科学研究院年报, 2013(1):195-196.
[11]董灵英. 铀的分析化学[M]. 北京:原子能出版社, 1982.
[12]曹诗倜. 矿石中微量铀的比色测定[J]. 原子能科学技术, 1966(4):232-239.
[13]李斌, 何辉, 丁伯发,等. 肼为还原剂催化还原U (Ⅵ) 制备 U (Ⅳ) 的工艺条件[J]. 核化学与放射化学, 2013,35(1):24-35.
[14]HANNA T, DANIELA V, ESA P,etal. A comparison of analytical methods for determining uranium and thorium in ores and mill tailings[J]. J Geochem Explor, 2014,9(4):1-7.
[15]刘金巍, 王彦丽, 杨金荣,等. 碳酸钠浸取-紫外荧光光谱法测量地质样品中痕量U[J]. 岩矿测试, 2007,26(2):160-162.
[16]HALBACH P, BORSTEL D, GUNDERMANN K D. The uptake of uranium by organic substances in a peat bog environment on a granitic bed rock[J]. Chem Geol, 1980,29(1):117-138.
[17]LI X L, DING C C, LIAO J L,etal. Biosorption of uranium onBacillussp. dwc-2: preliminary investigation on mechanism[J]. J Environ Radioact, 2014,135:6-12.
[18]MTIMUNYE P J, CHIRWA E. Characterization of the biochemical-pathway of uranium (Ⅵ) reduction in facultative anaerobic bacteria[J]. Chemosphere, 2014,113:22-29.
[19]TAPIA-RODRIGUEZ A, LUNA-VELASCO A, FIELD J A,etal. Anaerobic bioremediation of hexavalent uranium in ground-water by reductive precipitation with methanogenic granular sludge[J]. Water Res, 2010,44(7):2153-2162.
[20]曾峰, 唐永金. 高浓度 U 胁迫下植物物质成分的FTIR 研究[J]. 湖南师范大学自然科学学报, 2013,36(5):59-64.
[21]郭丽艳, 陈晓明, 朱捷,等. 不同物质对铬价态测定结果的影响[J]. 安全与环境学报, 2012,12(1):165-169.
(编辑王健)
*通讯作者,E-mail:xmhyx99@163.com
基金项目:国家973计划资助项目(2014CB846003);国防科工局资助项目(14Zg6101);四川省生物质资源利用与改性中心基金资助项目 (13zxsk02);核废物与环境安全协同创新中心基金(15yyhk05)
收稿日期:2015-01-16
中图分类号O614.62
文献标识码A
文章编号1000-2537(2015)03-0022-07
DOI:10.7612/j.issn.1000-2537.2015.03.005

