北五味子果实有效部位的连续制备技术研究
·实验研究·
北五味子果实有效部位的连续制备技术研究
王安华1,韩志福2,胡高升1
(1.沈阳药科大学中药资源教研室,辽宁 沈阳 110016;2.哈药集团技术中心,黑龙江 哈尔滨 150020)
摘要:目的建立北五味子中不同组分的制备方法。方法通过CO2超临界流体萃取(SFE)技术得到北五味子油;油中的3种主要木脂素含量及亚油酸含量的检测方法为高效液相色谱法和气相色谱法;SFE提取后的残渣用来提取多酚类成分,提取工艺用响应曲面法优化,提取物中的多酚含量用Folin-cicalteu′s试剂进行测定;多酚提取残渣再进行水提醇沉,得到北五味子粗多糖,用苯酚硫酸法进行多糖含量测定。结果北五味子油的出油率为14.1%,油中亚油酸含量为58.4%,3种主要木脂素(五味子醇甲、五味子乙素、五味子甲素)总含量为9.44%;北五味子多酚最佳提取条件为60%乙醇,溶液倍量25,提取时间31 min,在此提取条件下,出膏率为41.2%,其中多酚含量为2.56%;北五味子粗多糖提取率为3.88%。结论本制备工艺提高了北五味子的利用率,同时也为开发北五味子中不同药品及保健功能产品提供了原材料。
关键词:五味子;木脂素;多酚;多糖
基金项目:国家科技支撑计划(No.2011BAI03B04)
作者简介:王安华,男,研究方向:中药资源学,E-mail:sywanganhua@163.com
通讯作者:胡高升,男,博士研究生,研究方向:中药生物技术,Tel:024-23986501,E-mail:115644862@qq.com
中图分类号:R284.2文献标识码:A
Studies on continuous preparation of effective fractions from FructusSchisandraeChinensis
WANGAn-hua1,HANZhi-fu2,HUGao-sheng1
(1.SchoolofTraditionalChineseMaterialMedica,ShenyangPharmaceuticalUniversity,Shenyang
110016,China;2.HarbinPharmaceuticalGroupTechnologyCenter,Harbin150020,China)
Abstract:ObjectiveTo establish preparative method of the different fractions from Fructus Schisandrae chinensis(FSC).MethodsThe FSC oil was obtained by CO2 supercritical fluid extraction (SFE).The contents of three main lignans and linoleic acid in oil were determined using HPLC and GC,respectively.The debris was subsequently used to extract phenolic compounds,in which,the condition was optimized using response-surface method.The content of phenolic compound was determined using Folin-cicalteu′s reagent.Finally,debris after phenolic compounds extraction was used to extract polysacharrides by water extraction and ethanol precipitation and the content of polysaccharides was determined by phenol-sulfate method.ResultsThe oil yield rate was 14.1%,in which,the sum content of three main lignans reached 9.44% and the content of linoleic acid content in oil was 58.4%.The optimized condition for phenolic compounds extraction was 60% ethanol,solvent/material ratio as 25,sonication time as 31 min.The yield rate was 41.2% and the content of phenolic compounds was 2.56%.The yield of polysaccharide reached 3.88%.ConclusionOur continuous extract method improved the exploration rate of FSC and facilitated the preparation of different extract meeting the different need of medicine and health foods development.
Key words:FructusSchisandraechinensis;Lignan;Polyphenols;Polysaccharides
北五味子[Schisandrachinensis(Turcz.) Baill]为木兰科(Magnoliaceae)五味子属(SchisandraMichx.)药用植物,药用部位为干燥成熟果实。北五味子主产于亚洲东部和欧洲北部,秋季采摘后,烘干或晒干,除去果梗和杂质,即为北五味子药材。主要功效为收敛固涩,益气生津,补肾宁心。主要用于久嗽虚喘、久泻不止、心悸失眠等[1]。
在《中国药典》2010年版[1]中收载的制剂中有60个处方制剂含有北五味子药材,经过调查发现北五味子的国内产量超过90%应用在医药领域(包括中成药,饮片和提取物),在药品行业中的需求量属于稳步提高状态。在保健品开发方面,国内在北五味子保健品和食品领域的研究和产品较少,目前主要是五味子果酒、猴头菇羊肚菌五味子胶囊和灵芝五味子胶囊等几种较小规模的产品。国外对北五味子的保健品开发较成熟,仅韩国北五味子产品每年在国内的销售额超过1千万元,其北五味子原材料及提取物主要来自中国,产品形态以化妆品,保健品和食品为主。北五味子果实传统的提取方法主要的提取目标是木脂素类成分,多用高浓度乙醇提取,提取后的残渣往往被丢弃,造成了较大的原料浪费,本文对北五味子不同有效部位的提取工艺进行了摸索和优化,旨在得到一种能够综合利用五味子资源的提取方法,为开发具有不同功能的保健品提供原料。
1仪器与材料
1.1主要仪器超临界萃取设备(沈阳东宇药物技术研究院超临界制造分公司);日立高效液相色谱仪(UV-VIS Detector L-2420 Autosampler L-2200 Pump L-2130 Column Heater AT-330),D2000色谱工作站;Agilent 7890 A型气相色谱仪(美国安捷伦公司);毛细管柱DB-WAX(30 m×0.25 mm,0.25 μm)。
1.2主要材料北五味子果实采自辽宁省本溪市清源县,经过沈阳药科大学贾景明教授鉴定为北五味子[Schisandrachinensis(Turcz.) Baill]果实。正己烷,乙醇(山东禹王试剂公司);三氟化硼-甲醇溶液(美国Sigma公司);氢氧化钾(天津市大茂试剂厂)和亚油酸(美国Sigma公司);液相用乙腈,水均为色谱纯;苯酚、碳酸钠(山东禹王试剂公司),Folin-cicalteu′s试剂(上海生物生工有限公司);五味子醇甲对照品(中国药品生物制品检定所,批号:110857-200709);五味子乙素对照品(中国药品生物制品检定所,批号:110765-200710);五味子甲素对照品(中国药品生物制品检定所,批号:110764-200609);绿原酸(Sigma-Aldrich 公司)。
2实验方法
2.1超临界萃取法提取五味子果实油脂北五味子果实经干燥粉碎后,过20目筛,精密称定,均匀填装进萃取釜,超临界萃取设备型号(CLJ-B-120-35-1)。萃取条件(萃取釜温度40 ℃,速率7.5 ℃·min-1,压力30 MPa;分离釜温度30 ℃,压力4.5 MPa;萃取时间3 h)。每隔30 min,收集五味子油脂类成分。
2.2运用响应曲面法优化五味子多酚提取工艺以经过超临界提取后的北五味子果实粉末为原材料,再根据响应曲面法[2],提取液为不同浓度的乙醇,各组取0.3 g粉末,精密称定,置具塞锥形瓶中,超声振荡提取1次,混匀后离心10 min,转速4 000 rpm,吸取上清液,测定多酚含量。
2.3五味子果实中多糖的提取精密称取北五味子粉末5 g(提取完油脂及多酚的五味子果实粉末),置于150 mL锥形瓶中,加入100 mL蒸馏水,充分混悬,超声处理20 min,吸取上清液,沉淀再加入100 mL蒸馏水,再充分混悬,超声处理20 min,合并上清液。在溶液中加入适量 95%乙醇,使溶液中的乙醇浓度为80%,混匀,置于4 ℃下沉淀12 h后,在3 000 rpm,室温下离心5 min,弃去上清液,加入10 mL丙酮重新混悬沉淀,离心,弃上清液,加入10 mL乙醚重新混悬沉淀,离心,弃上清液,反复多次,然后在室温下挥干沉淀中的有机溶剂,得到北五味子果实粗多糖干燥粉末。
2.4五味子醇甲、甲素、乙素的含量测定方法
2.4.1色谱条件梯度洗脱条件见表1,Platisil C18色谱柱(4.6 mm×250 mm,5 μm),流动相:乙腈-水溶液,流速:1.0 mL·min-1,检测波长:250 nm,进样量:10 μL,柱温:30 ℃。

表1 高效液相梯度洗脱条件
2.4.2对照品溶液的制备分别精密称取五味子醇甲、五味子甲素及五味子乙素对照品适量,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,配制成含0.37 mg·mL-1五味子醇甲,0.34 mg·mL-1五味子甲素及0.54 mg·mL-1五味子乙素的标准品溶液。
2.4.3供试品制备精密称定北五味子果实油脂0.2 g,精密加入乙腈(正己烷饱和)20 mL,混匀,超声提取20 min,补足失重,室温离心5 min,转速4 000 rpm,取上清液过0.45 μm滤膜,得样品溶液。
2.4.4线性关系考察取对照品,加甲醇制成含60、120、180、240和300 μg·mL-1五味子醇甲;34、68、102、136和170 μg·mL-1五味子甲素及36、72、108、144和180 μg·mL-1五味子乙素的5种不同浓度对照品溶液,进样体积为10 μL,以峰面积(X)对浓度(Y)进行线性回归,五味子醇甲、五味子甲素和五味子乙素的回归方程分别为:Y=6.3×10-5X+8.413 5,r=0.999 9;Y=9.8×10-5X+8.366 4,r=0.999 6;Y=1.0×10-4X+11.285,r=0.999 5。实验结果表明,五味子醇甲在60~300 μg·mL-1,五味子甲素在34~170 μg·mL-1和五味子乙素在36~180 μg·mL-1范围内呈良好的线性关系,3种木脂素对照品与五味子样品HPLC液相色谱图见图1。
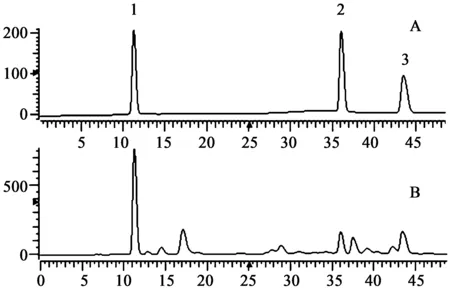
图1 北五味子油脂类成分液相色谱图 A.木脂素标准品; B.超临界提取的五味子种子油脂 1.五味子醇甲;2.五味子甲素;3.五味子乙素
2.4.5方法学考察精密度试验:取同一对照品溶液,连续注入高效液相色谱仪6次,进行分析。五味子醇甲的平均峰面积为2 755 906.56,RSD为1.78%,五味子乙素的平均峰面积为963 119.20,RSD为1.84%,五味子甲素的平均峰面积为715 207.50,RSD为1.65%。结果表明,测定方法精密度良好。
稳定性试验:取同一北五味子油脂供试品溶液,分别在0、3、6、9、12、24 h进样,五味子醇甲的平均峰面积为1 775 850.23,RSD为1.00%,五味子乙素的平均峰面积为769 914.50,RSD为1.42%,五味子甲素平均峰面积为733 284.32,RSD为1.71%。结果表明样品在24 h内稳定。
重现性试验:精密称取同一北五味子种子油脂0.2 g,平行6份,按 “2.4.3” 项下操作,制得供试品溶液,各10 μL 分别注入高效液相色谱仪。计算求得五味子醇甲的平均含量为6.19 mg·g-1,RSD为1.61%;五味子乙素的平均含量为2.57 mg·g-1,RSD为1.58%;五味子甲素的平均含量为3.80 mg·g-1,RSD为1.21%。结果表明,测定方法重现性良好。
加样回收率试验:精密称取已知含量的北五味子种子油脂样品0.1 g,共6份,分别加入等同于样品中五味子醇甲,五味子甲素及五味子乙素含量50%的混合对照品溶液,按供试品项下操作并按含量测定方法进行测定,计算求得五味子醇甲平均加样回收率为101.08% ,RSD为1.88%;五味子乙素平均加样回收率为99.45%,RSD为1.12%;五味子甲素平均加样回收率为99.85%,RSD为0.98%。
样品测定:按上述色谱条件进行分析,以外标一点法分别计算测定五味子醇甲,五味子甲素和五味子乙素含量。
2.5五味子油脂类成分亚油酸测定方法
2.5.1气相色谱条件色谱柱:DB-WAX 毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:100 ℃,维持3 min,以60 ℃·min-1升至180 ℃·min-1,维持4 min,再以20 ℃·min-1升至250 ℃,维持8 min;加热器温度:250 ℃;载气(N2)压力:8.586 8 Psi;进样量:1 μL;分流比:5∶1。
2.5.2样品处理根据“2.1”项下制备方法得到北五味子果实油脂。精密称定北五味子果实油脂9 mg,置于2 mL离心管中,加入300 μL 0.5 mol·L-1氢氧化钾-甲醇溶液,摇匀,置于60 ℃恒温水浴中皂化反应30 min。将皂化反应物冷却至室温,加入600 μL 14%三氟化硼-甲醇溶液,在60 ℃恒温水浴中加热3 min,冷却至室温后,加入600 μL正己烷萃取,上层溶液供气相色谱分析用,样品溶液进样前稀释20倍。
2.5.3标准品溶液配制精密吸取亚油酸对照品8.3 mg,按“2.4.2”项下方法配制20.75 mg·mL-1标准品溶液。
2.5.4线性范围考察精密吸取亚油酸标准品溶液10、20、30、40和50 μL,加正己烷定容至1 mL,配制成亚油酸含量为0.207 5、0.415 0、0.622 5、0.830 0和1.037 5 mg·mL-1的4种溶液,分别精密吸取1 μL进样,以峰面积(A)对浓度(C)进行线性回归,得回归方程:C= 0.000 8A+0.016 9,r=0.998 9。结果表明:在浓度为0.207 5~1.037 5 mg·mL-1范围内,线性范围良好。
2.5.5样品含量测定取亚油酸标准品,北五味子油脂各1 μL进样,检测结果图2。
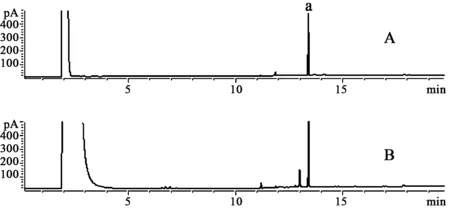
图2 北五味子油脂样品气相色谱图 A.油酸标准品;B.北五味子油脂 a.亚油酸
2.6五味子多酚测定方法
2.6.1Folin-cicalteu′s试剂配制及碳酸钠溶液配制取Folin-cicalteu′s试剂500 μL置于1.5 mL离心管中,精密加入500 μL重蒸水,配制成50%的Folin-cicalteu′s试剂。再取无水碳酸钠粉末适量,加重蒸水配制成质量分数为2%的碳酸钠溶液[3]。
2.6.2对照品溶液的制备精密称取绿原酸适量,置于1 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,配制成含5.0 mg·mL-1绿原酸的标准品溶液。
2.6.3线性关系考察取对照品,加甲醇制成含0、75、100、150、200和500 μg·mL-1绿原酸的6种不同浓度对照品,取上述溶液各30 μL,加入碳酸钠溶液600 μL后,摇匀,静置5 min,再加入30 μL Folin-cicalteu′s试剂,摇匀,静置30 min,750 nm处测吸光度,对吸光度(A)与绿原酸浓度(C)进行线性回归,回归方程分别为:C=9.0×10-4A+0.108 6,r=0.999 5。实验结果表明绿原酸在75~500 μg·mL-1范围内呈良好的线性关系。
2.6.4供试品溶液的制备精密称取北五味子果实粉末0.8 g,置于50 mL具塞锥形瓶,加甲醇20 mL,超声提取40 min(功率250 W,频率40 kHz),补足失重,转速4 000 rpm,离心10 min后吸取上清液,过孔径0.45 μm微孔滤膜,续滤液为供试品溶液[4]。
2.6.5方法学考察精密度试验:取同一对照品溶液连续测定6次,平均吸光度为0.43,RSD为1.24%。结果表明,测定方法精密度良好。
稳定性试验:取同一样品溶液再0.0、0.5、1.0、1.5、2.0、2.5和3.0 h进行测定,平均吸光度为0.53,RSD为1.85%,结果表明样品溶液在3 h内稳定。
重现性试验:精密称取同一产地北五味子粉末0.80 g,平行6份,按供试品项下操作,制得供试品溶液,进行测定,平均含量为70.49 mg·g-1,RSD为1.30%。结果表明,测定方法重现性良好。
加样回收率试验:精密称取已知含量的北五味子样品0.40 g,共6份,分别加入等同于样品中50%总酚含量的绿原酸标准品,按供试品项下操作,制得供试品溶液,进行测定,平均含量为70.98 mg·g-1,RSD为0.97%。
2.7五味子多糖测定方法
2.7.1五味子粗多糖制备[5]见“2.3”项下操作。
2.7.2苯酚溶液的制备取苯酚100 g,加铝片0.1 g和碳酸钠蒸馏,收集180 ℃馏分,吸取此馏分16 mL加蒸馏水200 mL,置于棕色瓶中放冰箱备用。
2.7.3葡萄糖标准溶液制备精密称取无水D-葡萄糖10 mg,定容于1 mL容量瓶中,制成浓度为10 mg·mL-1的葡萄糖标准溶液,分别精密吸取该浓度标准品溶液,配制成浓度为20、40、80、100、120和150 μg·mL-1的标准品溶液。
2.7.4标准曲线的制备精密量取20 μL葡萄糖各标准品溶液,用蒸馏水补足至200 μL,加入100 μL 5%苯酚溶液,混匀后,再加入98%浓硫酸500 μL,混匀后置于40 ℃水浴反应15 min,流水冷却至室温,在紫外可见分光光度计中测定490 nm处的吸光度,以蒸馏水为空白对照,测定3次,取平均值,对吸光度(A)与葡萄糖浓度(C)进行线性回归,回归方程为C=3.9×10-3A+0.033 3,r=0.997 1。
2.7.5方法学考察精密度试验:取同一对照品溶液连续测定6次,平均吸光度为0.49,RSD为1.74%。结果表明,测定方法精密度良好。
稳定性试验:取同一样品溶液再0.0、0.5、1.0、1.5、2.0、2.5和3.0 h进行测定,平均吸光度为0.46,RSD为1.12%,结果表明样品溶液在3 h内稳定。
重现性试验:精密称取北五味子粉末0.8 g,平行6份,按“2.7.1”项下操作,制得供试品溶液,进行测定,平均含量为14.20 mg·g-1,RSD为1.23%。结果表明,测定方法重现性良好。
加样回收率试验:精密称取已知含量的北五味子样品0.4 g,共6份,分别加入等同于样品中50%粗多糖含量的葡萄糖标准品,按供试品项下操作,制得供试品溶液,进行测定,平均回收率为99.21%,RSD为0.89%。
3结果
3.1超临界提取物中木脂素、亚油酸含量及油脂收率北五味子干燥成熟果实粉末中油脂和木脂素提取效率结果如表2所示,超临界提取北五味子果实后,所得到的油脂成分中亚油酸含量约占51.84%,木脂素类成分的含量分别为五味子醇甲58.37 mg·g-1、五味子甲素12.49 mg·g-1和五味子乙素23.55 mg·g-1,3种木脂素含量之和为94.41 mg·g-1。说明通过超临界提取法可以得到以亚油酸为主要成分,同时富含木脂素的油脂类成分。

表2 北五味子果实中亚油酸和木脂素提取效率表
3.2北五味子粗多糖提取率经过提取油脂及多酚成分后的北五味子果实粉末,再运用水提醇沉的方法得到北五味子粗多糖,运用苯酚硫酸法,测定粗多糖得率为3.88%。
3.3响应曲面法优化五味子多酚提取工艺本试验采用Design 8.0.6设计,采用Central Composite设计试验优化最佳提取方法,选取3个主要因素:乙醇浓度、提取时间和溶液倍量作为自变量,以多酚提取率作为响应函数,采用响应曲面法[2],通过回归得出自变量与响应函数之间的统计模型,确定提取北五味子多酚的最佳工艺参数。其中,乙醇浓度、提取时间和溶液倍量分别以A,B,C表示,并以+1.682、+1、0、-1、-1.682分别表示自变量的高、较高、中、较低和低水平,水平及因素编码见表3。

表3 试验因素水平及编码表

表4 得率试验值与模型预测值
续表4:

序号乙醇浓度(%)提取时间(min)倍量(倍)实测值(%)预测值(%)195020350.670.71205020150.740.87
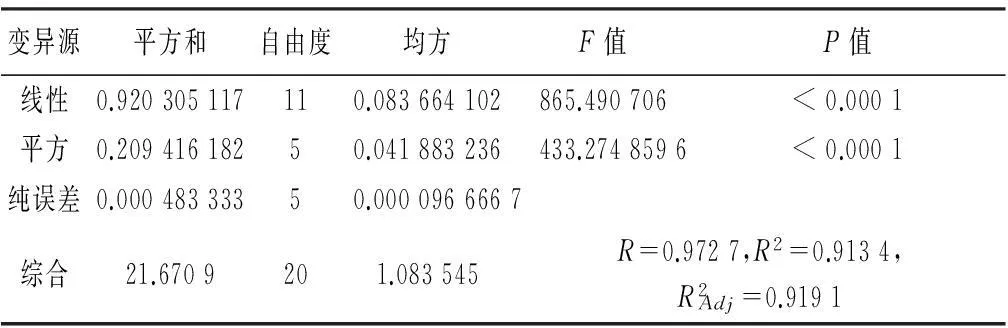
表5 回归模型方差分析
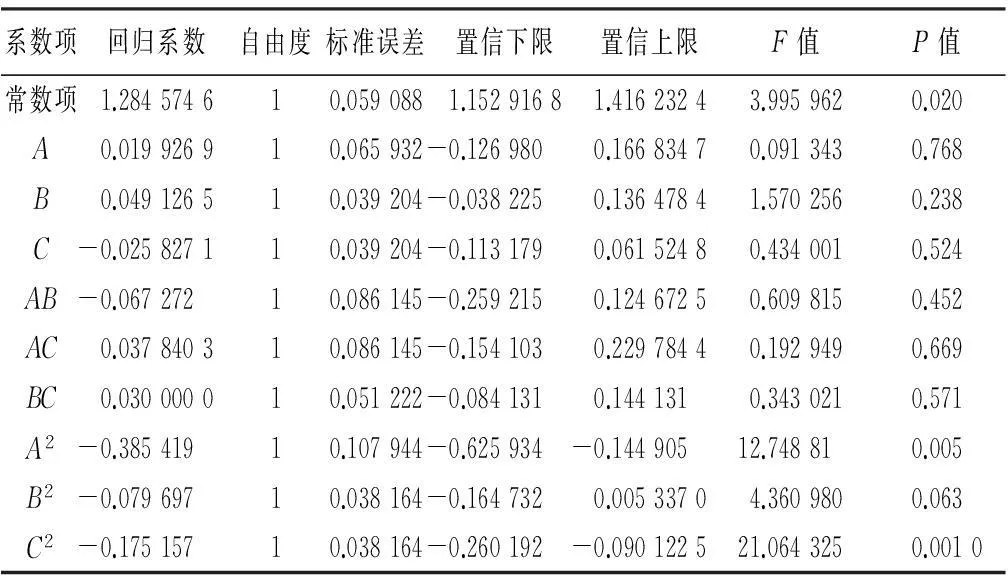
表6 回归方程系数显著性检验
通过对乙醇浓度,提取时间和倍量进行试验优化设计,由表4可知,得到相应的二次方程模型:Y=1.28+0.019A+0.049B-0.026C-0.067AB+0.038AC+0.030BC-0.38A2-0.079B2-0.17C2。
A/B/A2/B2/BC对提取率的影响极显著,由表6可知,C/C2对提取率显著,表明试验因子对响应值不是简单的线性关系,因子间一次项的影响相对较小,而二次项影响较显著。这和回归方程中的二次项影响较为显著一致。因素A、B、C都对提取效率的线性效应显著,因素A2、B2、C2对提取效率的曲面效应显著,AB、AC、BC对提取效率的交互影响显著。
在溶液倍量是25倍时,如图3所示,乙醇浓度和提取时间的交互作用显著,当乙醇浓度不变时,多酚提取率随着提取时间的增加,呈现先增加而后递减的趋势,当提取时间固定时,多酚提取率随乙醇浓度的增加也是先增加而后减小,说明当乙醇浓度和提取时间都处于中间水平时,多酚提取率最高。
在提取时间是30 min时,如图4所示,乙醇浓度和溶液倍量的交互作用显著,当乙醇浓度不变时,多酚提取率随着提取时间的增加,呈现先增加而后减少的趋势,只是变化范围较小,当倍量固定时,多酚提取率随着乙醇浓度的变化,先增加后下降,变化范围远大于倍量,说明,在一定倍量以后,对多酚提取率的影响不大。在两者同时处于中间水平时,多酚的提取效率达到最大。
在乙醇浓度为60%时,如图5所示,提取时间和溶液倍量的交互作用显著,当提取时间不变时,多酚提取率随着溶液倍量的增加,也呈现先增加后下降的趋势,当溶液倍量不变时,多酚提取率随提取时间的变化,先增加而后下降。结果与上文乙醇浓度和溶液倍量的交互作用类似,充分说明溶液倍量是这3个因素中,对多酚提取率影响最小的。
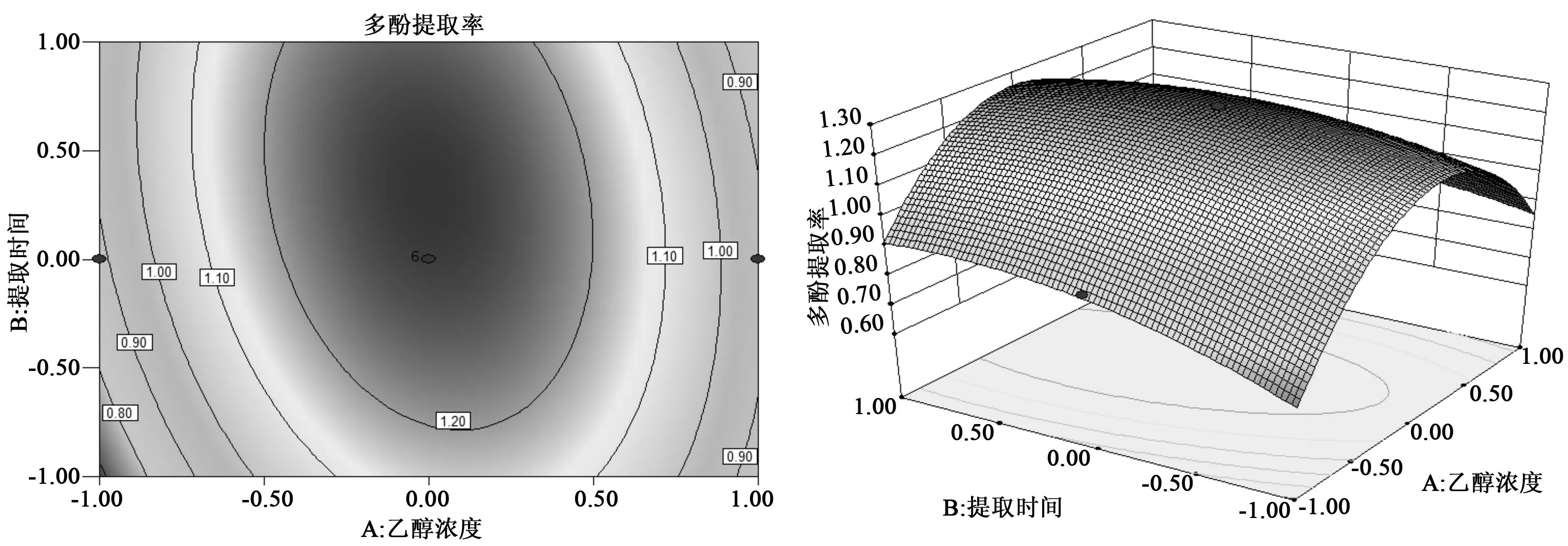
图3 乙醇浓度和提取时间交互影响多酚得率的响应曲面图及等高线图

图4 乙醇浓度和倍量交互影响多酚得率的响应曲面图及等高线图

图5 倍量和提取时间交互影响多酚得率的响应曲面图及等高线图
通过对二次多项式数学模型的解逆矩阵,求出最大多酚提取率的工艺条件是乙醇浓度59%、提出时间31 min和溶液倍量25倍,预测北五味子多酚提取率达到1.28%。为了进一步验证回归模型的有效性,根据得出的最佳工艺参数以及实际操作过程中的可行性进行验证试验,在乙醇浓度59%、提出时间31 min、溶液倍量25倍的条件下,实测得率1.25%±0.03%,与预测值相接近,结果表明该模型具有合理性。
4讨论
研究证明五味子小极性成分具有一定的毒副作用[6,7],这是五味子保健品开发过程中的巨大障碍。对韩国的部分五味子产品进行了检测,结果表明,这些产品中仅含有微量的醇甲,其他的小极性木脂素更是微乎其微。另外,在这些产品中均发现了520 nm下的吸收峰,以及明显的五味子辛香气和酸涩口感,这些现象表明,国外五味子开发过程中所应用的提取部位不含或含有很少的木脂素类成分,借鉴这一特点,对五味子的提取工艺进行了以上优化,将五味子提取物多样化,药品生产可用油脂和木脂素提取部位,保健品生产可用多酚与有机酸部位以及多糖部位,当然,之前必须要有相应的毒理与药效学评价。这一提取工艺在国内外尚未系统见报道,我们对其进行了专利申请保护(专利号:ZL201210456113.3)。
通过超临界提取法得到的北五味子油脂类成分具有环保,提取率高,无有机溶剂残留等优点,而且其中亚油酸含量为58%,三种主要木脂素类成分含量高达9.4%以上,该油状提取物中还有其他木脂素,因为对照品缺乏,未对其进行定量,因为都为同类型木脂素,我们对其进行了粗略估计,以醇甲计,油状物中总木脂素含量约为20%,远高于目前市面上的五味子提取物中木脂素含量(总木脂素含量为2%~9%),且杂质类成分干扰少,可开发为多种剂型。
采用响应曲面法优化北五味子多酚提取工艺,是为了确定最佳提取工艺,并且与正交试验相比,响应曲面法可以给出全面的数据以供评价研究。通过分析发现,影响北五味子多酚提取效率的主要因素是乙醇浓度和提取时间,而倍量影响相对较小,说明在中试生产中,可以重点优化前两者的条件,而倍量只要在适量的范围内即可。
已经提取过油脂和多酚的北五味子粉末,然后再提取得到粗多糖的得率为3.88%。与之前果实直接提取的粗多糖得率相比有所减少,分析原因可能与提取多酚的溶剂、溶剂转移和容器残留等方面有关系,但是考虑到北五味子果实已经提取过油脂和多酚,因此粗多糖得率是在合理范围内。
由于人们对北五味子中药材资源的不重视,导致北五味子野生资源的不断减少,如何有效地利用现有资源是目前发展中药产业的一大问题[8]。同时,也有很多关于五味子在抗HIV和抗肿瘤[9]、抗老年痴呆[10]的研究,其应用前景非常乐观。与以前单一考察某一类成分的提取效率相比,综合地把北五味子果实中每一步提取之后的残渣再提取一次,得到其中的主要成分,这样既可以节约成本,又有利于二次开发北五味子资源。
参考文献:
[1] 国家药典委员会.中华人民共和国药典2010年版(一部)[S].北京:中国医药科技出版社,2010:61-62.
[2] 徐卫东,王佩香,欧阳臻,等.响应曲面法优化桑枝多糖提取工艺[J].中国药房,2011,22(43):4064-4067.
[3] 郭志欣,顾地周,宋宇辉,等.五味子药渣中多糖提取工艺研究[J].江苏农业科学,2013,41(5):254-255.
[4] 赵丰丽,张云鸽,庞冠兰.柿叶多酚测定条件及其抗氧化活性的研究[J].中国实验方剂学杂志,2012,18(11):173-176.
[5] 陶移文,田庚文,张文峰.比较两种提取方法对元胡粗多糖制备及理化性质的影响[J].海南医学院学报,2011,17(1):17-20.
[6] 何来英,冯晓莲,孙明,等.五味子的急性毒性和遗传毒性研究[J].实用预防医学,2004,11(4):645-648.
[7] 陈晓铭,谢珣,孙晶晶,等.五味子与远志醇提物的急性毒性和益智药效研究[J].实用预防医学,2006,13(4):807-809.
[8] 高剑锋,刘春山.五味子药材资源的研究概况[J].中国医药指南,2010,8(18):66-69.
[9] Hwanga DS,Shin SY,Lee YN,et al.A compound isolated fromSchisandrachiensisinduces apoptosis[J].Bioorg Med Chem Lett,2011,21(20):6054-6057.
[10] Hu D,Li C,Han N,et al,Deoxyschizandrin isolated from the fruits ofSchisandrachinensisameliorates Aβ1-42-induced memory impairment in mice[J].Planta Med,2012,78:1332-1336.

