穿膜肽介导紫杉醇脂质体对肿瘤的治疗作用
穿膜肽介导紫杉醇脂质体对肿瘤的治疗作用
赵海伟,何伟,尹莉芳
(中国药科大学药学院药剂教研室,江苏 南京 210009)
摘要:目的制备和表征F3修饰紫杉醇脂质体,并进行细胞学和体内抗肿瘤评价。方法 采用薄膜分散法制备脂质体,人肺腺癌细胞A549进行摄取评价;小鼠肝癌细胞H22荷瘤小鼠进行体内抗肿瘤活性评价。结果F3修饰脂质体粒径为90 nm;该修饰后脂质体被细胞摄取能力明显增强,进而提高了药物的抗肿瘤活性,给药16天后,F3-Lipo组瘤体增长仅为11倍,相比于生理盐水组26倍,Taxol 18倍,未修饰脂质体14倍,有更好的抗肿瘤效果。结论F3穿膜肽可以明显提高载体入胞能力,进而改善药物治疗作用。
关键词:穿膜肽;脂质体;紫杉醇;细胞摄取;抗肿瘤
基金项目:国家自然科学基金(No.81473152)
作者简介:赵海伟,女,硕士研究生,研究方向:缓控释制剂的开发与研究,E-mail:zhaohw322@163.com
通讯作者:尹莉芳,女,教授,博士生导师,研究方向:药物新剂型与新技术,Tel:025-83271018,E-mail:lifangyin_@163.com
中图分类号:R944.9文献标识码:A
Therapeutic ation of paclitaxel liposome mediated by penetrating peptides on tumor
ZHAOHai-wei,HEWei,YINLi-fang
(DepartmentofPharmaceutics,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Abstract:ObjectiveTo prepare and exosyndrome F3 modified paclitaxel liposome and evaluate the cellular uptake and antitumor activities.Methods The liposomes were prepared by film-dispersed method;The studies of cellular uptake and antitumor activities were performed in A549 cells and H22-bearing mice,respectively.ResultsThe F3 modified liposomes with a diameter size of around 90 nm were uptaken by cells and thus had better antitumor activities.Conclusion F3 penetrating peptides could enhance the cellular uptake and thus improve the therapeutic outcome of drugs.
Key words:Penetrating peptides;Liposomes;Paclitaxel;Cellular uptake;Antitumor activities
据统计,到2030,全球每年的癌症新增病例将超过1千万,癌症相关患病人数将达1.2千万。肿瘤已经成为威胁人类健康的头号敌人[1]。近年来,新型微粒递药系统如脂质体、纳米乳、聚合物胶束等显示了其在肿瘤治疗领域的独特治疗优势。因为该类系统不仅可以通过增强渗透滞留效应(Enhanced Permeability and Retention effect,EPR效应)增加药物在病灶的蓄积,还可以明显降低药物对正常组织的毒性[2~7]。
脂质体(Liposome,Lipo)是由天然的或合成脂质通过自组装形成的具有闭合结构的双分子囊泡[7]。该类载体由于其构成与细胞膜相似,因而具有理想的生物相容性。与其他载体相比,Lipo不仅适合包载难溶性药物,对水溶性药物也具有很好的包封作用。由于Lipo具有完全闭合的结构,可以明显提供药物的稳定性[8]。
细胞穿膜肽是目前国际研究最为热门的靶基,主要因为穿膜肽不仅自身能透过多种细胞膜,而且还可有效携带比其相对分子质量大100倍的外源性疏水大分子进入活细胞,这种高效率的细胞穿膜肽对宿主细胞没有显著毒副作用。但是,普通穿膜肽对正常组织也有很强的穿透性,不但降低其载体对肿瘤的靶向性,同时也会导致药物在正常组织蓄积进而引起毒副作用。核仁蛋白,是一组穿梭于细胞表面与细胞核之间的蛋白,它在各种肿瘤细胞表面及肿瘤新生血管内皮细胞均高表达,但只存在于正常细胞的细胞核,由于对肿瘤新生血管及肿瘤细胞的有效性与特异性双重靶向及其高效的细胞内化,使其成为一个极具吸引力的靶点。 含31个氨基酸的小肽F3(CKDEPQRRSARLSAKPAPPKPEPKPKKAPAKK)能特异性识别细胞表面的核仁素蛋白,并从细胞表面有效转运至细胞核;同时,F3对肿瘤组织有很强的穿透力,介导载体深入瘤体内部,有效增加药物在病变部位的蓄积[9]。
PTX是临床最常用的广谱抗癌药物之一。目前,紫杉醇是唯一能促微管聚合的药物,通过稳固微管,阻碍纺锤体形成,使得染色体向两极移动,进而将分裂细胞周期阻滞于G2/M期[10,11]。此外,PTX还有诱导细胞凋亡、激活免疫系统、诱导肿瘤坏死因子TNF-α生成等功能。但PTX的用药依然面临以下问题[12,13]:①在水中的溶解度极低,致使其给药困难;②普通给药方式不具备靶向性,除了导致药物在靶部位无法有效蓄积外,也会大量分布至其它正常组织和器官,进而导致很大的毒副作用。因此,本研究旨在利用F3对肿瘤的靶向性,构建F3修饰PTX脂质体(F3-Lipo),进而提高PTX对肿瘤的治疗作用,降低毒性。
1材料与方法
1.1试剂与细胞株紫杉醇(Taxol)(批号:20130901,江苏红豆杉药业有限公司);F3(上海吉尔生化有限公司);胆固醇(中国慧兴生化试剂有限公司);大豆磷脂S100PC(790636-09/901,德国LIPOID);甲氧基化聚乙二醇二硬脂酸磷脂酰乙醇胺(mPEG-DSPE),马来酰亚胺化聚乙二醇二硬脂酸磷脂酰乙醇胺(Mal-PEG-DSPE),均购自美国Avanti polar lipids公司;甲醇(色谱纯,上海凌峰化学试剂有限公司);氯仿(分析纯,上海凌峰化学试剂有限公司);胎牛血清 (浙江天杭生物科技有限公司);RPMI1640 培养基(美国Hyclone公司);胰蛋白酶(美国Hyclone 公司);磷酸盐缓冲液PBS(美国Hyclone 公司);H22和A549细胞株(南京凯基生物科技发展有限公司);雄性ICR小鼠(18~22 g,扬州大学比较医学中心 [许可证号:SCXK(苏) 2012-0004];香豆素-6(C-6)(美国西格玛奥德里奇公司)。
1.2仪器精密电子天平(德国赛多利斯有限公司);KQ-200KDE超声波清洗器(昆山舒美超声仪器有限公司);RE52CS旋转蒸发仪(上海亚荣生化仪器厂);Zetasizer Nano ZS粒径测定仪(英国Malvern 仪器公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市裕华有限责任公司);DZF-6020 型真空干燥箱(上海一恒科技有限公司);TGL-16B 台式高速离心机(上海安亭科学仪器厂);超净工作台(美国Thermo有限公司);CO2培养箱(上海跃进有限公司);流式细胞仪(FACSCalibur,美国碧迪公司)。
1.3F3修饰脂质体制备与表征导向肽合成:按F3:DSPE-PEG-Mal=1.2∶1(mol/mol)的比例投料,F3溶于3 mL脱气pH 7.4的PBS缓冲液中,DSPE-PEG-Mal溶于1 mL的二甲基亚砜DMSO中,再将DMSO溶液慢慢加入PBS溶液中,吹氮气除去空气,氮气氛下冰浴下反应24 h。反应完后,产物移进透析袋(MWco=5 000),冰浴透析24 h,其间前面22 h用PBS透析液,后2 h换成纯净水透析。
采用薄膜分散法制备F3-Lipo。制备过程为:将大豆磷脂∶胆固醇∶PTX∶mPEG-DSPE∶导向肽(按摩尔比为9∶1∶0.3∶0.5∶0.1)溶于氯仿甲醇混合溶剂中;35 ℃减压旋蒸2 h,抽真空过夜,35 ℃下PBS水化30 min,冰浴下探头超声5 min。载探针C-6脂质体(C-6-Lipo)同法制得。
1.4细胞摄取生长良好的A549细胞消化离心后,吸弃上层废液,加入新RPM1640培养基,计数,再以105·cm-2的密度接种于24孔板,于5% CO2培养箱中37 ℃培养24 h。
不同时间摄取:吸去培养基后,加入900 μL新培养基,加入相同浓度(高浓度)的C-6-Lipo或F3-Lipo,在37 ℃下孵育0.5、1、2、4 h,弃去废液,加入PBS液体清洗3次,加入50 μL胰酶消化1 min,加入200 μL PBS停止消化,吹打分散细胞,流式细胞仪绿色荧光通道下检测。
不同温度和浓度摄取:吸去培养基,加入900 μL新培养基,分别加入100 μL高、低浓度的C-6-Lipo或F3-Lipo,在37 ℃或4 ℃孵育2 h后弃去上层液体,PBS清洗2次后荧光显微镜下观察高低浓度下的荧光强弱。最后利用流式细胞仪进行定量测定。
1.5体内抗肿瘤活性H22细胞传小鼠腹水,一周后,将腹水鼠处死,从腹腔处抽腹水,移入15 mL离心管中离心,将上层液体移去,加入生理盐水清洗细胞,重复2次,移去上清液,加入生理盐水,计数,按照计数结果,将细胞稀释至1×107·mL-1,再以每只小鼠200万量接于小鼠腋下。待瘤体长到1 cm3大小时开始给药。荷瘤小鼠随机分成4组,每组7只,分别为生理盐水组、PTX注射液(Taxol)组、PTX-Lipo组和F3-PTX-Lipo组,PTX剂量为10 mg·kg-1。尾静脉给药,并分别测量小鼠瘤体大小。每3天给1次药,每2天测量瘤体大小。
1.6统计学分析 数据用平均值±SD值表示,P<0.05时具有显著性差异。
2结果
本文采用了薄膜分散法制备F3-Lipo和普通长循环脂质体。制备得到的脂质体粒径约为90 nm,且多分散系数小于0.2,说明体系粒径分布较窄(见图1)。进一步通过透射电镜检测表明(见图1),所得粒子为球形,粒径在50~100 nm范围内,与光散射测定结果基本一致。
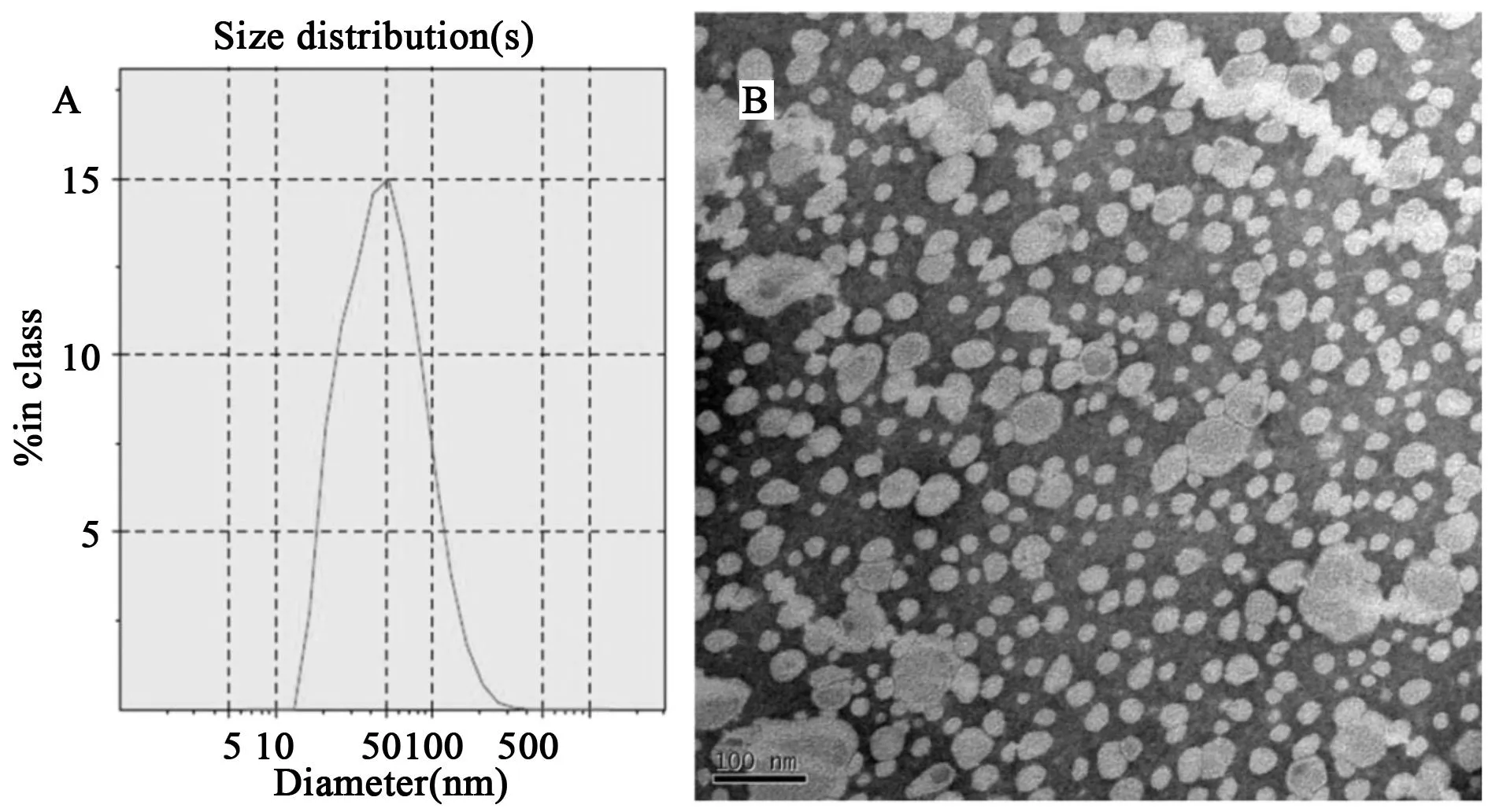
图1 F3修饰脂质体的表征 A.粒径及粒径分布;B.透射电镜扫描
荧光探针C-6包载的F3-Lipo和Lipo在A549细胞中的摄取见图2。A549对F3-Lipo或Lipo的摄取随着时间增加,摄取量增加;F3-Lipo或Lipo两者相比,前者的摄取量在2 h后,A549对脂质体的摄取量明显增加,表明F3穿膜肽可以明显增加载体的内化作用,提高载体被细胞摄取的能力。
在4 ℃和37 ℃条件下,高低浓度C-6包载的F3- Lipo和Lipo在A549细胞中的摄取见图3。在两种温度下,A549细胞对F3-Lipo或Lipo的摄取与浓度为正比关系,增加浓度,摄取量增加;同时也观察到,细胞对F3-Lipo的摄取量明显大于Lipo。

图2 普通脂质体及F3修饰脂质体在不同时间点的细胞摄取量

图3 普通脂质体及F3修饰脂质体在不同温度下的细胞摄取
包载PTX的F3- Lipo和Lipo或市售产品Taxol的H22荷瘤小鼠体内的抗肿瘤活性见图4。按照PTX剂量为10 mg·kg-1连续给药16天后,瘤体体积增长倍数为生理盐水组26倍,Taxol 18倍,未修饰Lipo 14倍,F3- Lipo 11倍,表明PTX制剂确实能明显抑制肿瘤生长(P<0.05);但制剂不同,其抗肿瘤效果差异明显。其中脂质体与游离药物相比,前者能进一步抑制肿瘤生长。当脂质体进一步被穿膜肽F3修饰后,其抗肿瘤作用进一步增强。

图4 H22荷瘤小鼠的肿瘤大小变化
3讨论
本文成功制得了F3修饰PTX脂质体。在F3的介导下,PTX脂质体被细胞摄取的能力明显增强,特别的是,在4 ℃条件下,细胞对高浓度的F3-Lipo同样具有很好的摄取能力。一般而言,在低温条件下(4 ℃),由于细胞膜的难变形的特点,细胞对纳米粒的摄取能力非常弱[14]。这就提示,一部分F3-Lipo有可能通过非经典内吞作用进入细胞[15]。
经F3修饰PTX脂质体后,制剂的抗肿瘤效果也增强了,主要是因为:①F3具有较强的肿瘤穿透作用。在F3的介导下,脂质体可以进一步渗透进入瘤体内部[16];②F3与肿瘤细胞核仁素受体结合作用。脂质体表面的F3与细胞高表达的特异核仁素受体结合,进一步增强载体的入胞作用;特别是从图3可知,F3有可能使得脂质体能绕过溶酶体-内涵体系统直接进入胞浆,有利于PTX发挥药效(因为药物的作用位点位于细胞浆)。总之,F3的介导能明显改善载体的抗肿瘤作用。
参考文献:
[1] Alzahrani B,Iseli TJ,Hebbard LW.Non-viral causes of liver cancer:Does obesity led inflammation play a role? [J].Cancer Lett,2014,345(2):223-229.
[2] Ashley CE,Carnes EC,Phillips GK,et al.The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers[J].Nat Mater,2011,10(5):389-397.
[3] Biswas S,Torchilin VP.Nanopreparations for organelle-specific delivery in cancer[J].Adv Drug Deli Rev,2014,66:26-41.
[4] HeW,LuY,Qi J,et al.Food proteins as novel nanosuspension stabilizers for poorly water-soluble drugs[J].Int J Pharm,2013,441(1-2):269-278.
[5] He W,Lu Y,Qi J,et al.Nanoemulsion-templated shell-crosslinked nanocapsules as drug delivery systems[J].Int J Pharm,2013,445(1-2):69-78.
[6] He W,Lu Y,Qi J,et al.Formulating food protein-stabilized indomethacin nanosuspensions into pellets by fluid-bed coating technology:physical characterization,redispersibility,and dissolution[J].Int J Nanomedicine,2013,8:3119-3128.
[7] Zhang X,Qi J,Lu Y,et al.Biotinylated liposomes as potential carriers for the oral delivery of insulin[J].Nanomedicine:NBM,2014,10(1):167-176.
[8] Torchilin VP.Recent advances with liposomes as pharmaceutical carriers[J].Nat Rev Drug Discov,2005,4(2):145-160.
[9] Hu Q,Gu G,Liu Z,et al.F3 peptide-functionalized PEG-PLA nanoparticles co-administrated with tLyp-1 peptide for anti-glioma drug delivery [J].Biomaterials,2013,34(4):1135-1145.
[10] Baird RD,Tan DS,Kaye SB.Weekly paclitaxel in the treatment of recurrent ovarian cancer[J].Nat Rev Clin,Oncol,2010,7(10):575-582.
[11] Bernabeu E,Helguera G,Legaspi MJ,et al.Paclitaxel-loaded PCL-TPGS nanoparticles:In vitro and in vivo performance compared with Abraxane?[J].Colloid Surface B,2014,113:43-50.
[12] Koudelka S,Turanek J.Liposomal paclitaxel formulations [J].J Control Rel,2012,163(3):322-334.
[13] Auzenne E,Ghosh SC,Khodadadian M,et al.Hyaluronic acid-paclitaxel:antitumor efficacy against CD44(+) human ovarian carcinoma xenografts[J].Neoplasia,2007,9(6):479-486.
[14] Liu C,Yao W,Zhang L,et al.Cell-penetrating hollow spheres based on milk protein[J].Chem Commun(Camb),2010,46(40):7566-7568.
[15] Zhang Z,Cao W,Jin H,et al.Biomimetic nanocarrier for direct cytosolic drug delivery[J].Angew Chem Int Ed Engl,2009,48(48):9171-9175.
[16] Winer I,Wang S,Lee YE,et al.F3-targeted cisplatin-hydrogel nanoparticles as an effective therapeutic that targets both murine and human ovarian tumor endothelial cells in vivo[J].Cancer Res,2010,70(21):8674-8683.

