pH -电位图原理在环境化学应用中的探讨
pH-电位图原理在环境化学应用中的探讨
韩湘才廖海波
(衡阳市环境监测站,衡阳 421001)
摘要:简要介绍了pH -电位图结构原理和方法,对pH-电位图研究重金属Hg、Cd、Cr、As及S在水环境、土壤环境中的行为等环境化学方面的应用进行了探讨,为深入研究pH-电位图原理在环境化学中的应用,分析重金属及硫化物在天然水体及土壤环境中的迁移、转化、演变规律,建立水化学和土壤环境化学的完整理论提供参考依据。
关键词:pH-电位图原理;氧化还原电位;活度;反应自由能
作者简介:韩湘才,男,本科,从事环保分析工作15年。
DOI:10.3936/j.issn.1001-232x.2015.01.020
收稿日期:2014-06-27
Application of pH-potential mapping in environmental chemistry.HanXiangcai,LiaoHaibo.(HenYangEnvironmentalMonitoringCentre,HenYang421001,China)
Abstract:This paper introduces the application of PH-potential diagram, which is used to study the behavior of heavy metals (Hg, Cd, Cr, As) and S in water and soil environment.
Key words:PH-potential diagram principle, redox potential, activity, reaction free energy
pH-电位图在湿法冶金领域中的广泛应用已为人们所熟知,应用pH-电位图来研究重金属与土壤氧化还原条件的关系及水体中重金属的稳定性等环境化学的有关问题,根据重金属-H2O系及MeS-H2O系pH-电位图,结合硫-H2O及pH-电位图并估计某些重金属形成硫化物的条件和可能性,从而了解其在环境中的行为,为控制重金属对天然水体及土壤的污染及危害提供理论依据显得日益重要。本文介绍了pH -电位图结构和方法,应用pH-电位图分析硫及重金属在水环境和土壤环境的行为。
1pH-电位图的结构原理
任何一种溶液中总含有氢离子,并且和各种不同的金属离子在热力学上保持着一定的平衡关系。氧化还原反应进行的方向及限度取决于有关物质得失电子的难易程度,即相应半电池的电极电位。
水溶液中的化学反应具有如下三种类型。
(1)有电子迁移而无H+参于的氧化还原反应
aA+ne=bB
其反应的电极电位为:
(1)
式中:Eh―电极电位(V),
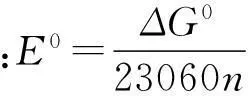
(2)无电子迁移,而离子活度只与pH有关的反应
aA+mH+=bB+cH2O
(2)
(3)有电子迁移,而E0与pH有关的氧化―还原反应。
aA+mH++ne=bB+cH2O
25℃时,反应的电极电位为:
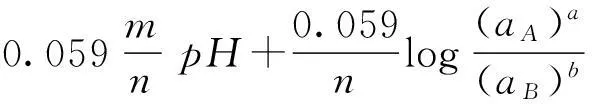
(3)
根据化学平衡的原理,可按以下几个步骤绘制研究体系给定条件下的pH -电位图:
Ⅰ确定体系可能发生的各类反应及其中每个反应的平衡方程式;
Ⅱ利用参与反应的各组分的热力学数据计算反应的ΔG0,从而求得反应的平衡常数K或标准电极电位E0;
Ⅲ根据上述通式导出体系中各个反应的电极电位Eh及pH的计算公式;
Ⅳ根据及pH的计算公式,在指定离子活度或气相分压的条件下,算出各个反应在一定温度下的E0与值;最后表示在以E0为纵坐标和以pH为横坐标的图上。
上诉三种反应类型在pH-电位图上分别呈现图1(a)、(b)、(c)所示的不同线性。
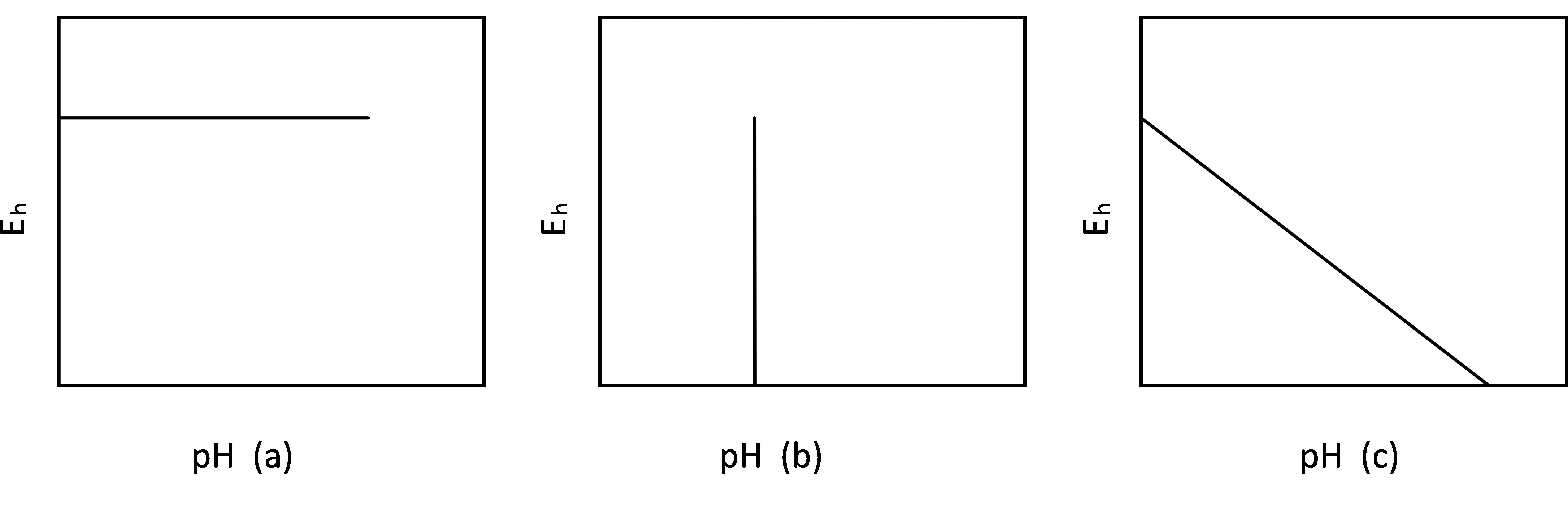
图1 pH -电位图三种类型平行线
由图1可知,在pH-电位图中三种类型的平衡线斜率是不同的。第(1)类反应由于没有H+离子参与,平衡线是一条与pH坐标平行的水平线,斜率为零;第(2)类反应由于没有电子转移,反应的平衡与E0无关,平衡线是一条与Eh坐标平行的垂直线,斜率为无穷大;第(3)类反应的平衡既与Eh有关又与pH有关,因而在pH-电位图上是一条斜线,斜率为-2.303RT.m/23060n。
常见的pH-电位图都是在指定有关物质活度时作出的,显然,这些平衡线的位置将随着有关物质的活度的改变而改变。对第(1)类平衡线而言,当A物质活度降低时,水平线向下平移,对于第(2)类平衡线而言,当A物质的活度降低时,垂直线向右平移。
2 水的热力学稳定区
水的热力学稳定区域对判断各种物质与水发生相互作用的可能性提供了理论依据,同时它又是pH-电位图的组成部分。
水溶液中存在着氢离子和氢氧离子以及水分子。在给定条件下,如果水溶液中有电极电位比氧电极电位更正电性的氧化剂存在,水就可能被氧化,在酸性介质中决定于电化学反应O2+4H++4e=2H2O或碱性介质中决定于化学反应O2+2H2O +4e=2 OH-的氧电极电位可以下式表示:
Eh(O2/OH-)=1.23-0.059 pH +0.015 l og PO2
(4)
如果溶液中有电极电位比氢电极电位更负的还原剂存在,还原过程就可能发生。在酸性介质中决定于化学反应2H++2e=H2或者在碱性介质中决定于电化学反应2 H2O++2e=H2+2 OH-的氢电极电位(25℃)可以下式表示:
Eh(H+/ H2)=-0.059 pH -0.029 l og PH2
(5)
根据方程(4)、(5)在PO2和PH2各等于1大气压的条件下氢电极电位与氢电极电位与溶液的pH分别有如图2所示的直线①和②的关系。这两条直线把整个pH -电位图分成了Ⅰ、Ⅱ、Ⅲ三个区域[1]。
在①线之上发生氢氧根的氧化4O-→2H2O+O2+4e,因此,在①线之上区域,水不稳定,要分解析出氧。在线②以下,因为电位比平衡电位为负,发生H+离子还原,H++e→1/2H2,②线以下的区域,水也是不稳定的,要分解析出氢。在①线以下的区域,电位比平衡电位为负,发生氧还原为氢氧根O2+2H2O +4e图2水的热力学稳定区→4 OH-,在②线以上,电位比平衡值为正,则发生氢的氧化,H2→2H++2e,可见在①线和②线包括的范围内,水是稳定的。
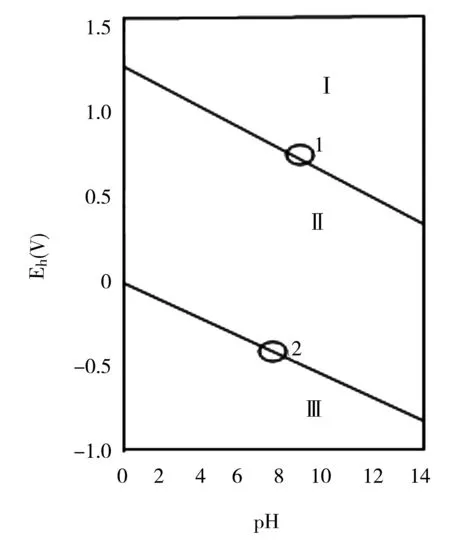
图2 水的热力学稳定区
3土壤pH-电位图
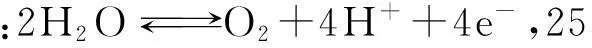
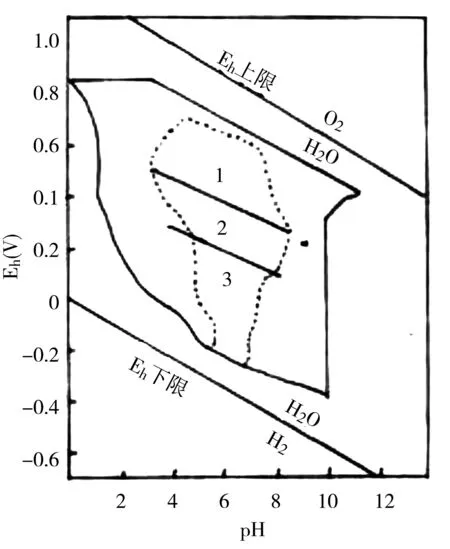
图3 土壤pH -电位图 1.旱地土壤 2.潮湿土壤3 .水分过饱和土壤
4天然水体及土壤环境中的硫行为
硫—H20系主要有以下反应:
(6)
pH=1.9(25℃时)
(7)
pH=7.0
(8)
pH=12.6
(9)
Eh=0.357-0.079 pH+0.0098 log [SO42-]
(10)
Eh=0.338-0.069 pH+0.0098 log [HSO42-]
(11)
(12)
Eh=0.142-0.059 pH -0.0295 log [H2S]
(13)
(14)
根据以上9个反应的pH-电位图关系式可绘出25℃,总硫为10-3M时的pH-电位图(图4)。从图4可看出,有一个素硫的稳定区。但当H2S浓度降低(12)式的电位变正,SO42-或HO42-浓度降低,(9)、(10)式的电位变负时,硫的稳定区缩小,最后消失到SO42-,HSO42-与H2S的界面。当绘制10-3M琉璃子浓度溶液的pH-电位图时可看出这一点。当pH<1.9时,电位下降,HSO42-还原为元素S,电位进一步下降时还原成H2S;电位上升时H2S先氧化成S,再氧化成HSO4-;pH在1.9至5.4范围内,电位下降时,SO42-还原成元素S,再还原为H2S;反之电位上升时,H2S氧化成S再氧化成SO42-。pH>7时,电位下降时SO42-还原为HS_,电位上升时HS_氧化成SO42-。
从图4可见,天然水体的pH,Eh范围位于SO42-的稳定区,天然水体中硫是以SO42-形式存在的。S2-是不稳定的,进入水体中的S2-很快被氧化SO42-。对天然水体的监测结果证实了这一点。在沉积物中,由于氧化还原电位较低,硫则多以金属硫化物的形态存在,有利于水体的净化。
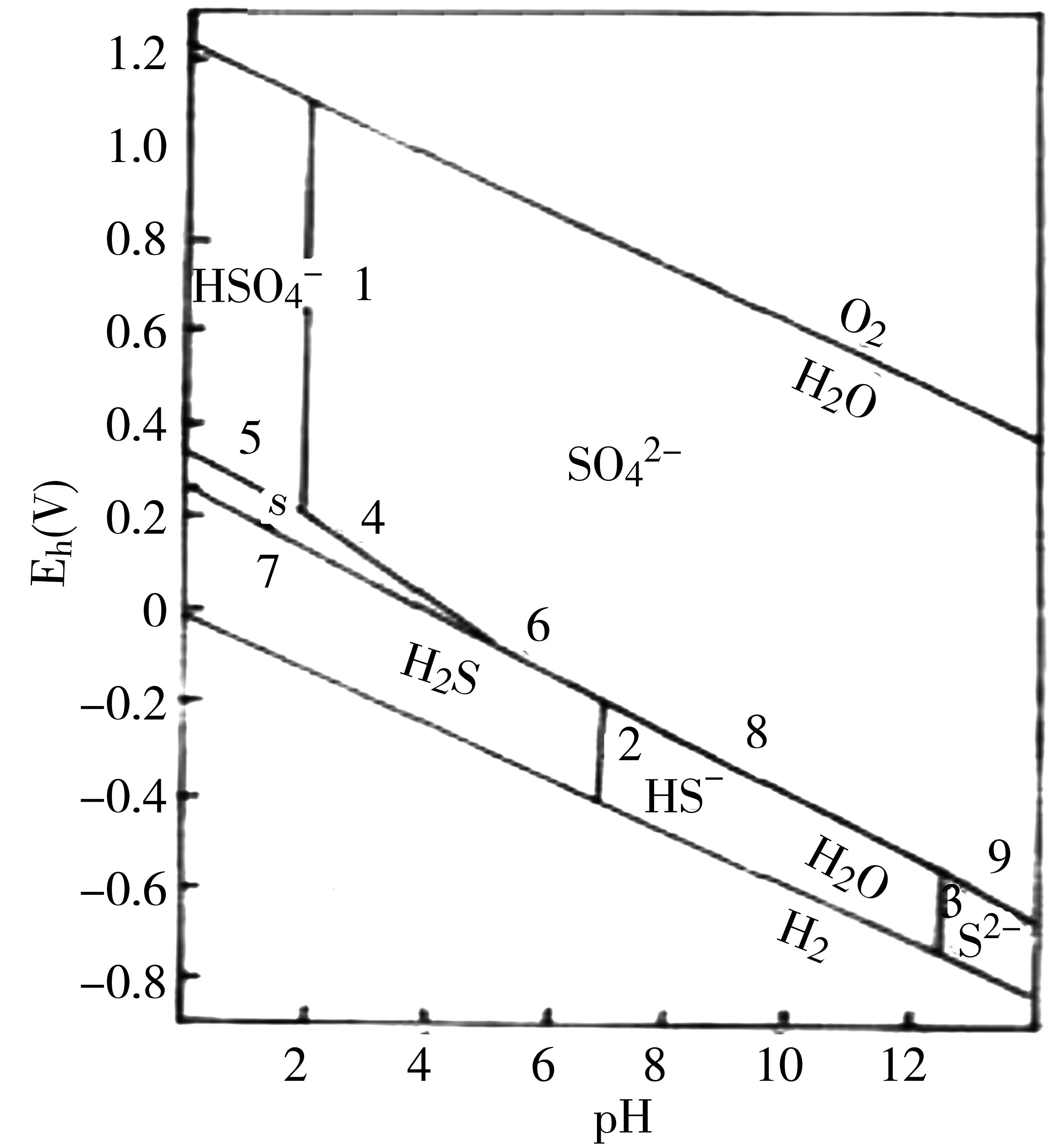
图4 硫的pH电位图 总硫为10 -3M
土壤中的硫对重金属的迁移和转化有重要意义。土壤中硫的含量一般为0.05%,以无机硫和有机硫两种形态存在,有机硫经微生物分解和矿化后,形成硫和多硫化物,在氧化条件下,形成硫酸盐形态,在较强的还原条件下,即成为硫化氢或金属硫化物。
5重金属及硫化物在天然水体及土壤环境中的行为
天然水体的pH和Eh是控制和影响水体重金属稳定性最重要的环境因素。天然水体的氧化还原电位与水体pH密切相关。通常,沉积物/水界面的Eh梯度控制着水体重金属形态的变化,一般与大气压接触的表层水多呈氧化态,其Eh可为+300~+600mV,而沉积物则多为弱氧化态以至强还原态,其Eh为+100~-400mV。表层沉积物/水界面多呈弱氧化态,而深层沉积物则多处于还原态。水体pH的变化影响天然水体中各结合态金属的化学稳定性及金属的平衡分布状态。一般天然水体pH变化范围较大,可为5.0~8.0,沉积物pH与水体相关,表层沉积物通常为6.1~9.0,深层略低些[3]。
土壤环境中,成分复杂,化学反应枞横交错,重金属含量甚微却呈现多种化合态,参与多种化学反应。难以详细描述其化学行为。我们借鉴较单纯的水溶液pH-电位图,推断土壤溶液中重金属化学行为。
重金属作为过渡元素在天然水体和土壤环境的不同条件下,价态变化是通过氧化还原反应实现的,反应方向由环境的氧化还原特性所支配。现以Hg、Cd、Cr、As、S为例,Hg、Cd、Cr、As等能形成难溶性的化合物,固定于沉积物或土壤中,反之转化为氧化条件时,则增加了它的可溶性,As等则完全相反。
5.1 汞的行为
汞的pH-电位图(25℃)见图5。从图5可见,汞在水溶液中的价态为Hg2+、Hg22+、 Hg0(金属汞)。在还原区域中,不但可形成硫化物的沉淀物,而且还可还原成金属汞。当溶液中Cl-的浓度增大时,则HgCl2的区域增大,如图中虚线所示。
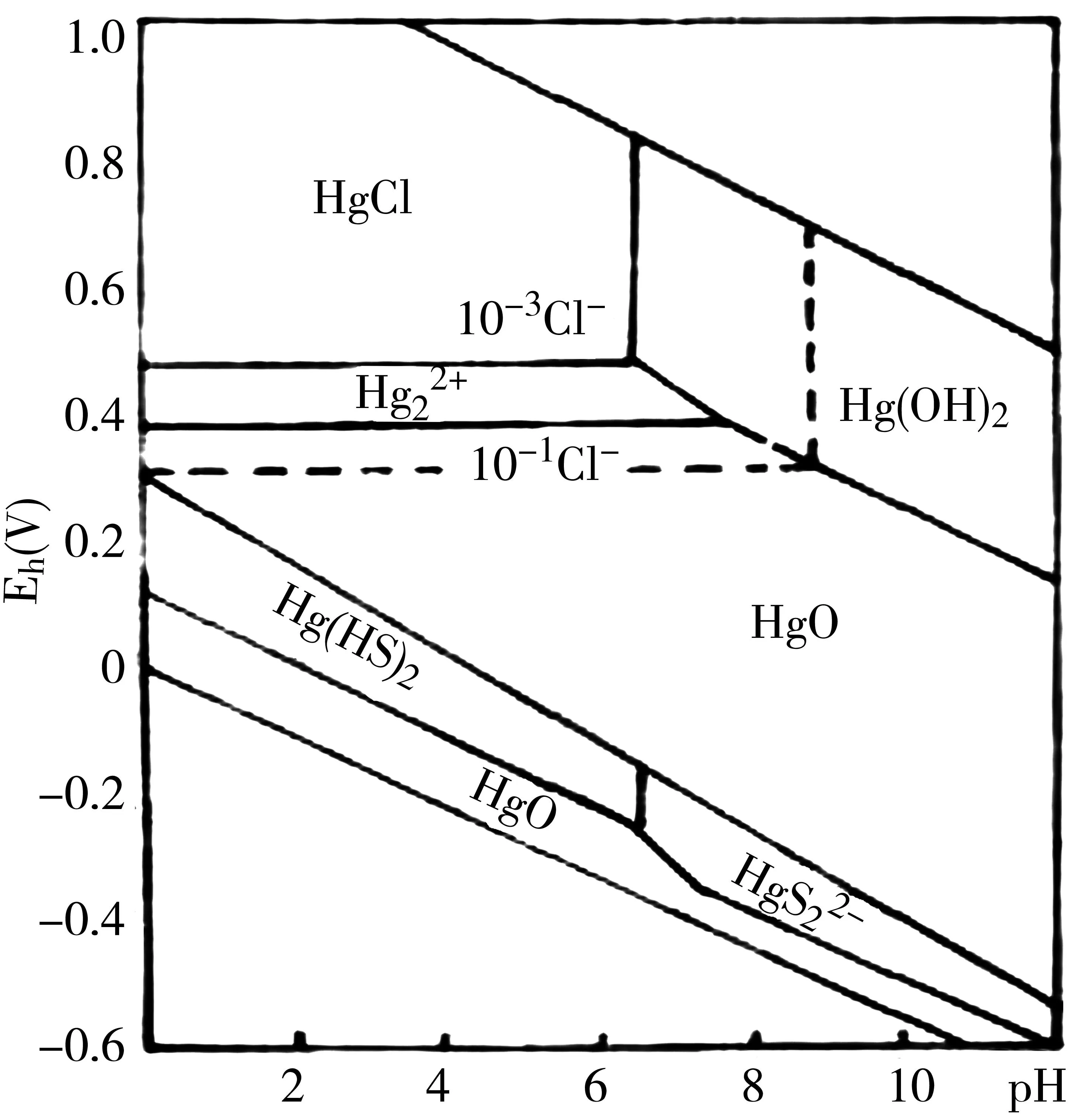
图5 汞的pH电位图 25℃,1大气压[SO 4]-10 -3M[Cl]-10 -3M
天然水体中,含汞极少,一般不超过0.1μg/L,根据其PH. Eh范围可知,汞以Hg0或Hg2+的形式存在,电位下降,Hg2+还原为Hg0,电位上升Hg0氧化为Hg2+;在沉积物中则以HgS22-形式存在[4]。
土壤中可能存在金属汞及无机汞化合物:Hg0、HgS、HgCO3、Hg HPO4、HgCl2、Hg(NO3)2,除HgCl2、Hg(NO3)2外大多数是难溶的,固定于土壤中。许多汞的化合物容易被土壤中还原性物质还原成金属汞。Hg22+→Hg2++ Hg0。将土壤pH-电位图投影于汞的pH-电位图中,可见,石灰性旱地土壤可能以氢氧化汞一类的难溶性汞为主,或者按Hg(OH)2→HgO+H2O反应形成难溶氧化汞。从图还可看出,在水稻土中,有金属汞,还可能有少量硫化汞。此外,当污染土壤中氯离子含量增高时,导致可溶性HgCl2增多。淹水还原,降低土壤的Eh,有利于难溶性硫化汞生成。
5.2 镉的行为
天然水体及土壤溶液中镉离子的浓度与土壤氧化还原电位密切相关,镉的pH-电位图(图6)清楚地表明镉的形态。在常见的天然水体pH及 Eh范围内,镉大多都是以Cd2+形式存在。在沉积物中由于氧化还原电位降低则多以硫化物、碳酸盐和氢氧化物的形式出现,水体pH降低可导致碳酸盐和氢氧化物结合的镉溶解析出。
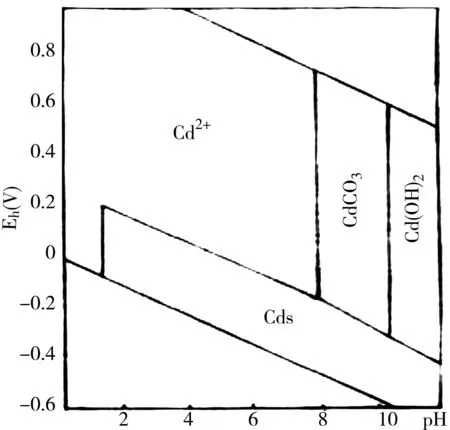
图6 镉的pH电位图 25℃,1大气压
在常见的土壤pH范围内,随着土壤氧化还原电位的降低,就可能形成难溶性的硫化镉,导致土壤溶液中镉离子浓度下降。反之,当土壤脱水时,随着氧化还原电位上升,土壤溶液中镉离子浓度逐渐增加。从图6还可以看出,随着pH值得升高,将产生难溶性镉的沉淀。
5.3 铬的行为
天然水体及土壤溶液中的铬主要有三价和六价两种价态。它们的价态和转化情况显示在铬的pH-电位图(7)中。从图中可见其价态受氧化还原反应和pH所制约。六价铬(Cr2072-)的废水排入环境中,若保持其易溶的铬酸盐态必须有较高的氧化还原电位。土壤的氧化还原电位只有数百毫伏,而渍水土壤多数在10mV以下。因此当Cr2072-进入水田时,就会迅速地还原成难溶性的三价铬化合物固定在土壤中。提高pH或降低氧化还原电位,可促使六价铬还原为三价。从而减轻铬对环境的污染。
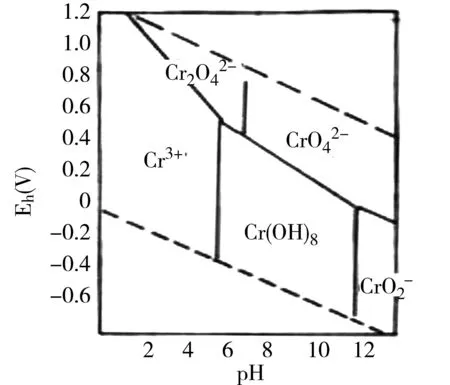
图7 铬的pH电位图(25℃)
5.4 砷的行为
就水环境和土壤环境中砷的价态而言,主要有三价和五价之分,而且受氧化还原电位所制约,砷盐中以三价砷的毒性最大,砷酸的pH-电位图对研究砷在环境中的行为有一定的实际意义。
天然水体中有亚砷酸盐形式存在。随着水体溶解氧的增加,氧化还原电位升高。亚砷酸盐氧化为砷酸盐,可减轻砷的危害。氧化还原电位下降,砷酸盐还原成亚砷酸盐。沉积物中的砷以亚砷酸盐形态存在。
在土壤中,与Cd、Cr相反,随着氧化还原电位的下降(如淹水还原),砷酸还原成亚砷酸盐从而加重了环境的危害(图8)。
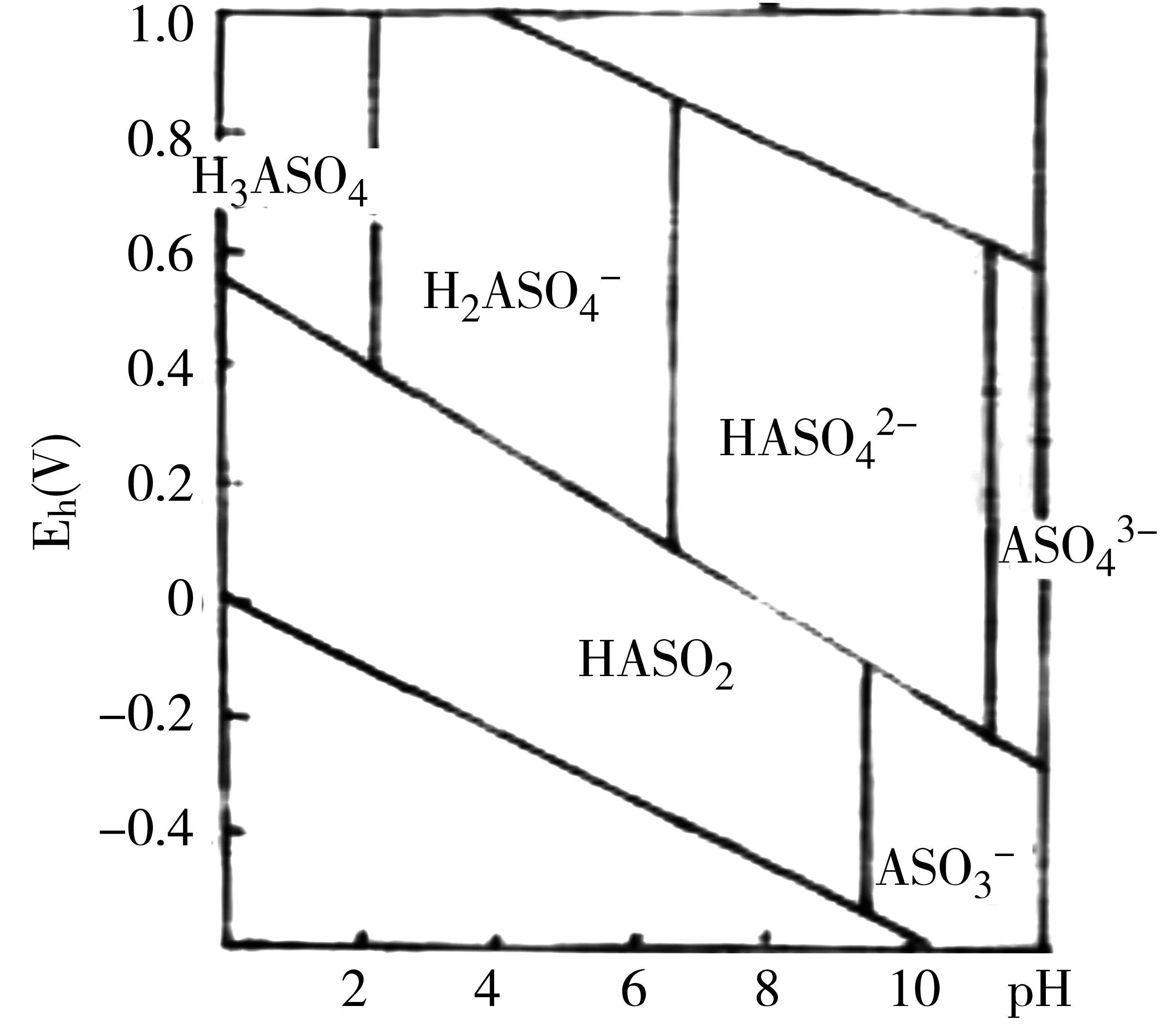
图8 砷酸的pH电位图(25℃)
5.5 金属硫化物的行为
金属硫化物的行为(MeS)在水环境及土壤环境中的各种变化的条件个和热力学规律,可通过MeS-H2O系PH-电位图了解清楚。现以ZnS-H2O系为例加以说明。25℃、PO2、PH2指定为1大气压,Zn2+、ZnO22-、H2S及含硫离子活度均为0.1时绘出的ZnS-H2O系pH-电位图见图9[5]。
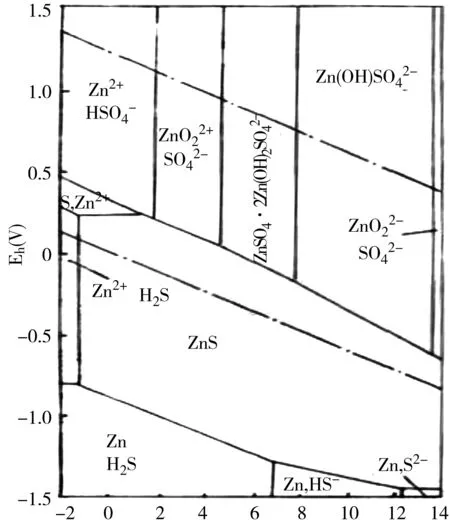
图9 ZnS-H 20的电位图(25℃)
当有氧存在时,几乎所有的MeS在任何pH范围内的水溶液都是不稳定的相,都能被氧化。在不同的pH和Eh下进行下列四种类型的反应:
Ⅰ.2 MeS+O2+4H+=2Me++2e+2H2O
Ⅱ. MeS+O2= Me2++SO42-
Ⅲ. MeS+2O2+2H2O=Me(OH)2+SO42-+2H+
Ⅳ. MeS+2O2+2H2O= Me O22-+SO42-+4H+
天然水中,ZnS氧化成Zn SO4. Zn(OH)2的形式存在。但当电位下降时,则还原为ZnS。沉积物中则以ZnS的形态存在。
土壤中,除水分过饱和土壤中ZnS不氧化外,在旱地土壤和潮湿土壤都会被氧化,不同的pH下分别得到图9所示的不同产物。
本文应用pH-电位图对硫、重金属及其硫化物在天然水体和土壤环境中的行为进行了初步探讨,为深入研究pH-电位图原理在环境化学中的应用,分析重金属及硫化物在天然水体及土壤环境中的迁移、演变规律,建立水化学和土壤环境化学的完整理论有借鉴作用。
(感谢廖本容、韩平学高级工程师对本论文的支持和帮助)
参考文献
[1]杨国治.土壤中氧化还原反应与重金属的危害[J].环境科学丛刊, 1983,4(3):1-7.
[2]栾兆坤.水体重金属稳定性问题[J].环境科学丛刊,1985,6(1):35-42.
[3]傅崇说.冶金溶液热力学原理与计算[M]. 北京:冶金工业出版社,1979:35-42.
[4]徐采栋.锌冶金物理化学[M].北京:冶金工业出版社,1978:67-87.
[5]中南矿冶学院.湿法冶金和电化学[M]北京:冶金工业出版社,1968:199-228.

