应用多参数技术方法对脑缺血皮质区神经细胞凋亡的检测
应用多参数技术方法对脑缺血皮质区神经细胞凋亡的检测
张文丽朱莹王瑞敏李倩郭静刘国荣耿福
(河北联合大学医学实验研究中心, 唐山 063000)
摘要:随着生物科学研究技术的不断提高和对细胞凋亡认识的不断深入,在细胞凋亡确认过程中,若单独使用一种方法检测会出现一定概率的假阳性,往往需要采用多参数技术方法相互印证。本实验结合透射电镜、流式细胞仪和共聚焦显微镜的检测技术及原理,通过多技术相结合观察判断了急性脑缺血皮质神经元细胞凋亡,并进行了定性、定量分析。
关键词:脑缺血;皮质细胞;凋亡检测
作者简介:张文丽,女,1974年出生,高级实验师,研究方向:脑缺血及脑损伤机制,E-mail:dianj@163.com。
DOI:10.3936/j.issn.1001-232x.2015.01.014
收稿日期:2014-07-19
Detection of nerve cell apoptosis in ischemic cortex by multi-parameter technology.ZhangWenli,ZhuYing,WangRuimin,LiQian,GuoJing,LiuGuorong,GengFu(MedicalLaboratoryResearchCenter,HebeiUnitedUniversity,Tangshan063000,China)
Abstract:This article decided the acute ischemic cortex neurons apoptosis which combined the detection technology and principles of transmission electron microscope, flow cytometry and laser scanning confocal microscope. And conducted the qualitative and quantitative analysis.
Key words:cerbral ischemic; cortial cells; detection of apoptosis
1前言
脑缺血性疾病是人类常见病、多发病,有关研究较多。但迄今为止其机理仍未完全清楚。急性脑缺血在临床上是最常见的脑卒中类型,占全部脑卒中的60%~80%。近年来大量研究表明[1-3],急性脑缺血通过各种原因引起脑血液循环灌注不足,脑组织发生病理性的改变。神经细胞的凋亡是脑缺血后神经元死亡的重要方式。正常脑发育过程中有30~70%的神经元是通过凋亡来清除老化细胞,细胞凋亡不仅在正常发育的神经元中发生,也在许多神经系统疾病中发生并起重要作用,如脑梗塞、脑外伤、脊髓损伤等。因此研究神经细胞的凋亡在神经科学中已成为了一个非常活跃的领域。细胞凋亡发生的原因和途径是复杂多样的,脑缺血损伤诱导神经元凋亡途径包括线粒体途径,单胺类神经递质受体途径,神经细胞内Ca2+超载和内质网应激途径等[4-6]。
细胞凋亡是有核细胞在一定条件下启动的其自身内部机制, 主要通过内源性 DNA内切酶的激活而发生的自然死亡过程,受基因调控,需新的蛋白质合成。细胞凋亡对细胞增殖、组织的发生和机体的功能维持起着重要作用。但在病理条件下,机体可诱发细胞凋亡发生。在形态学上凋亡截然不同于细胞坏死,凋亡可通过形态学观察、DNA片断化分析及凋亡相关分子蛋白检测等确定。但对凋亡形态认定结合细胞的定量分析也是检测细胞凋亡最直接可靠的方法。
2材料和方法
2.1 模型建立与动物分组
SPF级雄性SD大鼠20只,体重280~350g,由北京市华阜康生物科技股份有限公司提供。在我校动物饲养中心标准化喂养。通过两血管法即双侧颈总动脉结扎建立脑缺血模型[7,8];首先用10%水合氯醛(0.3mL/100g)腹腔注射麻醉,颈部消毒后正中切口,钝性分离出双侧迷走神经与颈总动脉,用4号丝线双重结扎剪断颈总动脉,缝合切口时注入庆大霉素4万单位预防感染。大鼠随机分为四组,对照组、脑缺血后6h、24h、72h组;对照组不致伤,本实验符合动物伦理学标准。
2.2 透射电镜取材及样品制备
各组大鼠麻醉后断头,均切取左侧脑皮质组织,1mm×1mm×2mm大小,放入2.5%戊二醛液中固定3h,再用1%锇酸后固定1h,乙醇梯度脱水,环氧树脂815包埋,超薄切片75nm ,醋酸铀染色15min,柠檬酸铅染色10min,日本Hitachi公司H-7650型透射电镜观察分析,美国Gatan公司CCD相机拍照。
2.3 流式细胞仪测定
将剩余左侧脑皮质组织切碎后置于4℃70%乙醇中保存。研磨脑组织,生理盐水冲洗, 制备成组织悬液,将组织悬液收集后离心5min,弃上清,向沉淀物中加入0.5%胃蛋白酶2mL,37℃消化30min,加入生理盐水稀释到5mL再次过滤,将滤液离心3min,弃上清。向沉淀物中加入细胞核荧光素溴化乙啶(EB,10μg/mL),染色30min, 美国BD公司Facscdidur流式细胞仪分析。每个样品分析1×106/mL细胞,计算细胞凋亡率。
2.4 激光共聚焦显微镜样品制备
取同一只大鼠的右侧脑皮质组织用10%福尔马林固定,石蜡包埋切片,捞片于多聚赖氨酸防脱载玻片上,常规脱蜡、脱水,用蛋白酶K室温孵育30min,PBS冲洗样品,滴加50ulTUNEL反应液进行标记,37℃湿盒内孵育1h,PBS冲洗样品,日本Olympus公司FV1000型共聚焦显微镜下观察拍照。
2.5 统计学处理
3结果
3.1 透射电镜超微结构观察
对照组大鼠脑皮质神经元细胞核膜清晰完整,核大而圆,核内异染色质及常染色质分布正常,胞质有大量粗面内质网及丰富的游离核糖体;线粒体结构完整。轴索结构正常。6h组神经元细胞核不规则,核膜凹陷,核内异染色质及常染色质分布基本正常,线粒体部分空化变性。24h组皮质神经元细胞皱缩,核内染色质分布不均匀,异染色质边集,细胞呈凋亡早期改变,胞浆内线粒体肿胀、空化;内质网扩张、有脱颗粒现象,核糖体减少。轴索结构排列紊乱、肿胀。48h组神经元细胞核内异染色质边集、核固缩,呈典型凋亡样改变。细胞器少,内质网扩张,线粒体肿胀、空化。镜下较6h、24h组有明显核固缩及凋亡细胞征象,也多见死亡细胞。72h组神经元细胞核内染色质分布不均匀,异染色质边集,有部分线粒体肿胀、空化;内质网扩张;细胞呈凋亡样改变(图1)。
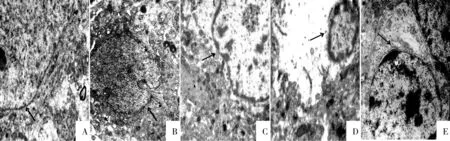
图1 透射电镜下超微结构(1500x) A正常组,B 6h组, C 24h组, D 48h组, E72h组, 箭头示神经元细胞核
3.2 大鼠脑皮质细胞凋亡发生率的影响
流式细胞术通过荧光染料与细胞的特异性结合,有一定的量效关系。在脑缺血6h、24h、48h、72h组与对照组相比,差异有统计学意义(P<0.05);提示脑缺血后早期皮质区细胞凋亡率随缺血时间的延长而增加,6h组细胞凋亡率较低,48h组细胞凋亡率最高,与24h、48h组相比,72h组细胞凋亡率有所降低(图2)。

图2 缺血后各时间点脑皮质凋亡细胞率 注: #与对照组相比p<0.05
3.3 激光共聚焦显微镜脑皮质扫描结果
激光共聚焦显微镜下一些细胞荧光颜色的改变与神经细胞凋亡有关。本实验中TUNEL(绿色荧光)阳性染色代表凋亡样损伤的神经元。对照组神经元排列整齐紧密,凋亡的神经元数量极少,6h组可见生存的神经元数量较少,而凋亡样损伤的神经元数量增多(p<0.05),24h、48h组可见大量凋亡样神经元,存活的神经元数量明显减少(p<0.05),72h组仍可见大量凋亡样损伤神经元,但较24h、48h组有所减少(p<0.05)(图3、图4)。
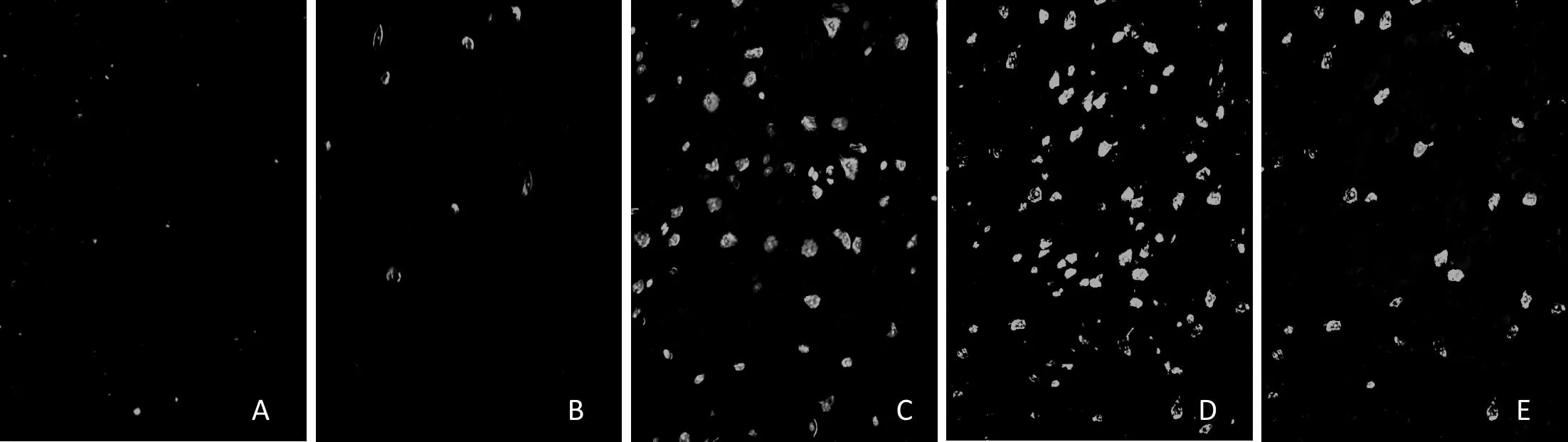
图3 激光共聚焦显微镜脑皮质凋亡细胞
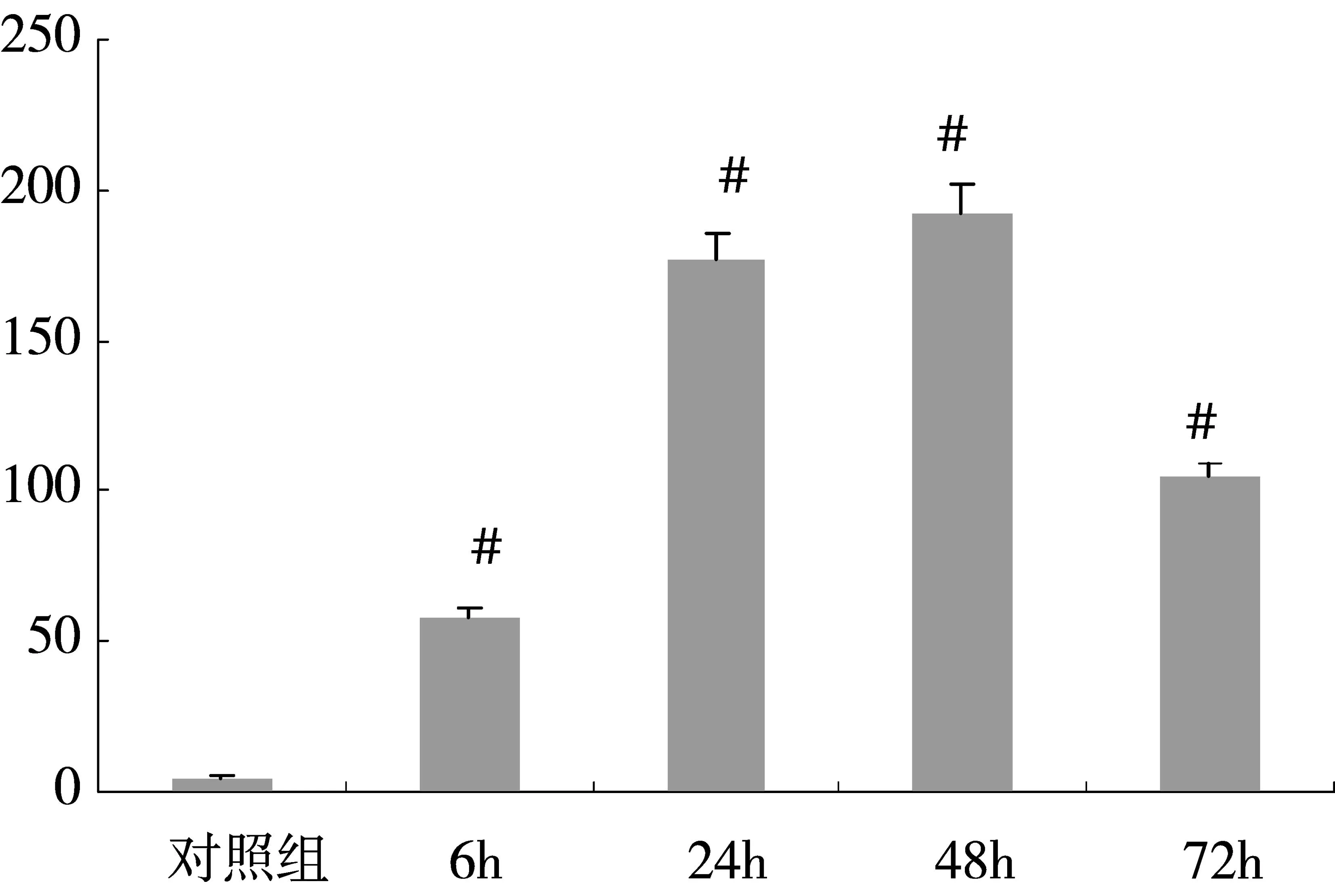
图4 缺血后各时间点脑皮质细胞凋亡数量
4讨论
国内外大量研究发现大多数脑梗死和老年痴呆症的发病前期都曾有脑缺血的存在[9]。本实验通过手术,进行永久性结扎大鼠双侧颈总动脉,制备急性脑缺血动物模型,这种方法实质上是由于大脑特定部位的血流供应受阻所导致的血氧不足或脑缺氧,不能满足脑部能量的供给,最终导致神经细胞的功能下降。较好地模拟了临床急性脑梗塞或缺血性中风疾病。脑缺血后,神经元损伤具有选择性和易损性的特点。细胞凋亡的形态学检测结果直观, 至今仍是判定细胞是否发生凋亡的金标准。电镜下一些细胞核染色质的改变与神经细胞凋亡有关。缺血6h组神经元细胞核不规则,核膜凹陷,线粒体略有肿胀。24h及48h组凋亡形态细胞较多,细胞核内染色体凝缩并沿核膜形成团块,细胞质开始浓缩,内质网解体,线粒体肿胀,但没看见凋亡小体出现。72h组有细胞皱缩,细胞器有肿胀、空化、核染色质不均匀等凋亡现象。
流式细胞仪和激光共聚焦显微镜对细胞的定量、细胞荧光定位分析是不可或缺的检测技术,可以弥补电镜形态检测的局限性。流式细胞仪对检测的细胞经过荧光染色后,通过激光检测区时受激光激发,发出特定波长的荧光通过滤色片,可将不同波长的散射光、荧光信号区分开来,并传送到不同的光电倍增管中,经过信号转换、放大,数字化处理对细胞进行定量及其分选的分析。激光共聚焦显微镜可进行细胞形态定位、定量荧光测定、定量图像分析等实用研究[10]。可以获得普通光镜无法达到的分辨率。本研究的结果表明急性脑缺血造成大鼠皮层脑组织发生细胞凋亡,凋亡的细胞数量随缺血时间的不同具有一定的时相性, 6h组可见少量凋亡的神经细胞,24h继续增加,48h凋亡的神经细胞较多,达到高峰,72h有所减少。流式细胞仪检测与激光共聚焦检测结果相一致。主要可能由于脑缺血缺氧致使线粒体的氧化磷酸化作用受到影响,细胞合成或分泌蛋白质的过程受阻,神经递质、第二信使、酶类、受体减少,能量供应不足,DNA的转录复制功能降低;导致神经元代谢功能紊乱;呈现一种迟发性神经元凋亡现象。
总之,细胞凋亡的检测方法很多,都是基于细胞凋亡过程中的各种特征进行设计的,不同的实验条件,检测得到细胞凋亡的结果也不一样,到目前,每种检测方法都有它一定的局限性。在进行实验时, 要采用并综合多参数技术方法进行检测相互论证,才能捕捉到有利的、明显的细胞凋亡证据。
参考文献
[1] 彭黎明.细胞凋亡的基础与临床[M].北京:人民卫生出版社,2000:22-28.
[2] Hämmerlein A, Weiske J, Huber O.A second protein kinase CK1-mediated step negatively regulates Wnt signalling by disrupting the lymphocyte enhancer factor-1/β-catenin complex[J]. CMLS Cellular and Molecular Life Sciences.2005,62(5):606-618.
[3] Shi H,Liu K J.Cerebral tissue oxygenation and oxidative brain injury during ischemia and reperfusion[J].Frontiers in Bioscience.2007,12(6):1318-1328.
[4] 曲鹏,乔春萍,方秀斌.凋亡相关基因与脑缺血再灌注损伤[J].解剖科学进展,2006,12(1):52-56.
[5] 方舒东,朱也森.脑缺血再灌注损伤的病理生理研究进展[J].医学综述,2006,12(18):1114-1116.
[6]Zhao Jianxin, Tian Yuanxiang, Xiao Hongling. Effects of Electroacupuncture on Hippocampal and Cortical Apoptosis in A Mouse Model of Cerebral Ischemia-reperfusion Injury [J]Journal of Traditional Chinese Medicine.2011,31(4):349-355.
[7]顾兵,程翔,金建波,脑缺血动物模型及其实验治疗学应用[J].中国临床药理学与治疗学,2010. 15(9): 1074-1080.
[8]王树,张力.脑缺血及脑缺血再灌注损伤动物模型制备方法及评价[J].神经药理学报,2011,1(3):31-40.
[9] Hou Deren,Wang Yan,Zhou Lin.Altered angiotensin-converting enzyme and its effects on the brain in a rat model of Alzheimer disease[J]. Chinese Medical Journal,2008,121(22):2320-2323.
[10]袁兰. 激光扫描共聚焦显微镜技术教程[M].北京:北京大学医学出版社,2004:52-55.

