miR302/367簇对肝癌细胞增殖的抑制作用及机制探讨
·基础研究·
miR302/367簇对肝癌细胞增殖的抑制作用及机制探讨
廖娟,雎岩,赵金,李洁,李涛
(陕西省肿瘤医院,陕西咸阳710061)
摘要:目的探讨miR302/367簇在肝癌发生、发展过程中的作用及机制。方法通过实时定量PCR检测肝癌细胞系(Bel-7402、HepG2、MHCC97、SMMC-7721)中miR302/367簇的表达;在HepG2、MHCC97肝癌细胞系中建立miR302/367簇过表达体系,通过细胞计数实验、MTT实验和异种移植瘤模型检测肝癌细胞体内、体外增殖和生长能力;利用流式细胞术,通过PI染色,检测肝癌细胞周期分布。结果miR302/367簇在四个肝癌细胞系中均不表达;过表达miR302/367簇后,肝癌细胞体内、体外的增殖和生长能力均明显受抑制,其G0/G1期比例显著增加,而S期比例明显减少(P均<0.05)。结论 miR302/367簇通过阻滞细胞从G0/G1期向S期转换抑制肝癌细胞的增殖。
关键词:肝肿瘤;微小RNA;miR302/367簇;细胞增殖
doi:10.3969/j.issn.1002-266X.2015.45.012
中图分类号:R735.7文献标志码:A
收稿日期:(2015-09-08)
肝癌的发生、发展是一个多因素、多步骤的复杂过程,癌基因的激活和抑癌基因的失活是细胞发生癌变的主要机制。近年研究表明,miRNA参与了细胞的增殖、分化与凋亡等生理过程,其表达异常与肿瘤的起源与进展密切相关[1]。已有大量报道显示,miRNA在肝癌组织中表达异常,如miR16、miR21、miR31、miR122、miR145等,与肝癌的发生、发展、转移及预后相关[2, 3]。然而,miR302/367簇在肝细胞癌中的作用及分子机制目前尚不明确,本研究进行了相关探讨。
1材料与方法
1.1材料细胞:人肝癌细胞系Bel-7402、HepG2、MHCC97、SMMC-7721和畸胎瘤细胞系PA-1购自美国模式菌种收集中心(American Type Culture Collection, Manassas, VA, USA),用含10%胎牛血清、1 000 U/mL青霉素、100 mg/mL链霉素的RPMI1640或DMEM细胞培养液,于37 ℃、5% CO2的条件下培养,待单层细胞生长达80%融合时,用胰蛋白酶消化细胞,收集细胞备用。试剂及仪器:细胞培养液RPMI1640和DMEM购自Gibco BRL公司;氨苄青霉素钠,硫酸链霉素和G418试剂购自美国Sigma公司;胎牛血清购自Hyclone公司;TRIzol,转染试剂脂质体(LipofectaminTM2000)购自Invitrogen公司;microRNA逆转录试剂盒及Real-time PCR试剂盒均购自美国Applied Biosystems公司。
1.2载体构建及细胞转染miR302/367簇位于人4号染色体4q25,包括miR302b、miR302c、miR302a、miR302d和miR367 5种miRNA[4]。从人肝癌细胞系HepG2基因组DNA中克隆了一段长723 bp的序列,将目的片段插入到miR-367前体miRNA的过表达载体(pCAG-EGFP-Neo)中并测序鉴定,构建miR302b、c、a、d和pCAG-EGFP-Neo。收集对数生长期的肝癌细胞,将5×105的细胞接种于6孔板中培养24 h。根据脂质体转染说明书,将转染试剂Lipofectmine2000与miR302/367簇过表达载体(实验组)或pCAG-EGFP-Neo载体(对照组)混合,转染24 h后观测荧光,同时以1∶10的比例将每组细胞传代,用G418药物筛选挑取单克隆,通过实时定量PCR检测其表达。
1.3细胞cDNA中miR302/367簇的检测采用实时定量PCR法检测肝癌细胞系(Bel-7402、HepG2、MHCC97和SMMC-7721)cDNA中miR302/367簇的表达,并选取畸胎瘤细胞系PA-1作为阳性对照。为进一步研究miR302/367簇在肝癌细胞中的作用,我们在HepG2和MHCC97细胞系中建立miR302/367簇过表达体系,并采用同样方法检测miR302/367簇的表达。收集对数期生长细胞,根据TRIzol试剂说明书提取细胞总RNA,并利用特异性miRNA引物及TaqMan®miRNA reverse transcription kit反转录总RNA。利用TaqMan microRNA assay 和TaqMan universal PCR master mix试剂盒检测cDNA中miR302/367簇的表达,其表达水平采用2-ΔCt方法,高度保守的snRNA U6作为内参。结果在这4个肝癌细胞系中,miR302/367簇中5种miRNA均不表达,而在PA-1中均高表达。转染miR302/367簇后,GFP阳性克隆均能表达5种miRNA。将过表达克隆(HepG2-302/367组和MHCC97-302/367组)与对照克隆(HepG2-EGFP组和MHCC97-EGFP组)用于后续研究。
1.4体外细胞增殖能力和细胞活力检测细胞增殖能力检测:采用细胞计数实验。收集对数生长期细胞,以5×104个细胞接种于6孔板中,利用细胞计数器检测1周内细胞数并绘制细胞生长曲线,比较实验组(HepG2-302/367组和MHCC97-302/367组)和对照组(HepG2-EGFP组和MHCC97-EGFP组)中细胞增殖能力的差异。细胞活力检测:采用MTT法。将1 000个细胞接种于96孔板中,加入MTT后37 ℃培养4~6 h,然后加入DMSO溶解,用分光光度计于570 nm处测定吸光度并绘制曲线图。连续7 d检测细胞活力。
1.5体内细胞增殖、生长和成瘤能力检测采用异种移植瘤实验。取对数生长期的实验组(HepG2-302/367组和MHCC97-302/367组)和对照组(HepG2-EGFP组和MHCC97-EGFP组)中细胞,经胰酶消化成单细胞悬液,调整浓度,终浓度为1×106/mL,将100 μL(1×105个)细胞悬液接种于4~6周龄的BALB/c-nu裸鼠(购自上海斯莱克公司)双侧背部皮下,连续观察6~8周,每周观察肿瘤的生长情况并记录。
1.6细胞周期检测取对数生长期的实验组(HepG2-302/367组和MHCC97-302/367组)和对照组(HepG2-EGFP组和MHCC97-EGFP组)中细胞,利用流式细胞术,通过PI染色,检测肝癌细胞周期分布。
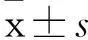
2结果
2.1miR302/367簇对肝癌细胞体外增殖、细胞活力的影响miR302/367簇干预后肝癌细胞的增殖能力明显受抑。7 d的培养期中,HepG2-302/367和MHCC97-302/367与HepG2-EGFP和MHCC97-EGFP相比,其细胞数分别下降了3倍和2倍(P均<0.05)。结果见表1。MTT实验亦显示miR302/367簇能明显抑制肝癌细胞生长。通过7 d的培养,HepG2-302/367和MHCC97-302/367与对照相比,其细胞活力均明显降低(P均<0.05)。结果见表2。
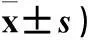
表1 各组不同时间的细胞数比较(×10 4个,
注:与HepG2-EGFP组比较,*P<0.05;与MHCC97-EGFP组比较,#P<0.05。
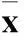
表2 各组不同时间的细胞活力比较(吸光度值, ± s)
注:与HepG2-EGFP组比较,*P<0.05;与MHCC97-EGFP组比较,#P<0.05。
2.2miR302/367簇对肝癌细胞体内增殖、生长和成瘤能力的影响过表达miR302/367簇后,肝癌细胞成瘤时间、成瘤率并未见明显变化,HepG2-302/367、MHCC97-302/367实验组和HepG2-EGFP、MHCC97-EGFP对照组在3周左右均可触摸到结节,成瘤率均为100%。但与对照组相比,过表达组移植瘤的生长速度明显减慢(表3,P<0.05)。裸鼠处死后取下肿瘤称重,HepG2-302/367组和HepG2-EGFP组体质量分别为(1.37±0.57)、(2.72±0.92)g,MHCC97-302/367组和MHCC97-EGFP组体质量分别为(1.16±0.53)、(1.93±0.77)g,miR302/367簇过表达后体质量明显减轻(P<0.05)。
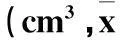
表3 各组不同时间的肿瘤体积比较 ± s)
注:与HepG2-EGFP组比较,*P<0.05;与MHCC97-EGFP组比较,#P<0.05。
2.3miR302/367簇对肝癌细胞周期的影响结果见表4。
3讨论
miRNA是一种细胞内源性的非编码小RNA,长19~22 nt,可通过特异性结合来降解mRNA或抑制其翻译,从而调节蛋白表达[5]。已有实验证实,miRNA参与细胞的多种生理和病理过程,如细胞分化、增殖、凋亡及肿瘤形成等[5]。miR302/367簇能促进胚胎干细胞的多潜能性,参与肿瘤的发生、发展。本研究旨在研究该基因簇在肝癌中的作用及机制。
表4 各组细胞周期分布比例比较 ± s)
注:与HepG2-EGFP组比较,*P<0.05;与MHCC97-EGFP组比较,#P<0.05。
miR302/367簇包括5个miRNA(miR302b、miR302c、miR302a、miR302d和miR367)。由于miR302a-d具有相同的种子序列,与miR367存在不同,因此大部分的文献均只研究miR302s[6,7],仅有为数不多的文献报道了miR302/367簇的功能[8,9]。该基因簇中的5个miRNA位于同一前体miRNA,其共转录本由共同的启动子调控转录,该启动子位于Larp7基因的8号内含子[10]。因此,这5个miRNA表达一致,应作为一个整体共同研究其功能。我们前期研究结果显示,4个肝癌细胞系中均不表达5个miRNA,而在畸胎瘤细胞系中均有表达,且表达水平一致。Suh等也报道了miR302/367簇在多潜能细胞中的特异性表达。
关于miR302s功能研究有不同的结果。有报道显示,miR302s能诱导人体细胞(成纤维细胞和毛囊滤泡细胞)和肿瘤细胞(Colo-829 黑色素瘤和PC3前列腺癌)形成诱导多能活细胞[7],而另一部分报道显示miR302s能抑制人多潜能干细胞和多种肿瘤细胞的成瘤能力。同样的,miR302/367簇亦能诱导人成纤维细胞形成多潜能胚胎干细胞样细胞[8]。在本研究中,我们并未发现miR302/367簇在肝癌细胞中具有重编程作用,但能通过抑制细胞周期进程从而抑制肝癌细胞增殖。在肝癌细胞系中过表达miR302/367簇后,可抑制细胞体内、外增殖和生长能力,这一过程是通过阻滞细胞从G0/G1期向S期转换实现的。
在以往的研究中,亦有文献报道了miR302/367簇抑制周期进程的分子机制。miR302s能下调多种细胞周期相关蛋白,包括CDK2、cyclin A、E2F-1、cyclin D1等[11]。在宫颈癌中,miR302/367簇能通过直接靶向AKT1,上调p27Kip1和p21Cip1这两个周期抑制蛋白,从而阻滞细胞从G0/G1期向S期转换[15]。
综上所述,miR302/367簇能通过阻滞细胞从G0/G1期向S期转换,从而抑制肝癌细胞的增殖能力,在肝癌的发生发展过程中发挥抑癌基因的作用。该研究为进一步探索肝癌的生物学机制及将miR302/367簇作为潜在的治疗靶点提供了理论基础。
参考文献:
[1] Esquela-Kerscher A, Slack FJ. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006,6(4):259-269.
[2] Ge W, Yu DC, Li QG, et al. Expression of serum miR-16, let-7f, and miR-21 in patients with hepatocellular carcinoma and their clinical significances[J]. Clin Lab, 2014,60(3):427-434.
[3] Karakatsanis A, Papaconstantinou I, Gazouli M, et al. Expression of microRNAs, miR-21, miR-31, miR-122, miR-145, miR-146a, miR-200c, miR-221, miR-222, and miR-223 in patients with hepatocellular carcinoma or intrahepatic cholangiocarcinoma and its prognostic significance[J]. Mol Carcinog, 2013,52(4):297-303.
[4] Puca AA, Daly MJ, Brewster SJ, et al. A genome-wide scan for linkage to human exceptional longevity identifies a locus on chromosome 4[J]. Proc Natl Acad Sci U S A, 2001,98(18):10505-10508.
[5] Ambros V. The functions of animal microRNAs[J]. Nature, 2004,431(7006):350-355.
[6] Scheel AH, Beyer U, Agami R, et al. Immunofluorescence-based screening identifies germ cell associated microRNA 302 as an antagonist to p63 expression[J]. Cell Cycle, 2009,8(9):1426-1432.
[7] Lin SL, Chang DC , Lin CH, et al. Regulation of somatic cell reprogramming through inducible mir-302 expression[J]. Nucleic Acids Res, 2011,39(3):1054-1065.
[8] Anokye-Danso F, Trivedi CM, Juhr D, et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency[J]. Cell Stem Cell, 2011,8(4):376-388.
[9] Cai N, Wang YD, Zheng PS. The microRNA-302-367 cluster suppresses the proliferation of cervical carcinoma cells through the novel target AKT1[J]. RNA, 2013,19(1):85-95.
[10] Card DA, Hebbar PB, Li L, et al. Oct4/Sox2-regulated miR-302 targets cyclin D1 in human embryonic stem cells[J]. Mol Cell Biol, 2008,28(20):6426-6438.
[11] Fareh M, Turchi L, Virolle V, et al. The miR 302-367 cluster drastically affects self-renewal and infiltration properties of glioma-initiating cells through CXCR4 repression and consequent disruption of the SHH-GLI-NANOG network[J]. Cell Death Differ, 2012,19(2):232-244.

