他克莫司对小鼠肠黏膜屏障功能的损伤作用及分子机制
他克莫司对小鼠肠黏膜屏障功能的损伤作用及分子机制
吕亚青1,曲林林1,江海涛1,黎介寿2
(1青岛大学附属医院,山东青岛266555;2南京军区南京总医院)
摘要:目的观察他克莫司(FK506)对小鼠肠黏膜屏障功能的损伤作用,并探讨其分子机制。方法将24只C57BL/6小鼠随机分为高剂量组、低剂量组和对照组各8只,分别予FK506 5 mg/kg、FK506 1 mg/kg、生理盐水灌胃。用药30 d处死小鼠,收集肠黏膜组织标本,采用HE染色法观察肠黏膜组织结构变化,透射电镜下观察肠黏膜上皮细胞紧密连接的超微结构改变,采用分光光度法测定血浆D-乳酸,氧电极法测定肠组织线粒体呼吸功能,高压液相色谱法检测肠黏膜上皮细胞线粒体三磷酸腺苷(ATP)酶活性。结果低、高剂量组小鼠体质量较对照组明显减轻,高剂量组减轻更明显(P均<0.05);低、高剂量组小鼠肠上皮细胞间紧密连接超微结构遭到破坏,其损伤程度与FK506剂量呈正相关;与对照组比较,低、高剂量组小鼠血浆D-乳酸水平升高,高剂量组升高更明显(P均<0.05);与对照组比较,低、高剂量组小鼠小肠3态呼吸耗氧量、呼吸控制率、膜电位、ATP酶活性下降,4态呼吸耗氧量升高,高剂量组变化更明显(P均<0.05)。结论 FK506能损伤小鼠肠黏膜屏障功能,且损伤程度呈剂量依赖性;其分子机制可能是通过损伤小鼠肠黏膜细胞线粒体功能而损伤肠黏膜屏障功能。
关键词:肠黏膜屏障;他克莫司;线粒体;小鼠
doi:10.3969/j.issn.1002-266X.2015.45.004
中图分类号:R333.3 文献标志码:A
基金项目:山东省优秀中青年科学家科研奖励
作者简介:第一吕亚青(1976-),女,主管护师,主要研究方向为围手术期肠屏障功能保护。E-mail:uuto2004@126.com
作者简介:通信黎介寿(1923-),男,中国工程院院士,医学博士,主要研究方向为胃肠外科疾病的诊治。E-mail:lijieshounju@126.com
收稿日期:(2015-08-01)
Damaging effect of FK506 on intestinal mucosal barrier function
in mice and its molecular mechanism
LYUYa-qing1, QU Lin-lin, JIANG Hai-tao, LI Jie-shou
(1TheAffiliatedHospitalofQingdaoUniversity,Qingdao266555,China)
Abstract:ObjectiveTo observe the damaging effect of tacrolimus (FK506) on intestinal mucosal barrier function in mice and to investigate its possible molecular mechanisms. MethodsTwenty-four C57BL/6 mice were randomly divided into 3 groups (8 in each group): high-dose group (5 mg/kg), low-dose group (1 mg/kg) and the control group (normal saline). All mice were sacrificed after FK506 was administered for 30 days and the intestinal mucosal tissues were obtained. The structure of intestinal mucosa was observed by HE staining and ultrastructure was observed by transmission electron microscope. The level of D-lactate was detected by spectrophotometry. The function of mitochondrion was detected with Clark electrodes. The adenosine triphosphate (ATP) was detected with high pressure liquid chromatography. ResultsThe body weight of mice was decreased significantly in the high-dose and low-dose groups as compared with that of the control group, and the body weight lost more in the high-dose group than in the low-dose group (all P<0.05). The ultrastructure of intestinal mucosa was destroyed in high-dose and low-dose groups and it showed a dose-dependent manner. Compared with the control group, the level of D-lactate was increased significantly in the high-dose and low-dose groups and it was more significant in the high-dose group (all P<0.05). Compared with the control group, state Ⅲ oxygen consumption, respiratory control ratio, membrane potential and enzymatic activity of ATP were decreased significantly and state Ⅳ oxygen consumption was increased significantly in the high-dose and low-dose groups, and the changes were more significant in the high-dose group than in the low-dose group (all P<0.05). ConclusionFK506 could destroy the intestinal mucosal barrier function with a dose-dependent manner, and the molecular mechanism may be caused by destruction of the mitochondrion of intestinal mucosal cells.
Key words: intestinal mucosal barrier; tacrolimus; mitochondrion; mice
目前,对抗器官移植术后急性排斥反应主要应用免疫抑制剂[1],其中他克莫司(FK506)作为一种强效免疫抑制剂被广泛应用[2,3],其通过抑制T辅助(Th)细胞释放白细胞介素-2、抑制细胞毒T细胞增殖达到免疫抑制作用[4]。但FK506同时亦有较强的不良反应,特别是在大剂量使用时可发生难以控制的感染[5],而感染是器官移植失败甚至患者死亡的主要原因之一[6]。我们前期研究发现,FK506能造成小鼠肠黏膜屏障功能损伤,然而其具体机制仍不明确。2013年3~7月,我们观察了FK506对小鼠肠黏膜屏障功能的损伤作用,并探讨其分子机制。
1材料与方法
1.1 材料4周龄C57BL/6雄性小鼠24只(上海斯莱克实验动物有限公司),体质量16~19 g。FK506胶囊购自安斯泰来制药(中国)有限公司。血浆D-乳酸检测试剂盒购自杰美公司,ATP酶试剂盒购自上海江莱生物科技有限公司。JEM-1200透射电镜购自日本电子JEOL公司,氧电极购自英国Hansatech公司。
1.2造模及分组将24只小鼠随机分为对照组、高剂量组、低剂量组,每组8只。将FK506完全溶于生理盐水制成0.25、0.05 mg/mL溶液,高剂量组小鼠胃内灌注FK506 5 mg/kg,低剂量组胃内灌注FK506 1 mg/kg,每天连续给药,7 d后隔天给药至30 d。对照组每天胃内灌注相同容积的生理盐水。用药期间观察小鼠的一般情况(体质量、有无腹泻等)。于给药30 d麻醉小鼠行腹正中切口取材,手术过程中腹腔内适量滴生理盐水,保持组织活性。
1.3肠黏膜组织病理学观察取回盲部靠近回肠部1 cm肠管,于等渗盐水中洗净肠内容物。组织标本用10%甲醛固定待行病理学检查,采用HE染色,光镜下观察。
1.4肠黏膜上皮细胞紧密连接超微结构观察取回盲部近结肠部约1 mm×1 mm×3 mm肠段,快速固定于3%的冷戊二醛溶液中2 h,1%锇酸固定1 h,丙酮梯度脱水,环氧丙烷置换,Epon-812树脂包埋,超薄切片机切片,醋酸铀-柠檬酸铅双重电子染色,JEM-1200透射电镜下观察肠黏膜上皮细胞紧密连接的超微结构改变。
1.5血浆D-乳酸检测于给药30 d心脏穿刺取血1.5 mL,新鲜血液标本离心(400 g,10 min)后,采用分光光度法测定血浆D-乳酸。
1.6肠黏膜上皮细胞线粒体功能检测给药30 d后麻醉小鼠,行腹正中切口获取小鼠回肠组织,用差速离心法分离小鼠回肠组织线粒体,按1 g组织∶9 mL分离介质的比例加入线粒体分离介质,组织剪碎后匀浆,低温离心,洗涤沉淀2次。洗涤后线粒体沉淀加300 μL分离介质溶解制成线粒体混悬液。采用氧电极法测定线粒体呼吸功能。反应总体积800 μL,设置温度为30 ℃。调节反应介质氧含量至高点并调节氧含量至0点,稳定后,向反应池中依次加入线粒体悬液100 μL,反应底物苹果酸钠(1.25 mol/L)10 μL和谷氨酸钠(1.25 mol/L)10 μL,间隔约1 min后加入腺苷二磷酸(ADP)(40 mmol/L)5 μL,观察线粒体呼吸态的变化。记录氧耗曲线。计算在ADP加入后3态呼吸(ST3)和ADP耗尽后4态呼吸(ST4)的氧耗量。线粒体呼吸活性以消耗线粒体蛋白表示,呼吸控制率(RCR)以3、4态耗氧之比(ST3/ST4)表示。采用罗丹明123作为荧光探针测定线粒体膜电位,线粒体膜电位=59×log([罗丹明123浓度]线粒体内/[罗丹明123浓度]线粒体外)。
1.7肠黏膜上皮细胞线粒体腺苷三磷酸(ATP)酶活性检测采用高压液相色谱法。将差速离心法分离所得小鼠回肠组织线粒体悬液严格按ATP酶试剂盒说明书操作。定义每小时每毫克组织蛋白中ATP酶分解ATP产生1 μmol无机磷的量为1个ATP酶活力单位。
2结果
2.1实验动物一般情况低、高剂量组小鼠体质量较对照组明显减轻,给药剂量越大体质量增加越缓慢。低剂量组、高剂量组小鼠出现不同程度的腹泻症状。
2.2小肠黏膜组织病理学变化光镜下可见低、高剂量组小鼠的小肠绒毛粗糙,肠黏膜与肠黏膜下层充血、水肿、糜烂,并伴有炎性细胞浸润,低剂量组黏膜损伤程度轻于高剂量组。
2.3肠黏膜上皮细胞紧密连接超微结构改变透射电镜下可见低剂量组小鼠肠黏膜上皮细胞间紧密连接间隙增宽,结构模糊;高剂量组小鼠肠黏膜紧密连接不仅出现间隙增宽、结构破坏,其桥粒结构亦消失。
2.4血浆D-乳酸水平变化对照组、低剂量、高剂量组小鼠血浆D-乳酸水平分别为(0.43±0.07)、(0.81±0.02)、(0.22±0.03)mmol/L,与对照组比较,低、高剂量组小鼠血浆D-乳酸水平升高,高剂量组升高更明显(P均<0.05)。
2.5肠黏膜上皮细胞线粒体呼吸功能变化及ATP酶活性结果见表1。
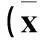
表1 三组小鼠小肠线粒体呼吸功能比较 ± s)
注:与对照组相比,*P<0.05;与低剂量组相比,#P<0.05。
3讨论
随着免疫抑制剂的临床应用,器官移植术后急性排斥反应得到了较好控制[7],但移植术后的其他问题逐渐显现出来。肠道是人体内最大的贮菌库,在移植术后,因肠黏膜屏障功能受损导致的细菌移位可造成严重的菌血症、毒血症、败血症等,甚至导致多器官功能障碍综合征,成为小肠移植手术失败的主要原因之一[8]。
FK-506为一种新型强效免疫抑制剂,可致肠黏膜屏障功能损伤,但损伤的机制仍不明确。有研究认为,肠黏膜屏障功能的维持可能呈能量依赖性[9]。当细胞能量代谢发生障碍时主要表现为细胞内ATP水平下降,ATP是体内最重要的高能化合物,亦是各种生命活动能量的直接供应者。细胞内80%以上的ATP在线粒体合成,线粒体功能障碍将致ATP合成受阻,造成细胞内各种合成反应中断、氧自由基生成增加及细胞膜稳定性受到破坏、细胞凋亡增加等严重后果[10]。而肠黏膜上皮细胞更新迅速,其对能量的供应变化极其敏感,当ATP生成障碍时,将造成肠黏膜上皮细胞的大量凋亡,肠黏膜屏障功能无法维持,肠黏膜通透性增加[11]。肠黏膜屏障的结构基础是相邻肠上皮细胞间的紧密连接,其封闭了相邻肠黏膜细胞间的空隙,能阻止大分子物质由此通过,其构成与解离亦受到能量代谢的影响[12,13]。因此,FK-506导致的细胞能量代谢障碍将造成肠黏膜上皮细胞紧密连接发生破坏,表现为肠屏障功能受损。本研究结果显示,应用FK-506后小鼠血浆D-乳酸水平明显上升,提示肠黏膜通透性增加,同时可观察到肠黏膜上皮紧密连接发生改变。
FK-506造成线粒体功能受损,导致能量生成障碍,其可能的作用机制:①线粒体氧化磷酸化脱偶联。氧化磷酸化是与电子传递过程偶联的磷酸化过程,是ADP被磷酸化生成ATP的酶促过程,亦是合成ATP的主要途径。线粒体氧化磷酸脱偶联后,磷酸化过程受阻,电子传递过程中将不能产生ATP。②增加线粒体中氧自由基的产生。氧自由基主要来源于线粒体呼吸链反应,细胞内90%以上的氧自由基由此产生。在正常情况下,电子通过呼吸链传递给O2生成H2O。当线粒体功能下降时,O2不能被有效利用,导致大量电子漏出,与O2反应生成氧自由基。氧自由基使生物膜中的多不饱和脂肪酸(PUFA)过氧化,导致生物膜中PUFA含量明显减少,膜的液态性、流动性和通透性发生改变[14]。
本研究中我们观察到FK506造成肠黏膜上皮细胞线粒体功能破坏,导致肠黏膜上皮细胞间紧密连接破坏,肠屏障功能受到损伤,且损伤程度呈剂量依赖性;其分子机制可能是通过损伤小鼠肠黏膜细胞线粒体功能而损伤肠黏膜屏障功能。
参考文献:
[1] 郭源,臧运金.肝移植术后排斥反应和免疫抑制治疗[J].山东医药,2003,43(30):51-52.
[2] 詹胜利,蔡明,石炳毅,等.他克莫司用于中国肾移植患者远期疗效的Meta分析[J].中国组织工程研究与临床康复,2009,13(53):10417-10422.
[3] 季曙明,陈江华,谭建明,等.肾移植后吗替麦考酚酯联合低剂量他克莫司加皮质激素的应用[J].中国组织工程研究,2013,17(5):777-784.
[4] 陆志城.免疫抑制剂他克莫司及其在肾移植中的应用[J].中国临床药学杂志,2001,10(2):128-131.
[5] 黄丽萍,石根玉,周华,等.他克莫司应用于初次肾移植三年临床观察[J].山西医药杂志,2007,36(6):501-503.
[6] Barkan H, Webster S, Ozeran S. Factors predicting the recurrence of adhesive small-bowel obstruction[J]. Am J Surg, 1995,170(4):361-365.
[7] 汪年松,桂定坤,李军辉.他克莫司在肾脏病中的合理应用[J].中华肾病研究,2014,3(4):200-203.
[8] Kusne S, Manez R, Bonet H, et al. Infectious complications after small bowel transplantation in adults: an update[J]. Transplant Proc, 1994,26(3):1682-1683.
[9] Madara JL, Parkos C, Colgan S, et al. The movement of solutes and cells across tight junctions[J]. Ann NY Acad Sci, 1992,664(1):47-60.
[10] Green DR, Reed JC. Mitochondria and apoptosis[J]. Science, 1998,281(5381):1309-1312.
[11] Mandel LJ, Bacallao R, Zampighi G, et al. Uncoupling of the molecular fence and paracellular gate functions in epithelial tight junctions[J].Nature, 1993,361(6412):552-555.
[12] Gopalakrishnan S, Hallett MA, Atkinson SJ, et al. aPKC-PAR complex dysfunction and tight junction disassembly in renal epithelial cells during ATP depletion[J]. Am J Physiol Cell Physiol, 2007,292(3):1094-1102.
[13] Joens T, Wittschieber D, Beyer A, et al. K+-ATP-channel-related protein complexes: potential transducers in the regulation of epithelial tight junction permeability[J]. J Cell Sci, 2006,119(15):3087-3097.

