大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病的不良反应及影响因素分析
大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病的不良反应及影响因素分析
王艳萍,卢愿,仲任,杨静,姜健
(青岛大学附属医院,山东青岛 266003)
摘要:目的观察大剂量甲氨蝶呤(HDMTX)治疗儿童急性淋巴细胞白血病(ALL)的不良反应,探讨不良反应影响因素。方法32例ALL患儿接受HDMTX治疗共102例次,观察治疗不良反应,并分析响因素。结果HDMTX治疗中的不良反应为骨髓抑制(68.6%)、口腔黏膜损害(70.6%)、胃肠道反应(55.9%)、肝功能损害(33.0%)、感染(31.4%)及皮肤损害(16.7%)。治疗后42 h甲氨蝶呤(MTX)血浆浓度越高,越容易发生口腔黏膜损害、胃肠道反应(P=0.003、0.003)。治疗后66 h MTX药物排泄延迟的患儿易发生颅内及血行播散感染等特殊部位的感染(P=0.030)。不同性别患儿口腔黏膜损害及胃肠道反应发生情况有统计学差异(P均<0.05),不同年龄患儿皮肤损害发生情况有统计学差异(P=0.020),不同临床分型、MTHFR C677T基因型各不良反应的发生情况无统计学差异(P均>0.05)。结论 HDMTX治疗的不良反应为骨髓抑制、口腔黏膜损害。胃肠道反应、肝功能损害、感染及皮肤损害,口腔黏膜损害、胃肠道反应发生与治疗后42 h MTX血浆浓度及性别有关,颅内及血行播散感染等特殊部位感染发生与66 h MTX浓度有关,皮肤损害发生与患儿年龄有关。
关键词:甲氨蝶呤;淋巴细胞白血病;口腔黏膜损害;胃肠道反应
doi:10.3969/j.issn.1002-266X.2015.35.036
中图分类号:R733.71文献标志码:B
收稿日期:(2015-04-10)
通信作者:卢愿
甲氨蝶呤(MTX)是一种叶酸还原酶抑制剂是儿童急性淋巴细胞白血病(ALL)缓解后治疗的关键药物之一[1]。本研究观察了HDMTX治疗ALL的不良反应,探讨影响不良反应影响因素。
1资料与方法
1.1临床资料选择2013年7月~2014年8月青岛大学附属医院收治的ALL患儿32例,男13例、女19例。32例ALL患儿接受HDMTX治疗102例次。按临床分型为高危型(HR)8例、中危型(MR)11例、标危型(SR)13例。
1.2治疗方法按照儿童ALL诊疗方案2008版[1]进行,HDMTX治疗前、后3 d给予碳酸氢钠碱化尿液,尿pH≥7;同时给予止吐、护胃、保心、保肝治疗。
1.3亚甲基四氢叶酸还原酶(MTHFR)C677T基因多态性检测取患儿2 mL EDTA抗凝静脉血,提取DNA,Hot start PCR法扩增DNA,反应在2720型热循环仪上进行,扩增产物长度为198 bp,DNA扩增后Q24实时定量焦磷酸分析仪对MHTFR基因C677T位点进行测序。
1.4血浆MTX检测HDMTX治疗后42 h取外周血2 mL,荧光偏振免疫法测定血浆MTX浓度,之后每24 h采集1次静脉血,直至血药浓度达0.1 μmol/L以下时停止检测和CF解救。
1.5不良反应观察血液系统不良反应参考美国国立癌症协会毒性分级标准;口腔黏膜损害、胃肠道反应、皮肤损害评价参考WHO标准[2~4];感染按发生感染的部位分为呼吸道感染、消化道感染、泌尿道感染、颅内感染、败血症等;肝功能损害:ALT<50 U/L为肝功能正常,50~200 U/L为轻度损害,≥200 U/L为重度损害。
1.6统计学方法采用SPSS17.0统计软件。等级资料采用非参数秩和检验。P<0.05为差异有统计学意义。
2结果
2.1HDMTX治疗不良反应HDMTX治疗不良反应为骨髓抑制(68.6%)、口腔黏膜损害(70.6%)、胃肠道反应(55.9%)、肝功能损害(33.0%)、感染(31.4%)及皮肤损害(16.7%)。
2.2MTX浓度与不良反应发生的关系治疗后42 h MTX血浆浓度越高,越容易发生口腔黏膜损害、胃肠道反应(P=0.003、0.003)。治疗后66 h MTX药物排泄延迟的患儿易发生颅内及血行播散感染等特殊部位感染(P=0.030)。见表1。
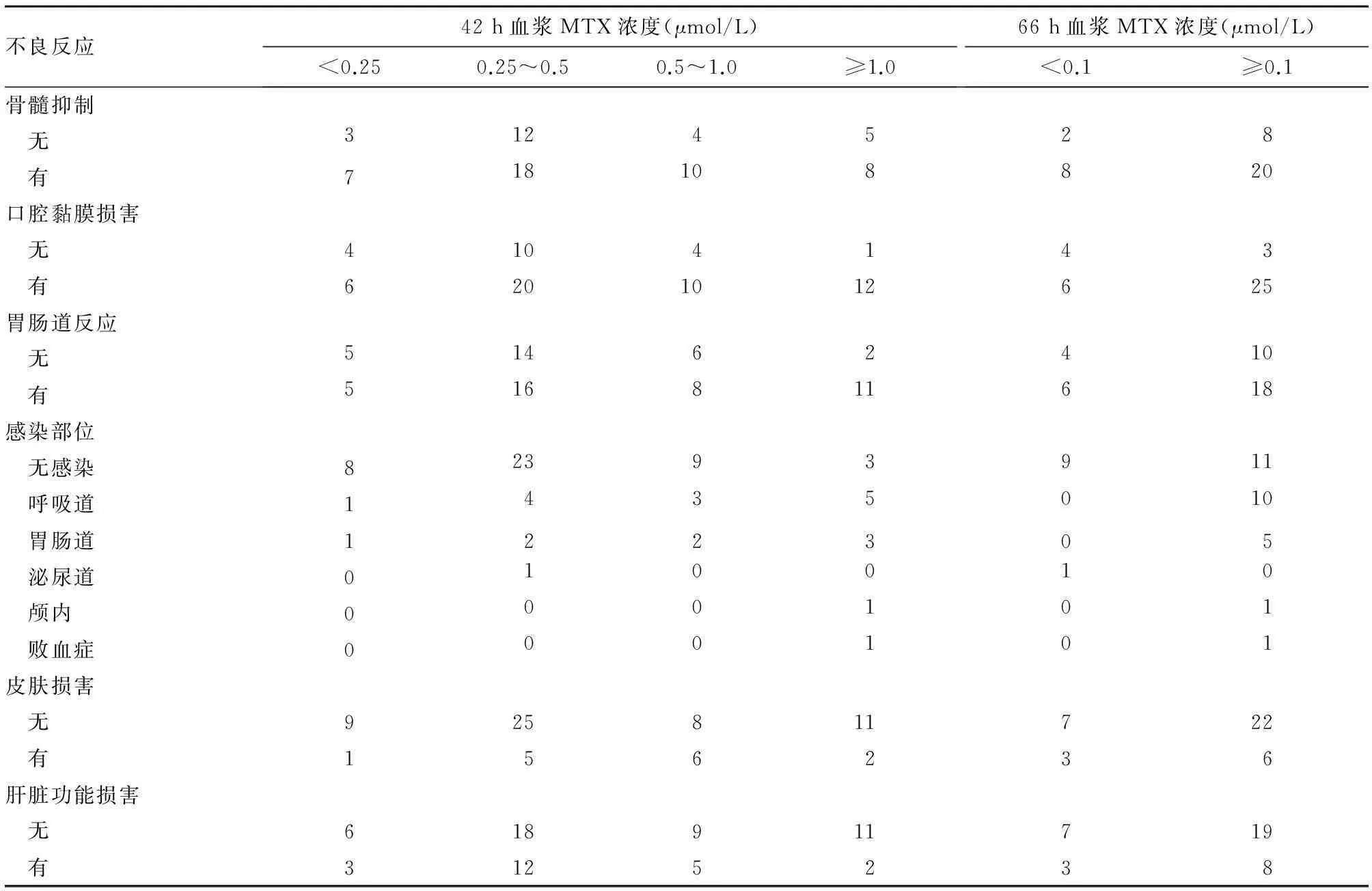
表1 治疗后42、66 h血浆MTX浓度与各不良反应之间的关系(例)
2.3性别、年龄、临床分型、MTHFR C677T基因多态性与不良反应发生的关系不同性别患儿口腔黏膜损害及胃肠道反应发生情况有统计学差异(P均<0.05),不同年龄患儿皮肤损害发生情况有统计学差异(P=0.020),不同临床分型、MTHFR C677T基因型患儿各不良反应的发生情况相比,P均>0.05。见表2。
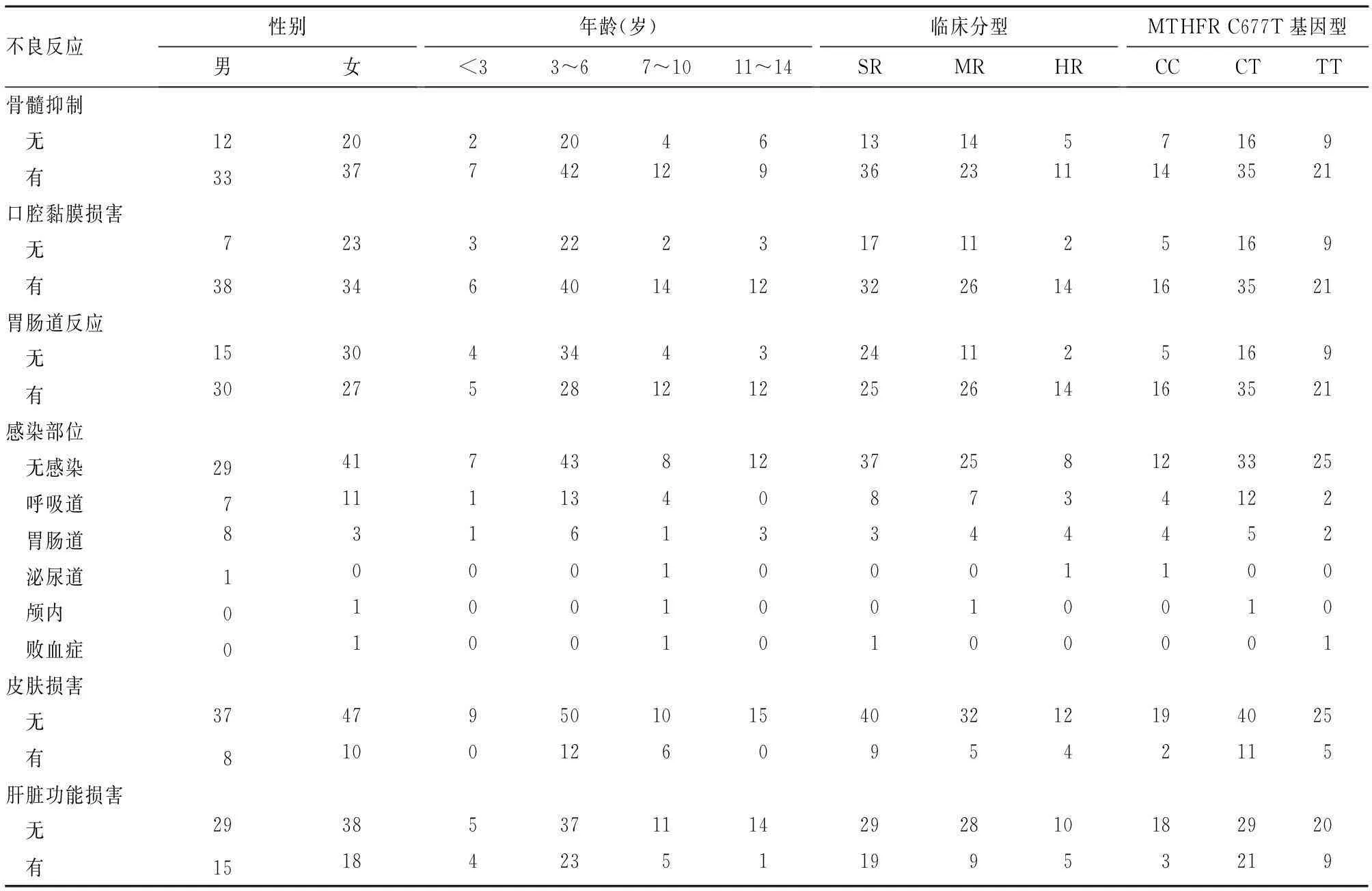
表2 性别、年龄、临床分型、MTHFRC677T基因型与各不良反应之间的关系(例)
3讨论
MTX主要经肾脏排泄,大部分以原形排出体外,MTX体内排泄指标为用药44、68 h血浆MTX浓度。本研究发现,HDMTX治疗后42、66 h分别有19.4%、73.7%患儿发生排泄延迟,提示42 h后仍需给予CF解救,促进MTX排泄。
MTX主要作用于细胞S期,其对处于对数增殖期的细胞作用最强,在有效杀灭肿瘤细胞的同时也对快速分裂的正常细胞有损害,细胞增殖越快,受到损害越严重,故组织细胞更新较快的部位较易发生不良反应。本研究发现,口腔黏膜、骨髓、胃肠道是易受损伤的部位,因此在用药前及用药过程中应对这些部位着重保护。
MTX在体内吸收、分布、消除受多种因素影响。Plard等[5]发现体质量、体表面积和年龄是影响MTX清除率的主要因素。还有研究[6]认为,MTX不良反应还与HDMTX持续静滴时间长短及有毒浓度持续时间长短有关。本研究结果也证实了这一点,因此,在治疗过程中及时监测MTX浓度,有助于避免排泄延迟发生。
国内外学者将性别作为影响MTX体内清除率的因素进行研究,各研究结果不尽相同[7~9]。本研究发现,男性患儿较女性患儿更易发生口腔黏膜损害,且往往程度更重,这与张峻等[9]的研究结果不一致,考虑与入组患儿不同年龄段性别构成比不同有关。本研究还发现,胃肠道反应发生情况在不同性别患儿之间有统计学差异,男性患儿较女性患儿更易发生胃肠道反应。
本研究中患儿皮肤损害的发生率为16.70%,皮肤损害发生情况在不同年龄患儿之间有统计学差异,进一步经LSD-t分析得出,7~10岁的患儿更易发生皮肤损害。经追问病史发现,发生皮肤损害的患儿中,多数在进行HDMTX治疗前有皮肤轻微损伤史或蚊虫叮咬、皮肤划伤、擦伤史。在进行HDMTX治疗过程中,MTX沿皮肤破损处排泄,造成局部浓度增高而发生皮肤损害。因此,应用HDMTX治疗前后及治疗过程中,保护患儿皮肤完整性有助于降低皮肤损害的发生率。
研究[10]发现,临床危险度分型是HDMTX治疗不良反应的独立危险因素。而王谷云等[11]观察了28例应用HDMTX治疗的ALL患儿,低危组MTX剂量为3 g/m2,中、高危组为5 g/m2,持续静滴24 h,36 h开始给予CF解救,两组不良反应发生率无统计学差异。本研究发现不同临床分型患儿不良反应发生情况无统计学差异。
MTX分子结构类似叶酸而与叶酸竞争结合MTHFR,因此MTHFR基因突变可能影响MTX疗效及不良反应[12]。人类MTHFR基因主要有MTHFR C677T和MTHFR A1298C两种突变类型,这两种突变类型可导致MTHFR活性不同程度降低。本研究发现MTHFR C677T基因各型间不良反应发生情况比较无统计学差异。
总之,HDMTX在治疗儿童ALL过程中不良反应发生的种类较多且发生频率较高,在HDMTX治疗过程中,应及时监测MTX浓度,根据MTX浓度调整治疗方案,有助于减少不良反应的发生。
参考文献:
[1] 孙伊娜,柴忆欢,何海龙,等.CCLG-ALL2008方案治疗儿童急性淋巴细胞白血病的临床疗效[J].江苏医药,2011,24(37):2922-2925.
[2] 罗云,娄世锋.谷氨酰胺防治血液肿瘤化疗后口腔炎的临床观察[J].重庆医学,2009,38(16):2038-2039.
[3] 田丽,陈长英,刘倩倩,等.化疗药物致消化道黏膜炎的治疗及护理进展[J].中华护理杂志,2013,48(7):658-661.
[4] 张学军,陆洪光.皮肤性病学[M].6版.北京:人民卫生出版社,2004:111-115.
[5] Plard C, Bressolle F, Fakhoury M, et al. A limited sampling strategy to estimate individual pharmacokinetic parameters of methotrexate in clildren with acute lymphoblastic leukemia[J]. Cancer Chemother Pharmacol, 2007,60(4):609-620.
[6] Arend VS, Reinhard H, Christoph B, et al. High-dose compared with intermediate-dose methotrexate in children with a first relapse of acute lymphoblastic leukemia[J]. Blood, 2008,111(5):2573-2580.
[7] Aumente D, Buelga DS, Lukas JC, et al. Population pharmacokinetics of high-dose methotrexate in children with acute lymphoblastic leukemia[J]. Clin Pharmacokinet, 2006,45(12):1227-1238.
[8] Zhang CY, Gu J, Li YZ, et al. Population pharmacokinetics of high-dose methotrexate administered in 329 children with acute leukemia[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2008,16(1):106-110.
[9] 张峻,杨龙,唐薇,等.大剂量甲氨蝶呤在急性淋巴细胞白血病患儿中的群体药动学[J].中国医院药学杂志,2007,27(8):1061-1066.
[10] Wang CL, Wu XY, Li HJ, et al. The incidence rate and risk factor analysis of delaying the discharge in the treat of childhood acute lymphoblastic leukemia(ALL) using larger dosage of methotrexate[J]. Chinese Nursing Research, 2014,28(11B):4074-4077.
[11] 王谷云,姚红霞,林丽娥.不同剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病的安全性观察[J].中国生化药物杂志,2014,1(34):102-103.
[12] Lopez-Lopez E, Martin-Guerrero I, Ballesteros J, et al. A systematic review and meta-analysis of MTHFR polymorphisms in methotrexate toxicity prediction in pediatric acute lymphoblastic leukemia[J]. Pharmacogenomics, 2013,13(6):498-506.

