ARDS患者预后影响因素分析
ARDS患者预后影响因素分析
支德源,段美丽,张淑文,刘壮,李昂
(首都医科大学附属北京友谊医院,北京100050)
摘要:目的分析急性呼吸窘迫症(ARDS)患者预后影响因素。方法ARDS患者132例,28 d内死亡51例(死亡组),存活81例(存活组)。收集患者诊断ARDS 24 h内的急性生理学与慢性健康状况评分Ⅱ(APACHE Ⅱ)评分、感染情况、器官功能衰竭数目;诊断ARDS 6 h内血气分析、血常规、血生化检测结果,血浆嗜中性粒细胞弹性蛋白酶(HNE)、肽酶抑制因子3(PI3)、肺表面活性蛋白D(SP-D)、肺表面活性蛋白A(SP-A)和克拉拉细胞蛋白16(CC16)检测结果。采用单因素分析及Logistic回归分析法分析ARDS预后影响因素。结果单因素分析结果显示,死亡组病因为感染者比例(63.9%)、合并肺外脏器功能衰竭比例(77.4%)高于存活组(54.1%、42.7%),死亡组年龄、APACHEⅡ评分、肺泡动脉氧分压差、血浆SP-D水平高于存活组,血浆PI3水平、氧合指数低于存活组(P均<0.05)。Logistic回归分析显示,APACHEⅡ评分(OR=6.578,P=0.008)、年龄(OR=4.386,P=0.021)、血浆SP-D(OR=3.423,P=0.027)为ARDS患者预后的独立影响因素。结论 患者年龄、血浆SP-D水平、APACHE Ⅱ评分为ARDS患者预后影响因素。
关键词:急性呼吸窘迫综合征;急性生理学与慢性健康状况评分Ⅱ;肺表面活性蛋白-D
doi:10.3969/j.issn.1002-266X.2015.39.033
中图分类号:R563.8文献标志码:B
急性呼吸窘迫综合征(ARDS)是在其他疾病基础上发生的进行性呼吸困难、顽固性低氧血症为主的一组急危重症,病死率高(40%~50%)[1]。ARDS的预后一直是危重症医学研究的热点。ARDS患者的年龄、合并脏器功能衰竭数目、败血症发生情况对死亡及临床治疗反应有一定影响[2]。急性生理学与慢性健康状况Ⅱ(APACHE Ⅱ)评分系统被认为能够较好地反映危重症患者疾病严重程度[3]。一些血浆生物标志物对ARDS预后、病情严重程度也有一定的预测价值[4],主要包括炎症标志物如嗜中性粒细胞弹性蛋白酶(HNE)[5]、肽酶抑制因子3(PI3),肺上皮细胞功能标志物如肺表面活性蛋白D(SP-D)、肺表面活性蛋白A(SP-A)、克拉拉细胞蛋白(CC16)等[6]。2011年1月~2013年6月,我们纳入上述指标,分析了ARDS患者预后影响因素,以期筛选评估预后较为可靠的指标。
1资料与方法
1.1临床材料ARDS患者132例,男72例、女60例,年龄35~90岁。均参照2012柏林ARDS诊断和治疗指南确诊。诊断ARDS后28 d内死亡51例(死亡组)、存活81例(存活组)。本研究已获得本院伦理机构审查委员会批准,并取得所有患者或其委托人知情同意。
1.2资料收集方法①患者诊断ARDS 24 h内APACHEⅡ评分;②诊断ARDS 24 h内感染情况(包括腹部、肺部、血液和组织感染),诊断ARDS时器官功能衰竭数目;③诊断ARDS 6 h内血气分析、血常规、血生化检测结果;④血浆HNE、PI3、SP-D、SP-A、CC16检测结果(ELISA法)。
1.3统计学方法采用SPSS21.0统计软件。计量资料以±s表示,组间比较采用成组t检验;计数资料采用χ2检验。多因素分析采用Logistic回归分析法。P<0.05为差异有统计学意义。
2结果
单因素分析结果显示,死亡组病因为感染者比例(63.9%)、合并肺外脏器功能衰竭比例(77.4%)高于存活组(54.1%、42.7%),死亡组年龄、APACHEⅡ评分、肺泡动脉氧分压差(A-a DO2)、血浆SP-D水平高于存活组,血浆PI3水平、氧合指数(PaO2/FiO2)低于存活组(P均<0.05)。见表1。将单因素分析中差异有统计学意义的上述8指标带入Logistic多因素回归分析,结果显示,年龄、APACHEⅡ评分、血浆SP-D水平是ARDS患者预后影响因素。见表2。
3讨论
ARDS是诱发危重症患者呼吸衰竭的主要原因,其发病机制迄今尚未完全阐明,但多数学者认为ARDS本质是炎症,其致病因子通过一系列激活途径导致体内过度或失控性炎症反应,晚期多并发多脏器功能衰竭[7]。因此筛选早期评估ARDS预后的指标尤为重要。本研究单因素分析结果显示年龄、病因是否为感染、肺外脏器衰竭数目、PaO2/FiO2、APACHE Ⅱ评分及血浆PI3、SP-D水平为ARDS患者预后影响因素,经多因素Logistic回归分析,筛选出年龄、APACHE Ⅱ评分、血浆SP-D水平为ARDS患者预后的独立影响因素。
表1 存活组与死亡组年龄、APACHE Ⅱ评分、A-a DO 2、PaO 2/FiO 2及血浆HNE、PI3、SP-D、SP-A、CC16水平比较( ± s)

表1 存活组与死亡组年龄、APACHE Ⅱ评分、A-a DO 2、PaO 2/FiO 2及血浆HNE、PI3、SP-D、SP-A、CC16水平比较( ± s)
组别年龄(岁)APACHEⅡ评分(分)A-aDO2PaO2/FiO2HNE(ng/mL)PI3(ng/mL)SP-D(ng/mL)SP-A(ng/mL)CC16(ng/mL)死亡组54.07±15.2418.41±5.43140.54±92.94218.90±50.1515.90±6.862007.18±1284.10448.35±198.5523.90±7.27149.66±48.71存活组59.76±16.86*26.53±5.68*176.33±86.84*151.73±48.63*16.17±4.681478.07±1072.77*701.46±291.67*24.37±5.89153.26±52.86
注:与死亡组相比,*P<0.05。
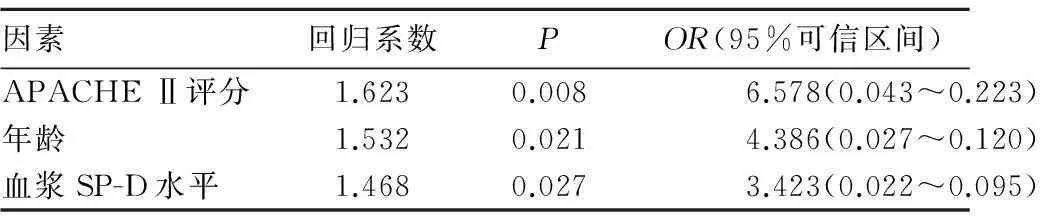
表2 ARDS患者预后影响因素Logistic回归分析结果
氧合指数较PaO2更能反映机体吸氧时呼吸功能障碍程度[8],但氧合指数易受PEEP影响,本研究纳入的均为ARDS初期患者,可排除PEEP对氧合指数的影响。研究[9]表明,年龄对ARDS患者预后有一定影响,老年患者肺弹性机能降低,咳嗽反射减弱,对药物治疗的反应性较年轻患者减弱,均可导致其预后不良。本研究结果显示ARDS患者年龄越大、病死率越高,与既往研究结论相符合。APACHE Ⅱ评分规则中包含众多因素如呼吸、心率、血压、患者意识、组织灌注和原发病等,是目前应用最广泛且较权威的危重病严重程度评价和预后评估的指标。我们发现,APACHE Ⅱ评分影响ARDS患者预后,这与相关文献[10]结果一致,即转入ICU时患者病情越差,危险性越高,预后越差。
研究证实,以嗜中性粒细胞(PMN)在触发和延续ARDS过程中起重要作用[11]。被激活的PMN可释放炎症介质造成肺损伤。HNE是人体内最具破坏性的蛋白酶,PI3是目前已发现的两个小分子量蛋白酶抑制因子之一,对HNE有更高的特异性和更强的抑制能力[12]。PI3蛋白还可与细胞外基质蛋白共价结合,同时发挥抑制蛋白酶的作用。本研究中,死亡组患者血浆PI3水平低于对照组,HNE水平无显著差异,提示PI3对改善ARDS患者预后可能有一定作用。
肺表面活性物质(PS)具有降低肺泡表面张力、提高肺顺应性、促进肺气体交换等生理功能,其主要成分是90%的磷脂和8%~10%的肺表面活性蛋白(SP)。SP按其发现先后顺序,有SP-A、SP-B、SP-C、SP-D 4类,其中SP-A和SP-D是亲水性蛋白,主要调节肺免疫功能,参与主动防御[13]。研究[14,15]表明,SP-D不仅可识别、清除肺内异物和凋亡细胞,在抑制炎症反应、抑制自身抗体产生等方面也有重要作用。ARDS患者血浆SP-D水平升高反映肺损伤程度加重及肺泡上皮屏障渗透能力增强。本研究中死亡组血浆SP-D水平高于存活组,而两组SP-A水平差异无统计学意义,可能是因为SP-D与磷脂连接的紧密程度不如其他肺表面活性蛋白,可在病情加重早期释放入血[16]。
CC16由细支气管上皮细胞分泌[17],在呼吸道抗氧化应激及抗炎中发挥重要作用,其易通过肺泡膜进入血液循环,因此其分泌水平增高时容易检出。ARDS早期,呼吸道抗氧化应激与抗炎反应增强,支气管上皮细胞分泌CC16增多,但若ARDS病情恶化,支气管上皮细胞受损加重,分泌能力下降,CC16水平也会相应降低,这可能是本研究中死亡组与存活组血浆CC16水平无统计学差异的原因。
总之,本研究发现,患者年龄、血浆SP-D水平、APACHEⅡ评分为ARDS患者预后影响因素。但受样本量限制,我们仅纳入5种既往研究报道与ARDS有关的生物标志物,尚可能存在对ARDS预后评估有价值的其他标志物[18]。另外,本研究纳入患者均来自重症医学科病房,上述结论未必适用于全部的ARDS患者。最后,本研究用ELISA法检测生物标志物,结果仅反映抗原水平,而非生物活性,可能也会对结论的可靠性造成一定影响。
参考文献:
[1] Afshari A, Brok J, Moller AM, et al. Inhaled nitric oxide for acute respiratory distress syndrome and acute lung injury in adults and children:a systematic review with meta -analysis and trial sequential analysis[J]. Anesth Analg, 2011,112(6):1411-1421.
[2] Ware JH. The limitations of risk factors as prognostic tools[J]. N Engl J Med, 2006,355(25): 2615-2617.
[3] Delibegovic S, Markovie D, Hodzic S. Apache ii scoring system is superior in the prediction of the outcome in critically ill patients with perforative peritonitis[J]. Medicinski Arhiv, 2011,65(2):82-85.
[4] Parsons PE, Eisner MD, Thompson BT, et al. NHLBI Acute Respiratory Distress Syndrome Clinical Trials Network.Lower tidal volume ventilation and plasma cytokine markers of infl ammation in patients with acute lung injury[J]. Crit Care Med, 2005,33(1):1-6.

