陕西省药品经营企业药品不良反应报告调查分析
陕西省药品经营企业药品不良反应报告调查分析
白军锋1,冯变玲2,郭佳栋2,张雪梅2,张 智1
(1.陕西省食品药品监督管理局药品不良反应监测中心,西安710065;2.西安交通大学药学院,西安710061)
摘要:目的调查陕西省药品经营企业药品不良反应报告工作开展情况,提供切实可行的建议。方法 采用问卷调查法对陕西省药品经营企业药品不良反应监测工作进行调查。结果 统计分析陕西省药品经营企业药品不良反应监测工作的基本建设、制度建设、经费支持、培训交流和上报情况等信息。结论 针对统计结果,在基本建设、制度建设等方面提出建议。
关键词:药品经营企业;药品不良反应;陕西省
doi:10.3969/j.issn.1004-2407.2015.06.029
中图分类号:R969.3文献标志码:A
基金项目:国家社会科学基金资助项目(编号:13BGL132)
收稿日期:(2015-01-18)
Empirical research on the status of adverse drug reaction reporting entities in Shaanxi province
BAI Junfeng1,FENG Bianling2,GUO Jiadong2,ZHANG Xuemei2,ZHANG Zhi1(1.ADR Center of Shaanxi Food and Drug Administration,Xi′an 710065,China;2.School of Pharmacy,Xi′an Jiaotong University, Xi′an 710061, China)
Abstract:ObjectiveTo analyze the present situation of adverse drug reaction (ADR) reporting entities in Shaanxi province, and to provide practical recommendations for the construction of organization system. MethodsThe questionnaire was administered to Shaanxi province reporting entities, and the subjects were selected by cluster sampling. ResultsAfter the information analysis of the returned questionnaires, we concluded the information of the present situation of Shaanxi province reporting entities, institution building, and status of adverse drug reactions reporting. ConclusionThe present study identified some challenges of drug safety monitoring in Shaanxi province.
Key words: pharmaceutical trading enterprise;ADR;Shaanxi province
药品不良反应是指合格药品在正常用法、用量下出现的与用药目的无关的或意外的有害反应[1]。《中华人民共和国药品管理法》明确指出:“国家实行药品不良反应报告制度,药品生产企业、药品经营企业、医疗卫生机构应按规定报告所发现的药品不良反应”。药品经营企业作为药品不良反应报告制度实施的主体之一,在药品不良反应报告和监测中的作用不可或缺[2]。
根据国家药品不良反应监测年度报告(2013年)[3]统计显示,医疗机构的报告数量占78.4%、药品经营企业的报告占19.6%、药品生产企业的报告占1.4%、个人及其他来源的报告占0.6%。药品经营企业作为药品不良反应报告和监测中的基层单位,是药品不良反应工作中的重要组成部分;但从报告统计来看,药品不良反应的监测和上报工作还需要进一步的发展和完善[4]。
本研究以陕西省药品经营企业为研究对象,通过问卷调查,了解其监测现状,为陕西省药品不良反应监测体系在组织结构、技术体系、制度政策、人员等方面提供现实依据和实证指导。
1 资料与方法
本研究的调查问卷主要依据世界卫生组织有关药品安全体系的建设要求[5],同时结合我国药品不良反应监测工作实际,在专家指导下制定了调查问卷。依照整群抽样的方式从陕西省隶属的10个地区进行抽样,样本覆盖西安、榆林、延安、宝鸡、渭南、咸阳、安康、汉中、铜川和商洛共10个市级行政区。抽样过程中市辖区、县都尽量保持均匀分布。最后,将问卷以电子版形式发放至所选择的药品经营企业,调查内容主要包括药品经营企业的基本信息、药品不良反应监测工作概况、药品不良反应报告情况以及其他情况。调查所得数据采用SPSS 19.0软件进行统计分析。
2 结果
本次调查于2014年4月~2014年7月进行,共回收有效问卷153份。据统计,153家药品经营企业中,国有企业19家,集体企业1家,私营企业128家,外资企业3家,其他企业2家。99.3%的药品经营企业有专门工作人员负责药品不良反应工作。
对药品经营企业工作人员的职称、专业和学历进行统计,被调查药品经营企业包括药品批发企业13家和药品零售企业140家;其中,零售连锁企业有75家。分布于各地市的连锁企业按该企业在本地的总人数进行统计,非连锁企业则按照各单体经营企业进行统计,结果显示每家药品经营企业工作人员平均为10.82人,其中专业技术人员平均4.48人、药士1.24人、药师2.19人和主管药师0.35人;对学历进行统计,中专以下1.63人、中专5.42人、大专2.41人和本科0.78人;工作人员专业分布,药学3.82人、医学0.97人、制药0.20人、药品营销0.89人和其他专业3.07人。
2.1基本建设调查问卷针对药品经营企业在药品不良反应监测工作中是否有明确授权、完善的组织机构、明确的职责以及清晰的工作流程进行调查。99家(64.7%)药品经营企业在药品不良反应监测过程中有明确的授权、117家(76.5%)有完整的组织机构,114家(94.1%)有明确的职责,105家(68.6%)有清晰的工作流程。调查结果显示,药品经营企业关于药品不良反应监测工作的基础建设情况基本良好,在制定清晰的工作流程和授权方面还需继续加强。
明确的工作职责可以实现监测活动的科学配置,还可以提高工作效率和工作质量。药品不良反应监测工作在保证药品质量、维护人民群众用药安全方面起着重要作用。对药品经营企业从事药品不良反应监测工作的人员隶属部门进行调研,92.8%的被调查企业从事不良反应工作的人员隶属于质量管理部门,仅有4.6%隶属于药品业务部门。
对被调查的药品经营企业工作人员的工作职责进行统计,具体情况见表1。
表1 被调查药品经营企业ADR监测人员工作职责
Tab.1 The responsibilities of the ADR monitoring in Shaanxi province pharmaceutical enterprises
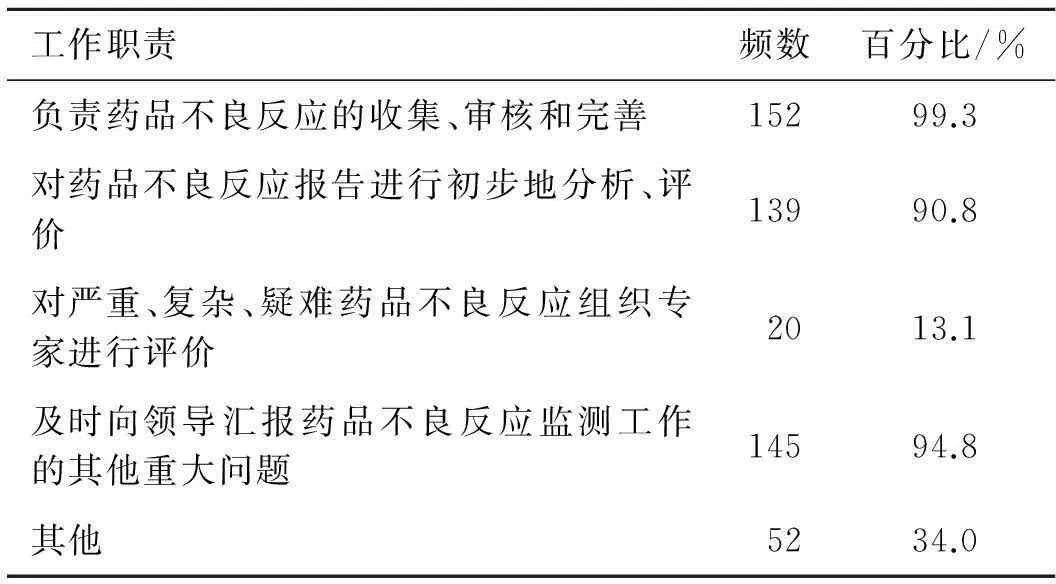
工作职责频数百分比/%负责药品不良反应的收集、审核和完善15299.3对药品不良反应报告进行初步地分析、评价13990.8对严重、复杂、疑难药品不良反应组织专家进行评价2013.1及时向领导汇报药品不良反应监测工作的其他重大问题14594.8其他5234.0
统计结果显示,“负责药品不良反应的收集、审核和完善”、“及时向领导汇报药品不良反应监测工作的其他重大问题”以及“对药品不良反应报告进行初步地分析、评价”是药品经营企业在不良反应报告工作中的主要职责;但是对“严重、复杂、疑难药品不良反应组织专家进行评价”的选择比例仅为13.1%,这可能与药品经营企业的具体工作职能相关。分别对药品批发企业和药品零售企业进行统计,在“负责药品不良反应的收集、审核和完善”方面,两者所选比例分别为100%和90%;在对“药品不良反应报告进行初步分析、评价”方面,两者所选比例分别为91.4%和79.3%;在“及时向领导汇报药品不良反应组织专家进行评价”方面,所选比例分别为94.2%和81.3%。统计结果显示,药品批发企业由于在硬件条件、人员配备方面均优于零售企业,在“对药品不良反应报告进行初步地分析、评价”等技术性较强的工作职责方面的选择比例也会高于零售企业。
被调查企业的硬件资源配置方面,计算机(99.3%)、电话(94.8%)、打印机(88.2%)配备比率较高;网络数据库(39.2%)、照相机(35.3%)、摄像机(5.2%)、碎纸机(3.9%)配备比率较低。
2.2制度建设在被调查的药品经营企业中,90.1%的企业有药品不良反应监测工作的标准工作流程;88.2%的药品经营企业建立了药品不良反应监测的考核制度;69.7%的药品经营企业建立了风险管理计划或风险控制措施;90.1%的药品经营企业建立了突发性药品不良反应事件应急处理制度。
根据“对药品经营企业工作人员对本企业关于药品不良反应监测工作满意度”的调查,题目选项设置为很满意、比较满意、不太满意和很不满意,分别记4分、3分、2分和1分,每个被调查者的态度分就是他对这道题的回答所得分数。经统计,药品不良反应报告工作人员满意度平均分数为1.7,标准差为0.55,满意度评分整体低于平均值2.5。说明被调查药品经营企业工作人员对本企业药品不良反应监测工作满意度偏低,监测工作有待于进一步加强。而此问题对药品批发企业单独进行统计,结果药品批发企业的满意度平均值为2.8,标准差为0.91,说明在药品批发企业中工作人员对本企业药品不良反应监测工作基本满意。
2.3 培训交流调查显示,仍然有33.1%的被调查企业工作人员认为药品不良反应会导致医疗纠纷的发生,进一步说明培训交流、理清药品不良反应的基本概念对于药品不良反应监测的重要性。
对培训交流方面的调查结果显示,85.0%(130家)的药品经营企业在上一年度接受过药品不良反应的相关培训,但培训的范围偏小,平均每个企业仅有2.4人次接受过该培训,有98.7%的药品经营企业为工作人员提供有关药品安全信息的相关资料;有61.4%的药品经营企业开展过有关药品安全问题的宣传教育活动。
据统计,92.8%的药品经营企业在药品不良反应监测工作遇到问题时,会与药品不良反应监测中心进行沟通交流;94.8%的药品经营企业会提供针对药品不良反应或药品安全问题的咨询服务。结果显示,随着药品不良反应监测工作的不断推进,药品经营企业与药品不良反应监测中心的沟通交流情况良好,对药品不良反应知识的普及还需进一步加强。
2.4 上报情况针对药品不良反应上报形式的调查结果显示,有87.6%的被调查企业上报报告为书面报告(纸质报表);63.7%的报告通过网络报告系统上报;电话报告和E-mail报告所占比例较低。96.7%的药品经营企业药品不良反应工作人员在发现药品不良反应后会选择立即上报。同时,调查结果显示,只有60.8%的被调查者认为上报的药品不良反应报告会被相关工作人员全部录入药品不良反应数据库中。
本研究还针对ADR患者的信息记录、药品不良反应初步评价以及上报ADR后得到上级部门的信息反馈情况进行了调查。结果显示,66.9%的被调查企业药品不良反应工作人员能够对遭受药品不良反应的患者进行详细记录;74.2%的被调查企业上报药品不良反应报告前会对药品不良反应病例做初步评价工作。被调查药品经营企业所上报的药品不良反应仅有46.7%会得到省级或市级ADR中心的信息反馈,基层部门对本地区药品不良反应的实际状况了解有限。
3 讨论
3.1 基本建设统一、明确的职能定位能够保障日常监测工作的顺利开展。建议不良反应报告主体明确规定负责药品不良反应监测工作的人员应该承担的职责,细化操作流程以及各种工作标准。使工作人员在日常工作中有章可循,并定期组织相关工作人员学习与考核。加强药品不良反应监测机构组织建设,统一省级ADR监测机构的建设,以实现我国ADR监测工作规范化、标准化管理,与全球ADR监测工作接轨。有些药品经营企业没有建立良好的岗位责任制度,监测管理混乱,缺少岗位责任制度。
在调查报告的主体中,大部分药品经营企业ADR监测机构都配备了计算机、打印机、传真机等基本的办公设备,已能满足正常的工作需要。网络数据库等软件资源已成为制约药品不良反应监测工作开展的重要因素之一,因此建议经营企业在软件资源配备上进行优化。
3.2 培训交流加强对药品经营企业工作人员关于药品不良反应基本知识的普及,可采用药品安全公报(或刊物)等形式向工作人员传递药品安全信息等内容。建议重视此类交流学习的方式,可以在机构内部定期出版或者向外部订阅药物警戒、中国药品不良反应等相关信息资料或期刊。加强信息交流,为方便工作人员查找和阅读ADR信息,建议统一各省级ADR监测机构发布的药品不良反应信息的资料名称。
此外,由于部分药品经营企业工作人员对ADR概念不清,错误地认为ADR与医疗纠纷有关。因此,建议对工作人员定期组织药品相关知识的讲座培训,帮助其了解掌握ADR的基础知识和报告方法。
3.3 上报情况完整地记录发生药品不良反应患者的信息有助于药品安全性评价工作,药品经营企业应重视记录工作,对负责记录的工作人员进行专业培训和定期考核。ADR的监测是一种专业化很强的工作,工作人员需要药学专业知识才能很好地完成监测报告的完整上报,加强专业技术人员的比例对于不良反应报告的有效上报具有重要意义。报告质量贯穿整个监测工作过程中,建议制定详细的ADR报告填写指南,指导报告者科学、规范地填写ADR报告;加强对ADR监测网络、ADR信息规范性的控制,比如在线报告时,若出现逻辑错误或缺项等问题,应自动弹出对话框予以警示,直到填写无误后方可上报。信息的顺畅流动是规范管理活动的充分体现,调查结果显示,上级部门对上报的药品不良反应进行信息反馈的比例偏低,基层单位难以及时了解安全用药的相关信息,建议在今后的监测工作中,管理部门应加强与基层监测相关人员的交流反馈,指导其安全合理地使用药品。
参考文献:
[1]张兵,冯变玲,赵晓红,等.青霉素类药物不良反应报告分析[J].西北药学杂志,2013,28(5):524-526.
[2]耿东升.对药品不良反应定义及其分类的商榷[J].西北药学杂志,2011,26(1):59-61.
[3]CFDA.国家药品不良反应监测年度报告[EB/OL].[2013-5-14].sfda.gov.cn/WS01/CL0078/ 99794. html.
[4]胥广英,曲鹏旭.药品经营企业在药品不良反应监测中的思考[J].辽宁中医杂志,2010,37(1):217-218.
[5]Sten O,Shanthi N P,Andy S,et al.Pharmacovigilance activities in 55 low- and middle-income countries[J].Drug safety,2010,33(8):689-703.

