血浆miR-142-5p在肺癌早期诊断中的价值研究*
汪奇云,刘和录,华建江,吴雄君,徐志康,刘 琼
(广州医科大学附属深圳沙井医院检验科,广东深圳 518104)
肺癌是最常见的恶性肿瘤之一,其病死率在各种恶性肿瘤中居首[1]。肺癌的早期诊断及早期治疗至关重要。因临床新发病例中大多属于晚期肺癌,所以如果能早期诊断对肺癌的治疗和预后具有非常重要的意义。现有检查手段如X光敏感性低,难实现早期诊断;支气管镜检法对于中央型肺癌的诊断比较有效,但是其缺点是一种侵入性检查手段;CT扫描为广泛非侵入性检查方法,但其不能高效区分良性病变及肺癌。目前临床肺癌早期诊断上缺乏高特异度、高灵敏度的血清学检查办法,因此如果能寻求早期特异的诊断方法,对提高患者的生存率具有重要意义。本研究通过实时荧光定量PCR检测比较早期肺癌患者和健康成人血浆中游离miR-142-5p的表达水平,从而探讨其作为肺癌患者早期诊断指标的临床价值。
1 材料与方法
1.1 研究对象 在患者知情同意下,我们在广州医科大学附属深圳沙井医院和广州医科大学呼吸疾病研究所收集标本。挑选2014年4月~10月未经治疗且处于疾病I,II期的新发病例,经病理学或细胞学确诊的55例肺癌患者作为研究组(C),其中I期患者25例、II期30例,年龄60.71±10.62;53例健康成人作为对照组(N),年龄57.11±12.09。病人入选标准包括疾病局限于胸部,没有远端转移的证据。标本采集前一年内没有外科手术史和放射治疗史。案例跟踪两年。癌症和非癌症样本根据年龄、性别匹配,经统计学分析,差异无统计学意义(P>0.05)。
1.2 试剂与仪器 ABI stepone plus荧光PCR仪购自美国ABI公司;MiScrip ReverseTranscription Kit试剂盒购自德国Qiagen公司;普通PCR仪(SLAN-96P)购自上海宏石。
1.3 实验方法
1.3.1 血浆收集:用EDTA-K2抗凝管抽取静脉血液5.0 ml并混匀抗凝,30 min内于4℃,3 000 r/min离心10 min。上层血浆分装至1.0 ml冷冻管,每管0.5 ml,置-80℃贮存备用。
1.3.2 miRNA提取:用miReasy Mini Kit试剂盒(Qiagen,德国)提取血浆中的miRNA。主要步骤如下:①向400 μl血浆中加入5倍体积的QIAzol试剂,室温放置5 min;②加入等体积100%(v/v)氯仿,放置2~3min;③4℃,12 000 r/min离心15 min后将离心机调至室温;④取上层水相300 μl,加入1.5倍体积100 g/dl乙醇,充分混匀;⑤将混合液依次转移至RNeasy Mini spin column柱子中,12 000 r/min室温下离心15 s,弃废液;⑥加700 μl Buffer RWT,离心 (同上),弃废液;⑦加500 μl RPE,离心(同上),弃废液;⑧重复步骤⑦;⑨换新2 ml收集管,空转2 min;用30 μl的RNease-free water溶解RNA。置于-70℃低温冰箱备用。为将RNA提取效率及PCR数据标准化,在每个提取标本中加入25 fmol的合成线虫miR-54(Cel-miR-54)。
1.3.3 RT-qPCR体系建立:应用miScript Reverse Transcription Kit 试剂盒(Qiagen,德国)于普通PCR仪上进行miRNA的逆转录。设计特异性引物:采用Primer5.0软件设计,Cel-miR-54作为内参照,引物序列为TACCCGTAATCTTCATAATCCGAG,miR-142-5p引物序列为CATAAAGTAGAAAGCACTACT。由于血浆中miRNA的浓度较低,按照试剂盒说明书,取15 μl模板RNA+4 μl Buffer RT+1 μl Mix,反应体系为20 μl,反应条件为:37℃1 h,95℃5 min。qPCR反应采用miScript SYBR Green PCR Kit试剂盒,按照试剂盒说明书依次加入反应所需的cDNA模板和试剂:①1 μl cDNA+0.4 μl miRNA特异性引物+10 μl Mix+2 μl UP+6.6 μl H2O;②1 μl cDNA+0.4 μl U6 F/R+10 μl Mix+8.2 μl H2O。反应体系均为20 μl。反应条件为:95℃15 min,94℃30 s,55℃15 s,70℃30 s,设置2个重复孔,40个循环结束。反应在qPCR仪上进行(ABI step one plus)。
1.3.4 分析RT-qPCR数据:应用RT-qPCR技术检测肺癌血浆中游离miR-142-5p的表达水平。miR-142-5p为目的基因,Cel-miR-54作为内参基因作数据的标准化处理。肺癌样本作为研究组C,健康成人作为对照组N。目的基因的相对表达量(Re)应用2-△Ct公式进行计算,ΔCtc=Ctc目-Ctc内,ΔCtn=Ctn目-Ctn内,ΔCt值越小,表示基因相对表达量越高,对目的基因的相对表达量进行对数处理后,符合正态分布规律。
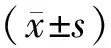
2 结果
2.1 肺癌患者与健康成人血浆中miR-142-5p结果比较 miR-142-5p在肺癌患者组的相对表达量为8.878 2±2.251 2,健康成人组相对表达量为12.000 0±3.694 4,肺癌组明显高于健康成人组,差异有统计学意义(t=-5.325,F=13.561,P=0.000,P<0.01),同时测得FC值为8.704 7,数值>1,也表示miR-142-5p在肺癌组中高表达。
2.2 miR-142-5p在早期诊断肺癌的价值评估 为了更好地评价miR-142-5p在肺癌早期诊断的诊断价值,采用SPSS17.0软件制作miR-142-5p的受试者ROC曲线图,分析结果显示,miR-142-5p诊断肺癌的ROC曲线下面积(AUC)为0.749,95%置信区间为0.657~0.841,同时得到临床诊断临界值为10.050,灵敏度为66.0%,特异度为83.6%,见图1。
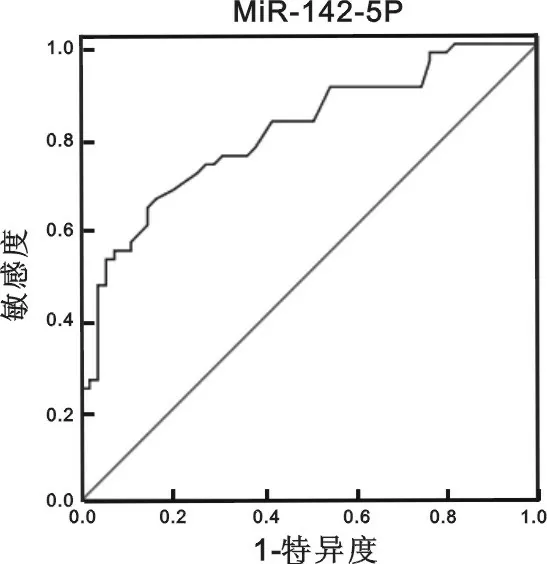
图1 miR-142-5p的ROC分析
3 讨论
3.1 微小RNA(microRNA或miRNA)是一类长度为18~24个核糖核苷酸组成的非编码小分子RNA。它主要通过与靶标基因完全或不完全配对,降解靶标基因mRNA或抑制其翻译,从而参与调控个体发育、细胞凋亡、增殖及分化等生命活动,并参与包括肿瘤在内的多种疾病过程[2,3]。Mitchell等[4]研究证实,miRNAs在血清或血浆中非常稳定,在高温、骤冷,还有强酸、强碱条件下都不会被降解,特别是能够抵抗RNA酶的降解,表明血清或血浆miRNAs可以作为足够稳定的生物标记物来应用于临床。近年来miRNA在肿瘤的诊断上价值也越来越受重视,Chen等[5]采用Solexa测序法对健康人血清、非小细胞肺癌血清的miRNA进行测序分析,结果显示,肺癌患者血清miRNA分子谱与健康对照者明显不同。miRNA还被发现可能成为新的肺癌早期诊断和癌症进程相关的标记物,有助于肺癌的早期诊断和个性化治疗[6]。有研究发现在某些常见肿瘤如膀胱癌[7]、食管鳞状细胞癌[8]等某些miRNA存在异常表达。miRNA已经成为现代肿瘤学的研究热点,为肿瘤的早期诊断、治疗、预后提供了可靠的依据和新的方向。
3.2 miR-142位于人类17号染色体上,其含有两个亚单位:miR-142-3p和miR-142-5p,分别为前体的3’端和5’端加工而来。有研究[9,10]发现, miR-142-5p在肾癌组织中表达量明显高于癌旁组织,在特应性皮炎患者外周血单个核细胞中存在高表达。但关于miR-142-5p与肺癌关系的相关文献报道较少,为探讨miR-142-5p与肺癌关系我们采用RT-qPCR检测肺癌及健康成人血浆中的miR-142-5p表达水平。RT-qPCR经证实为检测miRNA最常用且有效的方法[11]。本研究结果发现miR-142-5p在肺癌组的相对表达量明显高过健康成人组(P<0.01),提示miR-142-5p可能在肺癌的发生发展中起到重要作用。
3.3 ROC曲线是肿瘤标志物临床应用中一种全面、准确评价诊断实验的非常有效的方法。面积在0.5以下时无诊断价值;面积在0.5~0.7时有较低的准确性;面积在0.7~0.9时有较高的准确性;面积在0.9以上时准确性最高。我们通过ROC曲线对miR-142-5p对肺癌的诊断价值进行分析评价,发现ROC曲线下面积为0.749,由此可见,miR-142-5p对早期肺癌有一定的诊断价值。miR-142-5p诊断肺癌的特异度较高但敏感度不够,可作为排除指标。由于尚无法进行大样本研究,所以miR-142-5p诊断早期肺癌的特异度、灵敏度、准确度以及建立正常人群参考范围等问题尚需进一步研究。可以预见,随着临床相关研究的开展,miR-142-5p作为肺癌的早期诊断指标将有更广阔的应用前景。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistice,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2] Vasudevan S,Tong Y,Steitz JA.Switching from repression to activation:microRNAs can up-regulate translation[J].Science,2007,318(5858):1931-1934.
[3] Lin PY,Yu SL,Yang PC.MicroRNA in lung cancer[J].Rr J Cancer,2010,103(8):1144-1148.
[4] Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30):10513-10518.
[5] Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[6] Olson P,Lu J,Zhang H,et al.MicroRNA dynamics in the stages of tumorigenesis correlate with hallmark capabilities of cancer[J].Genes Dev,2009,23(18):2152-2165.
[7] 谢小娟,朱 娜,潘晶晶,等.miRNA-148a在膀胱癌组织中的表达及生物信息学分析[J].现代检验医学杂志.2015,30(4):6-9,13.
Xie XJ,Zhu N,Pan JJ,et al.Expression of miRNA-148a in bladder carcinoma tissues and its bioinformatics analysis[J].Journal of Modern Laboratory Medicine,2015,30(4):6-9,13.
[8] 王 静,王 成,张春妮.血清miR-25和miR-100作为食管鳞状细胞癌诊断和预后标志物研究[J].现代检验医学杂志.2015,30(5):17-21.
Wang J,Wang C,Zhang CN.Study on serum miR-25 and miR-100 as diagnostic and prognostic markers for esophageal squamous cell carcinoma[J].Journal of Modern Laboratory Medicine,2015,30(5):17-21.
[9] 赵 爽,王海峰,刘凌琪,等.miRNA-142-5p在肾细胞癌中高表达的研究[J].山东医药,2008,48(41):12-14.
Zhao S,Wang HF,Liu LQ,et al.Study on over-expression of miRNA-142-5p in renal cell carcinoma[J].Shandong Medical Journal,2008,48(41):12-14.
[10] 肖能鑫,史丙俊,刁庆春,等.miRNA-142-5p在特应性皮炎中的表达及其靶基因预测[J].重庆医学,2013,42(15):1701-1702,1705.
Xiao NX,Shi BJ,Diao QC,et al.Expression of miRNA-142-5P in atopic dermatitis and its target gene prediction[J].Chongqing Medicine,2013,42(15):1701-1702,1705.
[11] Pall GS,Hamilton AJ.Improved northern blot method for enhanced detection of small RNA[J].Nat Protoc,2008,3(6):1077-1084.

