马钱子碱对人慢性粒细胞白血病KCL-22细胞的增殖及凋亡作用*
韩泽平,谢杏仪,何金花,黎毓光,吕钰冰,周嘉彬
(广州市番禺区中心医院检验科,广州 511400)
传统中药马钱子(又名番木鳖),是马钱子科植物马钱子的干燥成熟种子,具有抗炎消肿,散结活血,通络止痛等功效,临床广泛应用于各种风湿顽痹、骨病和肿瘤以及癌性疼痛等治疗[1]。马钱子碱(Brucine)是从马钱子中提取的吲哚型结构的生物碱,是马钱子组成和发挥药效的主要成分之一。研究发现,马钱子碱不仅可在体外显著地抑制多种细胞增殖,诱导肝癌、乳腺癌、结肠癌、多发性骨髓瘤等多种癌细胞产生凋亡[2],而且动物实验表明马钱子碱也可有效地抑制体内肿瘤的生长和转移[3,4],成为近年来抗肿瘤药物研究的一个热点。本实验旨在研究马钱子碱在体外对人慢性粒细胞白血病细胞株KCL-22细胞的增殖及凋亡作用,为临床治疗白血病提供实验依据。
1 材料与方法
1.1 主要试剂及药物 胎牛血清、RPMI 1640培养基(美国Hyclone公司),Annexin V-FITC/PI 细胞凋亡检测试剂盒(美国ABGAB公司),多克隆兔抗人细胞色素C(Cyt-C),Caspase-3,Caspase-9(美国Santa Cruz公司),Bcl-2,Bax为鼠抗人单克隆抗体(美国Cell signal公司),兔抗人β-actin多克隆抗体及二抗(辣根过氧化物酶链接的抗鼠IgG、辣根过氧化物酶链接的抗兔IgG)均购于武汉博士德生物工程有限公司。MTS细胞增殖检测试剂盒购自Promega,Westem细胞裂解液和BCA蛋白浓度测定试剂盒均购自江苏碧云天生物制品有限公司。马钱子碱标准品,购自北京中国药品生物制品检定所(规格:20 mg/支,批号:110706-201306)。
1.2 细胞培养及药物处理 人慢性粒细胞白血病KCL-22细胞株由中山大学肿瘤防治中心惠赠。用含10 ml胎牛血清、100 U/ml链霉素、100 U/ml青霉素的RPMI 1640培养液培养细胞,置于5 ml/dl CO2,37℃,饱和湿度培养箱中传代培养,每2~3天换液传代1次,取对数生长期细胞进行实验。马钱子碱标准对照品(20 mg/支),为白色粉末状制剂,加入少许浓盐酸,待马钱子碱完全溶解后加入12.625 ml无血清RPMI 1640培养液,配制成浓度为1.280 mg/ml的储存液,用NaOH溶液调节pH值为7.2~7.4,0.22 μm微孔滤膜滤过除菌后,4℃保存备用。
1.3 MTS法检测细胞增殖 收集KCL-22细胞,RPMI 1640完全培养液重悬,接种于96孔板,使细胞密度为5×104/ml,每孔100 μl。设调零组(不接种细胞)、对照组(终浓度为0 μg/ml马钱子碱)与不同浓度的实验组(马钱子碱终质量浓度分别为50,100,200,400 μg/ml),每组设3个平行孔。置于培养箱中培养,24,48,72 h后加入MTS 试剂10 μl/孔,37℃避光孵育2 h,用酶标仪于490 nm波长处测定各孔的吸光度,计算细胞抑制率。抑制率(%)=(A对照组-A实验组)/A对照组×100%。
1.4 Annexin V-FITC/PI双染流式细胞术检测细胞凋亡 参照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书。收集经过0~400 μg/ml马钱子碱处理48 h的KCL-22细胞,PBS洗涤2次,用1×Binding buffer重悬,使细胞密度为1×106/ml,吸取400 μl细胞悬液分别移入5 ml流式管中,加入5 μl Annexin V-FITC混匀后室温避光孵育15 min,继续加入5 μl PI混匀后室温避光孵育5 min,迅速加入400 μl 1×binding buffer,使用流式细胞仪检测细胞凋亡状态。
1.5 Western blotting检测蛋白表达 分别收集终浓度为0,50,100,200,400 μg/ml马钱子碱作用48 h后的KCL-22细胞,PBS液洗3次。加入100 μl蛋白裂解液冰上裂解细胞30 min,4℃ 12 000 r/min,离心15 min,收集上清液,运用蛋白质定量试剂盒BCA法蛋白定量。12 g/dl十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离,转膜到醋酸纤维膜(NC)上。转膜成功后,50 g/L脱脂奶封闭1 h,分别加入一抗Bax,Bcl-2,Caspase-3,Caspase-9,Cyt-C和β-actin,4℃孵育过夜。TBST洗膜3次,每次5 min。37℃孵育二抗1 h。TBST洗膜3次,每次5 min。加入ECL发光试剂后在暗室曝光、显影、照相及结果分析。
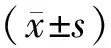
2 结果
2.1 马钱子碱对KCL-22细胞增殖的抑制作用 马钱子碱对白血病KCL-22细胞的增殖有明显的抑制作用。0~400 μg/ml马钱子碱抑制作用随药物浓度的增高和作用时间的延长而增大,呈明显的剂量和时间依赖性,各实验组(50,100,200,400 μg/ml)与对照组(0 μg/ml)相比,差异均有统计学意义(P<0.05),见图1。
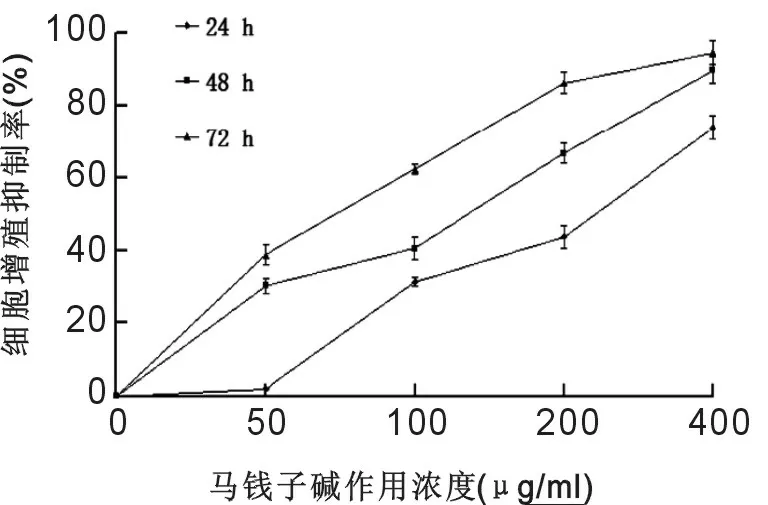
图1 不同浓度的马钱子碱作用24,48,72h后对白血病KCL-22细胞的增殖抑制影响
2.2 马钱子碱对白血病KCL-22细胞的凋亡作用 不同浓度的马钱子碱作用白血病KCL-22细胞48 h后,运用流式细胞术Annexin V-FITC/PI检测细胞凋亡状况,见图2A。经马钱子碱(0,50,100,200,400 μg/ml)作用后,KCL-22细胞的凋亡率分别为(1.2±0.25)%,(21.4±1.1)%,(35.2±2.71)%,(52.8±3.03)%和(68.6±2.87)%,凋亡率随着马钱子碱浓度的增加而逐渐上升(P<0.05)。其中,以早期细胞凋亡现象最为明显,并呈浓度依赖性,早期凋亡率达(50.7±1.4)%,见图2B。
2.3 细胞凋亡的信号通路检测 Western blotting结果显示,马钱子碱作用48 h后,KCL-22细胞内Pro-Caspase-9和Pro-Caspase-3随着药物浓度的增加表达减弱,并逐渐出现切割活化条带Cleaved-Caspase-9,Cleaved-Caspase-3。Cyt-C蛋白的表达水平随药物浓度增高而显著上升,呈现药物浓度依赖性。进一步检测马钱子碱对线粒体凋亡途径相关蛋白Bcl-2,Bax表达的变化。结果表明,抗凋亡蛋白Bcl-2的表达随药物浓度增加而减少,而Bax蛋白的表达却呈上升趋势,见图3。

A:流式细胞术检测细胞凋亡代表图;B:KCL-22细胞早期凋亡率。1):对照组.马钱子碱终浓度0 μg/ml;2):马钱子碱终浓度 50 μg/ml;3):马钱子碱终浓度100 μg/ml;4):马钱子碱终浓度200 μg/ml;5):马钱子碱终浓度400 μg/ml;*与对照组比较,P<0.05。
3讨论肿瘤细胞可通过逃脱程序性细胞死亡而实现恶性增殖[5]。因此,了解程序性细胞死亡的机制并设计诱导肿瘤细胞程序性死亡的治疗方法对治疗肿瘤尤为重要。慢性粒细胞白血病(chronic myeloid leukemia,CML) 是一种起源于造血干细胞的恶性克隆性疾病,表现为大量的不成熟白细胞数量增加,导致机体出现贫血、出血、感染及器官浸润等症状,主要发病在青壮年群体[6]。化疗是治疗CML的主要手段,然而,目前一线化疗药物治疗的效果并不理想,唯一治愈的方法是造血干细胞移植,但造血干细胞的供者缺少且治疗费用极高,因此寻找更为高效、低毒的治疗药物成为了燃眉之急。近年来,中药在抗肿瘤方面取得了很好的疗效,利用中药及其提取物治疗白血病,已经日益受到广泛重视。

图3 Western blotting法检测不同浓度马钱子碱处理KCL-22细胞后凋亡相关蛋白的表达
马钱子碱是从传统中药马钱子中提取的吲哚型结构的生物碱,体外研究发现,马钱子碱可显著抑制多种细胞的增殖,是近年来抗肿瘤研究较多的一种中药成分。已证实,马钱子碱具有抗多种血液肿瘤作用,且在一定范围内其作用呈剂量和时间依赖性[7~9]。本研究以慢性粒细胞白血病KCL-22细胞作为研究对象,探讨马钱子碱对其的作用。MTS结果显示,不同浓度马钱子碱对KCL-22细胞有不同程度的抑制作用,且抑制率随马钱子碱浓度的增大而升高,随作用时间的延长而升高,呈现明显的时间-剂量依赖性。
细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡,又称I型程序性细胞死亡(program rtled cell death,PCD),是近年来肿瘤治疗研究的热点之一。本研究运用Annexin V-FITC/PI双染流式细胞术证实了马钱子碱对KCL-22细胞的诱导凋亡作用,客观地显示了在0~400 μg/ml浓度范围内马钱子碱浓度与凋亡率的剂量效应关系。值得注意的是,马钱子碱以诱导细胞早期凋亡为主,并随着药物浓度的增强,早期凋亡率在一定范围内逐渐上升(图2)。Bcl-2家族蛋白作为细胞凋亡的重要调控因子,其主要作用部位是线粒体外膜[10]。研究表明[11],一般状态下易位到线粒体的Bax不断被线粒体上的Bcl-2等抗凋亡蛋白移回细胞质从而保证线粒体外膜正常的通透性。当细胞受凋亡信号刺激后,线粒体膜上的Bcl-2减少,引起Bax /Bcl-2比率增加,线粒体外膜通透性增大,使线粒体内的促凋亡物质Cyt-C等释放到包浆中,激活Caspase家族。Caspase家族蛋白的激活在细胞凋亡过程中扮演着重要角色,被认为是诱发凋亡的直接效应物。生理状态下Caspase以无活性的前体形式存在,在凋亡信号刺激下,线粒体膜通透性升高释放Cyt-C与Caspase-9前体形成凋亡小体的复合体,通过凋亡小体对线粒体通路的Caspase-9进行募集和自切割活化活化的Caspase-9切割活化下游的Caspase-3激活级联反应,活化的Caspase-3能裂解DNA,使DNA片段化,最终导致细胞凋亡出现形态学和生物学的改变[12],达到抑制细胞的增殖、促进细胞凋亡的效果。本研究的结果表明,在马钱子碱诱导KCL-22细胞凋亡的过程中,抗凋亡蛋白Bcl-2表达随着药物浓度的增加而递减,而凋亡蛋白Bax则相反,使得Bax/Bcl-2的比率增加,促使Cyt-C的释放,Cyt-C的表达量呈现剂量依赖的趋势,最终导致Caspase-9,Caspase-3被切割活化,提示马钱子碱可能通过调节Bax/Bcl-2,释放Cty-C,激活Caspase-9,Caspase-3依赖的内源性线粒体途径诱导KCL-22细胞发生不可逆凋亡。
综上所述,马钱子碱处理后可抑制慢性白血病KCL-22细胞增殖,并促进其凋亡,这种作用可能是通过调控Bax/Bcl-2平衡、释放Cyt-C及激活Caspase-9,Caspase-3实现的。我们将进一步探讨马钱子碱诱导KCL-22细胞凋亡的分子机制,为慢性粒细胞白血病的治疗提供新的思路和资料,也可更好地为临床治疗提供参考和帮助。
[1] 唐 敏,伍冠一,朱 婵,等.马钱子碱镇痛研究进展[J].中草药,2014,45(12):1791-1795.
Tang M,Wu GY,Zhu C,et al.Research progress on analgesic properties of brucine[J].Chinese Traditional and Herbal Drugs,2014,45(12):1791-1795.
[2] 杨福伟,王 辰,王光明,等.Brucine抗肿瘤的分子水平研究进展[J].中国老年学杂志,2014,34(17):5022-5024.
Yang FW,Wang C,Wang GM,et al.Research progre-ss on anti-tumor molecular level of Brucine[J].Chinese Journal of Gerontology,2014,34(17):5022-5024.
[3] Shu G,Mi X,Cai J,et al.Brucine,an alkaloid from seeds of Strychnos nux-vomica Linn,represses hepatocellular carcinoma cell migration and metastasis:the role of hypoxia inducible factor 1 pathway[J].Toxicol Lett,2013,222(2):91-101.
[4] Li P,Zhang M,Ma WJ,et al.Effects of brucine on vascular endothelial growth factor expression and microvessel density in a nude mouse model of bone metastasis due to breast cancer[J].Chin J Integr Med,2012,18(8):605-609.
[5] Qiu JX,He YQ,Wang Y,et al.Plumbagin induces the apoptosis of human tongue carcinoma cells through the mitochondria-mediated pathway[J].Med Sci Monit Basic Res,2013(19):228-236.
[6] Thompson PA,Kantarjian HM,Cortes JE.Diagnosis and treatment of chronic myeloid leukemia in 2015[J].Mayo Clin Proc,2015,90(10):1440-1454.
[7] 辛 菲,魏 武,纪爱芳,等.马钱子碱诱导人单核细胞白血病THP-1细胞凋亡及作用机制[J].中国实验血液学杂志,2014,22(3):681-686.
Xin F,Wei W,Ji AF,et al.Inducing-apoptosis effect of brucine on human monocytic leukemia cell line THP-1 and its mechanism[J].Journal of Experimental Hematology,2014,22(3):681-686.
[8] 李仙仙,魏 武,纪爱芳,等.马钱子碱对白血病细胞株HL-60的作用研究[J].白血病·淋巴瘤,2013,22(10):593-596.
Li XX,Wei W,Ji AF,et al.Effects of brucine on chronic myeloid leukemia cell line HL-60[J].Journal of Leukemia & Lymphoma,2013,22(10):593-596.
[9] 王海丽,魏 武,纪爱芳,等.马钱子碱对人白血病细胞株K562细胞的诱导凋亡作用[J].中国实验血液学杂志,2011,19(3):630-633.
Wang HL,We W,Ji AF,et al.Apoptosis-inducing effects of brucine on human chronic myeloid leukemia cell line K562[J].Journal of Experimental Hematology,2011,19(3):630-633.
[10] Ola M S,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1/2):41-58.
[11] Ashkenazi A.Targeting the extrinsic apoptotic pathway in cancer:lessons learned and future directions[J].J Clin Invest,2015,125(2):487-489.
[12] Goldar S,Khaniani MS,Derakhshan SM,et al.Molecular mechanisms of apoptosis and roles in cancer development and treatment[J].Asian Pac J Cancer Prev,2015,16(6):2129-2144.

