三孢布拉霉高产β-胡萝卜素菌株选育
■ 刘 星 刘姗姗 殷海松 乔长晟
(1.天津科技大学生物工程学院,天津300457;2.天津市现代职业技术学院,天津300350)
β-胡萝卜素作为一种饲料添加剂能够改变饲料颜色,具有增加畜类和禽类的食欲;增强某些水产品如虾类、蟹类的色泽;能够促进动物生长,提高肉类品质及其产率;提高鸡、鸭等禽类的产蛋率、受精率及蛋的孵化率,并能改善其蛋的色泽;提高马、牛和猪等牲畜的产仔率等作用。因此,被广泛应用于饲料行业。由于化学合成的β-胡萝卜素其生产过程可能会产生对人或动物有害的中间副产物,天然提取法提取的β-胡萝卜素价格相对较为昂贵,因此,利用微生物发酵法生产β-胡萝卜素作为饲料添加剂具有广泛的应用前景[1-3]。目前,利用三孢布拉霉发酵β-胡萝卜素具有工业化生产潜力。三孢布拉霉(Blakeslea trispora)是一种异宗接合的真菌,有正(+)、负(-)两种单性菌株。单独的正菌或者单独的负菌产β-胡萝卜素能力很低,几乎不产β-胡萝卜素。当两种单性菌株按一定比例混合后,其在有性繁殖阶段会产生性激素三孢酸。三孢酸能够刺激菌体使其β-胡萝卜素产量大大增高[4]。通过在筛选培养基中添加一定含量的三孢酸,刺激菌体产生β-胡萝卜素,从而使菌株形成的菌落由无色变为黄色,并且,菌株利用三孢酸产β-胡萝卜素能力越强,其形成的菌落颜色越深。根据经过紫外诱变前后形成的菌落颜色深浅对比,从诱变菌落中挑选较为经诱变的菌落颜色深的菌落做为目的菌株,从而大大提高筛选高产β-胡萝卜素菌株的效率。对工业微生物发酵法产饲料添加剂β-胡萝卜素的应用具有重要意义[5-8]。
1 材料与方法
1.1 菌种
三孢布拉霉(Blakeslea trispora)正(+)菌株、负(-)菌株,由天津科技大学微生物保藏中心保藏。
1.2 试剂
玉米淀粉、黄豆饼粉、磷酸二氢钾、七水硫酸镁、豆油、工业玉米浆、土豆、葡萄糖、酵母浸粉、琼脂、乳化剂OP、三孢酸标品(含量≥98%)、β-胡萝卜素标准品(≥98%)。
1.3 培养基
1.3.1 斜面培养基
土豆20%、葡萄糖2%、磷酸氢二钾0.05%、酵母浸粉0.1%、琼脂2%,pH值6.5~7.2(121℃灭菌20 min)。
1.3.2 种子培养基
玉米淀粉3.5%、黄豆饼粉2.3%、磷酸二氢钾0.15%、七水硫酸镁0.01%、豆油0.5%、工业玉米浆1%、pH值自然,500 ml三角瓶装100 ml(121 ℃灭菌20 min)。
1.3.3 发酵培养基
玉米淀粉3.0%、黄豆饼粉2.4%、磷酸二氢钾0.25%、七水硫酸镁0.02%、豆油3.5%、工业玉米浆2.0%、VB10.005%、柠檬酸三钠0.3%,pH值7.0(121℃灭菌20 min)。
1.3.4 平板初筛培养基
土豆20%、葡萄糖2%、磷酸氢二钾0.05%、酵母浸粉0.1%、琼脂2%、0.1%三孢酸、0.05%乳化剂OP,pH值7.0。
1.4 试验方法
1.4.1 斜面产孢培养
将正、负菌株分别接种至斜面培养基,28℃,避光培养5~7 d。
1.4.2 摇瓶种子培养
在无菌条件下,分别从正、负菌株试管斜面用接种铲沿菌苔表面产下约小拇指盖大小的菌苔,接种至装有100 ml种子培养基的500 ml摇瓶中。27℃、200 r/min,摇床培养48 h。
1.4.3 摇瓶发酵培养
将正、负菌株按1∶4比例混合,共10%的接种量,在无菌条件下,用灭过菌的10 ml移液管接种至发酵培养基。27 ℃、200 r/min,初始pH值7.0,500 ml装液100 ml,摇床振荡培养4 d。
1.4.4 β-胡萝卜素标准曲线的绘制
用分析天平精确称取0.010 0 gβ-胡萝卜素标品,溶于100 ml乙酸乙酯中。精确量取1 ml上述溶液,乙酸乙酯定容至100 ml,得到1 mg/lβ-胡萝卜素标液。再分别吸取1、2、3、4、5、6、7、8、9 ml上述溶液,分别用乙酸乙酯定容至10 ml,以乙酸乙酯为空白样,分别于454 nm处测其吸光值,得到一条y=0.194 7x,r2=0.999 4的标准曲线。
1.4.5 干菌体的获得
用800目尼龙滤布过滤种子培养与发酵培养的产物,保留菌体。将菌体用蒸馏水清洗2~3次后,用800目尼龙滤布将菌体裹住,轻轻挤压,将菌体间的水分尽量挤出。将残余水分基本挤干后,在电子天平上称量,得到菌体湿重。将湿菌体放入已经恒重过的培养皿中,在-40℃的条件下真空干燥至恒重,称量其重量。
1.4.6 β-胡萝卜素含量的测定
精确称取1.4.2得到的菌体,烘干,精确称取0.03 g。置于干净的研钵中。在阴暗避光的条件下,向研钵中加入2 ml的乙酸乙酯溶液,在通风橱中,快速研磨至菌体无色。将上述溶液全部吸取到25 ml容量瓶中,乙酸乙酯定容,混匀。精确吸取上述溶液1 ml至10 ml容量瓶,乙酸乙酯定容,摇匀。以乙酸乙酯为空白样,用分光光度计454 nm处测其吸光值,并根据所得标准曲线回归方程计算其β-胡萝卜素含量。
1.4.7 紫外诱变出发菌株的确定
在发酵培养基中添加0.1%的三孢酸,分别将正、负菌株单独接种至上述培养基,单独发酵培养,根据方法1.4.6测其β-胡萝卜素产量。以β-胡萝卜素产量为指标,确定出发菌株。
1.4.8 孢子悬液的制备
无菌条件下,新鲜的孢子斜面中加入一定量的无菌水,用接种针将孢子轻轻刮下。用灭过菌的在漏斗管道中塞有一定量棉花的漏斗除去菌丝体。将所得孢子液吸入装有100 ml无菌水(10颗玻璃珠)的500 ml锥形瓶中。200 r/min振荡5 min,使孢子分布均匀。将上述孢子悬液用血球计数板在显微镜下计数。进行孢子计数后,按一定比例,将孢子浓度稀释到 106个/ml。
1.4.9 致死率曲线绘制
将紫外诱变箱中的30 W紫外灯开启预热30 min之后,使紫外灯波长稳定,同时对箱内环境进行灭菌。将制备的孢子悬液在无菌条件下分装至灭过菌的6 cm平板中,每个平板里装液量为5 ml(平板中装有转子)。将含有孢子液及转子的平板置于紫外诱变箱中的磁力搅拌器上,打开磁力搅拌器,搅拌。掀开培养皿盖,开始紫外照射孢子悬液。计时。分别照射1、2、3、4、5、6、7、8 min后,分别将培养皿盖子盖上,取出培养皿。分别将上述溶液孢子液稀释涂布于平板上,菌落计数,计算致死率,绘制致死率曲线。
1.4.10 紫外诱变处理
根据1.4.5的致死率选择紫外照射时间进行紫外处理。处理方法参照1.4.5。
1.4.11 平板初筛
根据方法1.4.6对孢子悬液进行紫外诱变处理,稀释涂布在筛选培养基上,避光培养3~5 d后,至新长出的菌落成熟。与未经照射的孢子液在筛选平板上形成的菌落进行颜色对比。从中挑选出较未经紫外照射的孢子液形成的菌落颜色较深的菌落。将这些菌落进行编号后,用接种针将其挑起,在无菌环境下,挑至斜面培养基上,28℃,避光培养5~7 d,至孢子斜面成熟。得到目的菌株。
1.4.12 菌种纯化
将1.4.11得到的目的菌株与出发菌株的孢子洗下,稀释涂布于筛选培养基。28℃,避光培养,培养3~5 d后,形成菌落。比较菌落颜色深浅,将目的菌株形成的菌落颜色较出发菌株形成菌落颜色深的菌落挑下,接种于PDA斜面,28℃、避光培养5~7 d,至孢子斜面成熟。得到纯化的目的菌株。
1.4.13 摇瓶复筛
将经过纯化后的目的菌落在斜面培养基上生长至孢子成熟后,无菌条件下,用接种铲铲下一小块菌苔,接种于种子培养基。另一种单性菌株也按上述方法接种于种子培养基。27℃、220 r/min,培养2 d。按方法1.4.3进行发酵。
2 结果与讨论
2.1 紫外诱变处理出发菌株的确定(见图1)
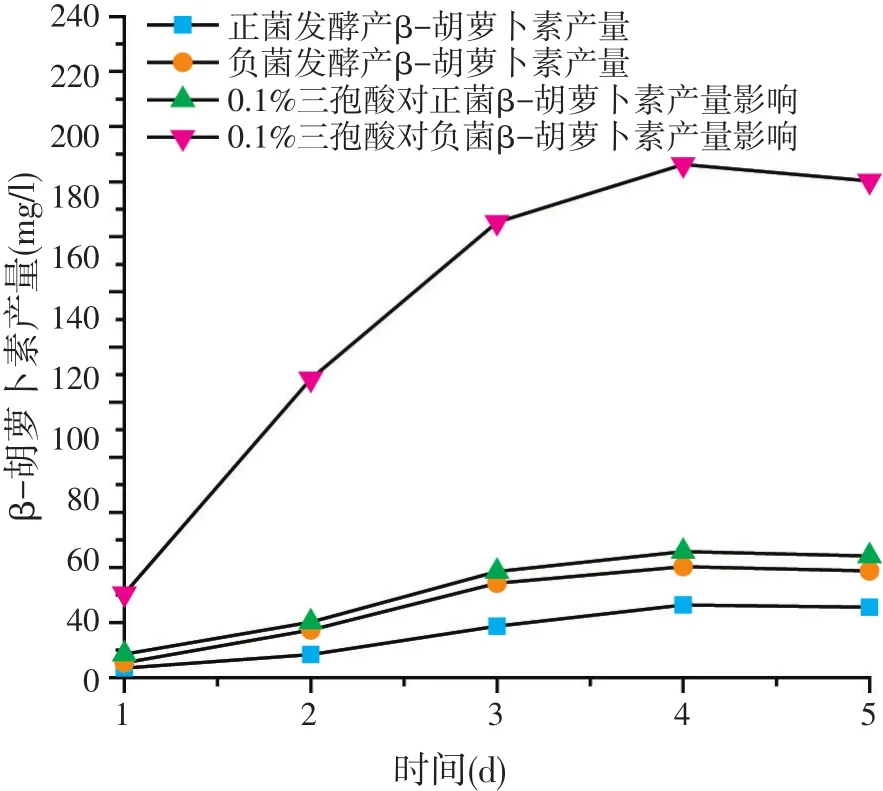
图1 三孢酸对正、负菌株产β-胡萝卜素的影响
由图1可看出,当发酵培养基中不添加三孢酸时,正菌发酵产β-胡萝卜素产量最高达到46.24 mg/l;负菌发酵产β-胡萝卜素产量最高达到57.23 mg/l。在发酵培养基中添加了0.1%的三孢酸之后,正菌的β-胡萝卜素产量达到63.28 mg/l;负菌的β-胡萝卜素产量最高达186.27 mg/l。由以上数据可以分析出,三孢酸能够刺激正菌和负菌产生β-胡萝卜素,使其产量均有所提高,但对负菌的影响效果显著。由此推测,负菌才是生产β-胡萝卜素的主产菌株;正菌起到的作用可能是与负菌在有性繁殖阶段配合负菌产生性激素三孢酸,从而刺激菌株产生β-胡萝卜素。因此,选择负菌作为紫外诱变的出发菌株进行紫外诱变处理。
2.2 致死率曲线(见图2)

图2 致死率曲线
诱变剂量一般选择致死率在70%~80%之间时对应的诱变剂量。但由于三孢布拉霉菌体细胞为多核单细胞结构,经过诱变得到的高产β-胡萝卜素菌株容易发生退化,因此,选择致死率稍高的诱变剂量。根据以上数据,选择致死率为约88%时的紫外照射时长,即紫外照射4 min。
2.3 平板初筛(见图3)
三孢布拉霉负菌在PDA平板上形成的菌落颜色呈无色,在添加了三孢酸的平板上形成的菌落呈黄色,初筛结果说明,三孢酸的加入能够刺激菌体产生β-胡萝卜素。经过紫外诱变处理之后形成的菌落由于其各自利用三孢酸产β-胡萝卜素的能力不同,其产生的菌落颜色深浅不一。利用三孢酸产β-胡萝卜素能力高的菌株,会形成颜色较出发菌株形成的菌落颜色深的菌落,如图3C箭头所指菌落。将这种菌落挑至斜面培养基并对其编号,得到目的菌株。将得到的菌株进行分离纯化,得到较纯化的目的菌株。
2.4 第一轮摇瓶复筛
将经过纯化的目的菌株进行第一轮摇瓶复筛,测定其β-胡萝卜素产量。由第一轮摇瓶复筛结果可以看出,根据菌落颜色深浅进行平板初筛得到目的菌株,将目的菌株经过摇瓶发酵测定其β-胡萝卜素产量后,大部分的目的菌株的β-胡萝卜素产量都较出发菌株有所提高,说明利用这种方法筛选高产β-胡萝卜素菌株是可行的。但存在少量的菌株产β-胡萝卜素能力较出发菌株有所下降的现象。造成这种现象的主要原因可能是因为菌株虽然利用三孢酸产β-胡萝卜素的能力有所提高,但其与正菌混合后,在有性繁殖阶段产三孢酸的能力有所下降,造成最后β-胡萝卜素总产量下降;也存在对菌落颜色深浅判断失误的可能性,没有较准确的挑选出目的菌落。
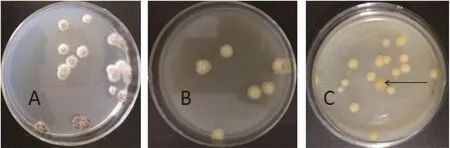
图3 平板初筛结果
2.5 第二轮摇瓶复筛
从第一轮摇瓶复筛得到的目的菌株中,挑选出β-胡萝卜素产量较出发菌株提高30%以上的菌株(见表1)。

表1 第二轮摇瓶复筛结果
2.6 遗传稳定性分析
经过紫外诱变后的目的菌株,可能会由于在传代过程中,由于遗传性状的不稳定性导致菌株产β-胡萝卜素能力发生退化。因此,将经过第二轮摇瓶复筛的菌株连续传五代,分析其每一代产β-胡萝卜素能力变化。经过连续五次传代后,其每代产β-胡萝卜素能力见表2。
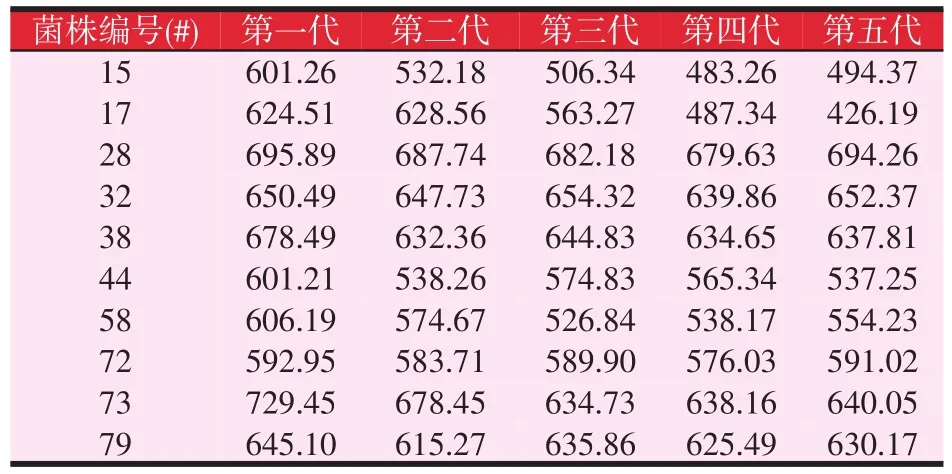
表2 遗传稳定性分析(mg/l)
由表2数据可知,73#菌株第一代β-胡萝卜素产量最高,较出发菌株提高59.72%,但经过连续五代传代之后,其β-胡萝卜素产量有所降低,降到了640.05 mg/l,较28#菌株的第五代产量694.26 mg/l低。并且,28#菌株在传代过程中,其每代β-胡萝卜素产量均较为稳定。因此,选择28#菌株作为目的菌株,经过五次传代后,其β-胡萝卜素产量为694.26 mg/l,较出发菌株β-胡萝卜素产量提高52.01%。
3 结论
确立了以负菌作为诱变出发菌株的育种思路,验证了利用三孢酸筛选β-胡萝卜素高产菌株的可行性。负菌株经过紫外诱变处理,平板初筛,分离纯化,摇瓶复筛,遗传稳定性分析后,从多个目的菌株中筛选出一株遗传性能稳定,较出发菌株产β-胡萝卜素能力提高52.01%,产量达694.26 mg/l的诱变菌株。

